宏基因组二代测序技术在假体周围感染中寻找病原菌的应用和价值
董文超,昝强,马建兵,卿忠,支力强*
(1.陕西中医药大学第一临床医学院,陕西 咸阳 712000;2.陕西中医药大学附属医院骨关节科,陕西 咸阳 712000;3.西安市红会医院关节外科,陕西 西安 710054)
人工关节置换术是治疗晚期关节病变的有效方法,而关节置换术后感染,又称关节假体周围感染(prosthetic joint infection,PJI),是关节置换术后灾难性的并发症[1],给患者造成了沉重的负担,且严重影响患者的生活质量[2]。文献报道初次膝、髋关节置换术后PJI发生率为0.7%~2.0%[3-4],而翻修术后PJI发生率5.6%~35.0%[5-7],并且这个数据随着国内老龄化的发展,人工关节置换患者基数的增长也在不断增大[8]。而PJI属于外科手术植入物的相关感染,常需进行再次手术和较长时间的抗生素治疗,明显增加患者的治疗费用及住院时间,严重影响疗效及患者的满意度[9]。PJI发生后如果能做到早期诊断并明确病原菌,大部分病例可获得较好的疗效,但延误诊断和无法及时针对性治疗,常会导致患者需要承受多次手术,接受多种抗生素治疗,更多的治疗花费,严重者甚至需要截肢手术甚至死亡[10-13]。因此,及时和准确的微生物诊断能有效指导医生选择合理的抗生素和处理方法,提高PJI的治愈率,才是PJI治疗成功的关键。
现今在术前诊断PJI时仍存在许多困难,传统的细菌培养技术是PJI诊断的金标准之一[14]。但结合以往研究及文献报道提示,传统的细菌培养对病原的检出率常不超过50%[15-16],可能的原因包括:慢性PJI的致病微生物被假体表面生物膜包裹;关节液和滑膜组织中的浮游菌量低;生物膜诱导微生物进入休眠状态,难以培养;部分微生物培养条件苛刻,常规培养困难;取材前应用抗生素,微生物生长受抑制等[17-18]。近年来宏基因组二代测序技术(metagenomic next-generation sequencing,mNGS)不断发展并在临床诊断领域得到广泛应用[19]。mNGS技术将高通量测序与生物信息学分析相结合,直接检测样本中的所有核酸,并将结果与对准工具进行比较,以确定样本中所有已知微生物的种类和丰度[20]。与传统细菌培养相比,mNGS不仅能够明显提高PJI患者的病原菌检出率,检出与细菌培养一致的病原菌,而且可以检出多种其他潜在的病原菌,检测耗时短,更有利于PJI的早期诊断和及时治疗,具有更高的应用价值。
由于mNGS技术在临床上并未普遍应用于PJI的诊断,关于其在PJI诊断的应用也鲜有报道,在PJI的诊治作用尚未明确。因此,本研究的目的是通过评估mNGS对关节液或滑膜组织中感染微生物的敏感性和特异性等诊断性能指标,统计在mNGS指导下靶向用药治疗所需的治疗时间、花费及使用抗生素后可能出现的不良反应等,将其结果与传统培养技术相比来确定该技术在对PJI的诊断性能和治疗花费及时效性上是否具有差异。
1 资料与方法
1.1 纳入及排除标准 2019年1月至2021年1月西安市红会医院关节科收治的进行了关节翻修术疑似膝关节或髋关节置换术后PJI和无菌性松动(aseptic loosening,AL)的患者进行了筛查。纳入标准如下:(1)患者年龄>18岁;(2)既往行全膝关节置换术(total knee arthroplasty,TKA)或全髋关节置换术(total hip arthroplasty,THA)失败需要二次翻修患者;(3)参考2018年费城共识对于PJI的诊断标准[21]分为PJI或AL;(4)签署手术及研究知情同意书;(5)收集到足够的关节液或滑膜组织进行细菌培养和mNGS检测。排除标准:(1)临床资料或检查不足以明确是否为PJI或AL;(2)用于mNGS检测的关节液或滑膜组织量过少;(3)采样、转运或处理标本的过程中明显污染,以及可能影响实验室试验结果的炎症性疾病或恶性肿瘤的患者;(4)提取DNA浓度量过低无法建立测序文库,或者建库后量过低无法上机测试。
1.2 一般资料及分组情况 60例患者符合纳入标准,38例膝关节及22例髋关节。PJI组42例,男16例,女26例;年龄29~82岁,平均(64.33±13.03)岁;AL组18例,男6例,女12例;年龄44~85岁,平均(62.50±9.78)岁。两组患者年龄比较差异无统计学意义(P=0.801);PJI患者术前关节液中白细胞计数、C反应蛋白及红细胞沉降率指标均明显高于AL组,差异有统计学意义(P<0.05);两组中性粒细胞百分比比较差异无统计学意义(P=0.114,见表1)。进一步选取于2017年1月至2018年12月仅行常规培养阴性的PJI患者20例,作为经验性抗生素组(empirical antibiotic group,EA);2019年1月至2021年1月行mNGS检测的20例PJI患者作为靶向抗生素组(targeted antibiotic group,TA)。对两组患者进行至少6个月的随访,统计分析两组在抗生素使用时间、住院抗生素花费、不良反应例数及复发病例的差异。不良反应主要包括肝功能损害(谷丙转氨酶或谷草转氨酶峰值>1.5倍正常上限值)、肾功能损害(血清肌酐值>1.5倍初始值)及药疹(排除其他原因,全身或局部皮疹)。

表1 PJI与AL组患者术前一般资料比较
1.2 关节液或假体周围组织标本采集及微生物培养 术前收集关节液、术中收集关节液或滑膜组织分别送常规培养和mNGS检测,测序组将采集的关节液或滑膜组织置入一次性容器内,样本容器应密闭、无菌、无核酸酶及其他扩增抑制物并立即送至测序机构。对未能及时送达的标本于-80 ℃冰箱保存,待第2天送检。余下的关节液或滑膜组织在室温下15min内送至微生物室微生物培养。选用illumina Next Seq 550Dx测序仪平台进行高通量测序,之后使用PACE seq检测进行生物信息学对比分析,对微生物进行鉴定,具体测序流程见图1。
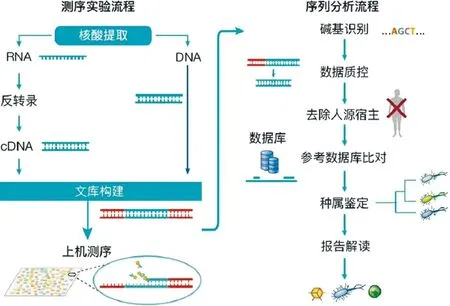
图1 mNGS测序实验及序列分析流程
与测序机构合作提出置信度指标,置信度为“高”,建议临床重点关注。置信度为“中”的微生物可能来自于采样环节、定植微生物或环境微生物,需要结合临床进行判读,如有必要请后续再次送样进行检测。该指标通过样本测序量、检出序列数、微生物基因组大小、覆盖度、质控情况等多个维度综合分析得出,体现了该微生物为致病菌的可能性。

2 结 果
2.1 实验室微生物培养和mNGS检测结果 42例PJI患者的细菌培养中30例为阳性,mNGS检测有40例阳性;18例AL患者的细菌培养结果2例为阳性,mNGS检测有7例结果为阳性。细菌培养共检出12种病原菌,mNGS检测共检出31种病原菌。占比数最高的两种病原菌分别为表皮葡萄球菌(22%)及金黄色葡萄球菌(12%),检测结果包括2例真核微生物黄曲霉和7例病毒(见图2)。PJI组30例细菌培养阳性的患者中,29例mNGS检测阳性;其中16例与培养结果在种属水平完全一致,3例与培养结果完全不一致,1例在属水平一致,9例mNGS检测出和微生物培养结果一致外的更多病原菌。
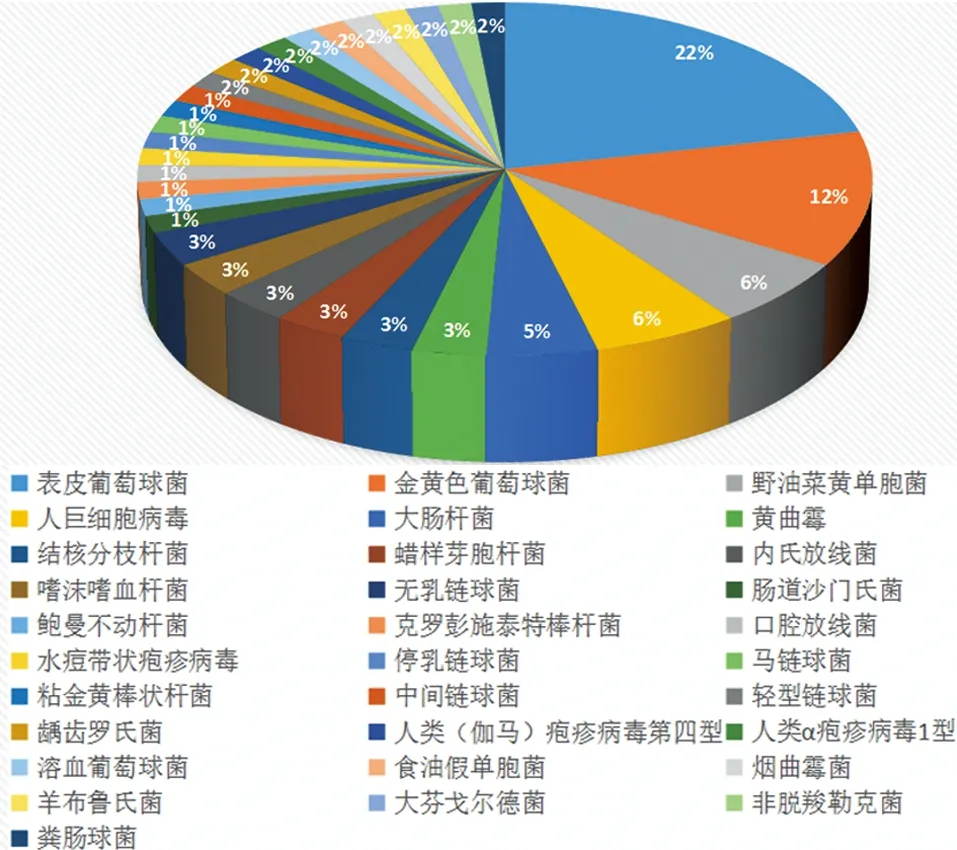
图2 mNGS病原菌检测结果
2.2 实验室微生物培养和mNGS检测针对关节置换术后PJI诊断效率比较 将2018年费城共识中PJI诊断标准作为“金标准”来计算传统培养和mNGS检测的敏感度、特异度、阳性预测值、阴性预测值及一致率。结果显示mNGS组敏感度明显大于培养组;mNGS组特异度61.1%低于培养组94.4%,mNGS的一致率85.0%大于培养组的60.0%;mNGS的检出时间(1.87±0.39)d明显低于培养组的(5.55±0.65)d,差异均具有统计学意义(P<0.05)。在阳性预测值及阴性预测值的两组间比较均无统计学意义(P>0.05,见表2)。

表2 实验室微生物培养和mNGS检测对关节置换术后PJI的诊断效率
2.3 EA组和TA组抗生素使用及经济学比较 20例TA组PJI患者在静脉抗生素使用时间为(10.15±1.50)d,对照组EA组静脉抗生素使用时间为(14.52±2.00)d;TA组住院治疗间抗生素费用为(6 149.15±763.06)元,对照组EA组的住院抗生素治疗费用为(10 874.70±1 353.63)元,两组在静脉抗生素使用时间及住院间抗生素治疗花费的差异均具有统计学意义(P<0.05)。TA组出现1例肝功能损害;EA组出现7例不良反应,包括4例肝功能损害、2例肾功能损害和1例药疹。两组在使用抗生素发生不良反应的差异上具有统计学意义(P=0.044);随访1年EA组2例感染复发,TA组无一例感染复发。
2.4 mNGS耐药基因及药敏名单与对比 对于置信度为“高”且达到一定的覆盖度的结果,尝试根据CARD(comprehensive antibiotic resistance database)数据库进行耐药基因预测报告8例,mNGS结果与培养结果相符率可达87.5%(7/8)。证明mNGS结果可以指导临床用药,通过早期针对性用药有效抑制病原菌繁杂,减少抗生素使用时间,达到减轻病患痛苦、减少治疗花费的目的。部分置信度为“高”患者的耐药基因预测结果见表3。

表3 患者的耐药基因预测结果
3 讨 论
PJI是关节置换术后的一种灾难性并发症,其诊断及治疗仍存在许多挑战。无论选择何种治疗方式,关键是需要明确病原菌。病原菌不能明确难以有针对性的选择抗生素,治疗效果往往不理想,且容易产生耐药性,延误治疗,甚至引起严重的并发症。而准确识别关节置换术后PJI中的感染病原菌,可以提高感染控制率[12,22-23]。文献资料报道[24-25]传统细菌培养敏感性较低,在关节置换术后PJI病原菌的检测能力上有所不足,难以找到致病菌,影响抗生素的使用;在检测时间上偏长,不能早期针对性使用抗生素治疗,会进一步增加患者的痛苦和经济负担。
近年来mNGS技术被尝试性的试用于临床感染患者的病原菌诊断,有研究表明,mNGS技术提高了口腔感染、颅内感染和肺部感染等传染病致病微生物的检测率[26]。有一些关于使用mNGS进行PJI诊断的报道,其结果显示出良好的敏感性和特异性[27],同时mNGS可以检测到滑液培养鉴定的大多数病原菌(物种水平82.9%,属水平90.2%)以及一些未经培养鉴定的病原菌。Street等[28]还证明,mNGS的物种级敏感性为88%(95%可信区间,77%~94%),属级敏感性为93%(95%可信区间,84%~98%),物种级特异性为88%(95%可信区间,79%~93%)。此外,一些微生物如唾液酸支原体,不能通过常规培养检测,可以通过mNGS精确地识别出来[29]。与传统细菌培养相比,mNGS不仅能够明显提高PJI患者的病原菌检出率,检出与细菌培养一致的病原菌,而且可以检出多种其他潜在的病原菌。检测耗时短,更有利于PJI的早期诊断和及时治疗,具有更高的应用价值。
本研究共纳入60例患者(42例PJI,18例AL),有32例患者微生物培养结果呈阳性,敏感性、特异性、阳性预测值、阴性预测值和一致率分别为71.4%、94.4%、93.8%、33.3%和60.0%。47例患者的mNGS结果呈阳性,敏感性、特异性、阳性预测值、阴性预测值和一致率分别为95.2%、61.1%、85.1%、84.6%和85.0%。研究表明,术中收集的关节液和滑膜组织mNGS的敏感性优于微生物培养,7例初次诊断为AL的患者关节液或滑膜组织中发现了病原菌,结果可能与关节中存在慢性微生物的定植有关,费城共识中指出关节置换术后患者关节内存在慢性持续的定植。事实上,这是来自皮肤且可形成生物膜的无害(低毒力)微生物所造成感染的基本特征[30]。关于原生关节在何种程度上也存在这些微生物群的资料相当有限,一些针对明显未感染个体关节液的微生物学研究为这一假设提供了支持性证据。此外,一些研究通过细菌培养或严格的分子技术从肩关节液中鉴定出细菌[31-33]。研究结果说明,mNGS检测具有强于微生物培养的病原菌识别能力,这有助于我们排除一些假阴性患者,帮助临床精确诊断、减少误诊。在病原菌的检出所需时间上,mNGS相较于传统微生物培养也更具优势,mNGS组(1.87±0.39)d明显低于培养组的(5.55±0.65)d,这使我们可以尽早根据mNGS检测结果针对性的进行治疗,有利于PJI的早期诊断和及时的治疗。
PJI造成的经济负担也是值得关注的问题,患病率和住院费用也呈上升趋势[34]。因此,仔细和持续地监测这些趋势及其相关的经济负担是至关重要的。由于传统细菌培养所需的时间较长,灵敏度较低,在治疗上往往会经验性的对这些PJI患者使用抗生素,从治疗效果和时间上无法与明确病原菌针对性用药相比。本研究中对两组40例患者的治疗时间和花费进行了研究,EA组患者在抗生素的使用时间上(14.52±2.00)d明显长于TA组的(10.15±1.50)d,EA组在治疗过程中产生了多于TA组的抗生素花费,并且EA组报道了7例不良反应多于TA组的1例,这可能与EA组难以准确针对致病菌使用抗生素有关。本研究探索性地提供耐药基因检测报告为临床抗生素使用提供指导,通过判读部分置信度为“高”,达到一定的覆盖度的耐药基因预测报告,得到mNGS结果与培养结果相符率可达87.5%。虽然基因型并不等于表达,测到耐药基因不代表一定耐药,但这对临床早期正确选择抗生素,避免因抗生素耐药而延误PJI患者的治疗仍具有一定指导意义。
本研究仍存在一些不足,如本研究是一个样本量相对较小的单一中心研究(PJI组42例患者,AL组18名患者),有必要进行具有大量样本的多中心研究;选择2018年制定的新PJI诊断标准为金标准[21],也可能造成个别病例的分组错误,mNGS检测结果需要的read数较高,否则检出灵敏度低容易导致假阴性。此外,mNGS也对污染高度敏感,因此对mNGS检测呈阳性结果,尤其是对于微生物培养阴性的PJI,应考虑患者的病史和实验室试验结果。总之,mNGS可以有效地识别PJI患者的病原菌,特别是在那些传统培养难以检出的病原菌或最近使用抗生素引起的阴性培养的情况下。mNGS表现出比传统培养更高的灵敏度,其在PJI的诊断中具有更大的诊断价值。本研究结果认为应在临床中将mNGS与传统微生物培养结果结合判读,这对于帮助临床诊断PJI致病菌具有重大意义。

