香蕉钾转运体HAK/KUP/KT家族鉴定及其在果实发育和低钾胁迫下的表达分析
金龙飞 张安妮 滕梦鑫 李新国




摘要:钾是香蕉生长发育中需求量最大的营养元素,对果实产量、品质和贮藏性都有重要的影响。从香蕉基因组中鉴定出24个HAK/KUP/KT(MaKUP)基因,并对其理化性质、染色体定位、基因结构、保守功能域、进化关系、组织表达和低钾胁迫下的表达特征进行分析。结果表明,MaKUP编码的肽链平均有772个氨基酸,分子量为63.54~93.82 ku,等电点为5.44~9.30,蛋白不稳定指数为32.69~44.29,脂肪族指数为105.34~116.90,总平均亲水性为 0.352~0.549,含有8~11个外显子,可分为4个亚族;表达分析发现15个MaKUP基因家族成员在香蕉不同发育时期的果实中高表达,6个MaKUP基因家族成员在低钾胁迫中上调表达,表明MaKUP在香蕉果实发育和钾吸收中具有重要的作用。
关键词:香蕉;钾;HAK/KUP/KT;基因表达;低钾胁迫
中图分类号:S668.101 文献标志码: A
文章编号:1002-1302(2022)02-0030-07
收稿日期:2021-04-15
基金项目:国家自然科学基金(编号:31760549);海南省自然科学基金(编号:320RC485);海南省热带园艺作物品质调控重点实验室科研项目[编号:HNZDSYS(YY)-01]。
作者简介:金龙飞(1988—),男,湖北荆门人,博士,助理研究员,主要从事热带作物栽培研究。E-mail:jlf_0511@163.com。
通信作者:李新国,博士,教授,主要从事果树种质资源与遗传改良研究。E-mail:lixinguo13@163.com。
钾是植物细胞中最多的阳离子,含量占植物干质量的2%~10%。钾参与植物跨膜转运、维持细胞电荷平衡、酶的活化、光合作用、渗透调节和气孔运动等众多的生命活动过程[1]。缺钾会严重影响作物的产量和品种。植物中的钾离子转运蛋白主要包含Shaker通道、KCO/TPK通道、HAK/KUP/KT(后簡写为KUP)转运体、Trk/HKT转运体和K+/H+逆向转运体,其中KUP转运体是钾转运系统中最早发现的数量最多、功能最丰富的钾转运体[2]。KUP转运体最早在大肠杆菌中被发现[3],因其具有钾吸收功能,被命名为钾吸收透性酶(K+uptake permease,简称KUP),该转运体可使酵母在外界K+浓度极低的条件下仍能保持较高的细胞内K+浓度,因此也被命名为高亲和性K+转运体(high-affinity K+transporter,简称HAK)[4],在拟南芥中的研究发现其具有钾转运功能,也被命名为K+转运体(K+transporter,简称KT)[5]。随着大量植物基因组序列的公布,KUP基因家族也在水稻[6]、小麦[7]、大豆[8]、棉花[9]、甘蔗[10]、大白菜[11]、茶树[12]等作物中被鉴定出来。高钾亲和力的KUP的表达通常受低钾胁迫的诱导,在玉米中过表达高亲和性钾转运体基因ZmHAK5可以提高玉米在低钾条件下对钾的吸收能力,促进根系的生长[13]。
香蕉是典型的喜钾作物,植株的钾含量高达7.16%,果实中钾含量高达13.7 mg/g[14-15]。氮钾肥(N ∶K2O)施用比例为1 ∶1.12~1 ∶1.20时,果实农艺性状最佳、品质最优、产量最高,较对照处理增产高达16.1%[16]。然而对于香蕉钾吸收、转运和利用相关的分子机制还少见报道。随着香蕉AB基因组测序的完成,基于全基因组信息挖掘和鉴定香蕉钾转运蛋白并分析其与钾素吸收的特性,能够从基础研究的层面解析香蕉钾素吸收的分子机制,为香蕉通过遗传改良提高养分利用效率奠定理论基础。本研究基于香蕉基因组数据,利用生物信息学方法鉴定MaKUP基因家族成员,并从基因及蛋白结构、基因在各组织中的表达模式及基因在低钾胁迫下宝岛蕉的表达模式等3个方面进行分析,以期初步解析香蕉中MaKUP基因在果实发育和低钾响应中的作用。
1 材料与方法
1.1 试验材料
供试品种为宝岛蕉(Musa AAA Cavendish,cv. Baodaojiao),来自中国热带农业科学院组培中心,苗高约20 cm,长势一致,5叶1心,心叶未展开,无病虫害。将袋装宝岛蕉幼苗取出,洗净根系转入清水中进行适应性培养,待新根长出后,依次换1/4、1/2和全营养阿夫多宁营养液,每5 d更换1次培养液。培养条件为光照强度75 μmol/(m2·s),光照时间14 h/d,昼夜温度27 ℃,相对湿度85%~90%,每 3 h 通气15 min。试验时间为2020年10月至2021年2月。
1.2 试验方法
1.2.1 水培和低钾处理 采用水培对供试材料进行低钾胁迫处理,低钾胁迫处理的钾浓度为4 mg/L,以全营养液作为对照(钾浓度为40 mg/L),3株1个处理,每个处理重复3次。低钾处理后1、3、6、12、24 h采集2 cm的根尖,液氮速冻后,保存在 -80 ℃ 冰箱中。
1.2.2 MaKUP基因家族的生物信息学分析 从香蕉基因组数据库中下载基因的编码序列(CDS)、基因序列、蛋白序列、启动子序列以及在香蕉各组织中的表达数据(RPKM值)。利用ExPASy(https://web.expasy.org/protparam/)分析蛋白序列的氨基酸数量、等电点、分子量;利用CD-Search Tool(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)分析结构域,利用MEME(http://alternate.meme-suite.org/tools/meme)分析保守基序,使用TBtools软件绘制热图[17];利用GSDS 2.0(http://gsds.cbi.pku.edu.cn/index.php)分析基因结构;利用MEGA 6.0软件绘制进化树。
1.2.3 香蕉根尖总RNA的提取、cDNA的合成和荧光定量PCR 采用植物总RNA提取试剂盒(DP432)[天根生化科技(北京)有限公司]提取香蕉根尖总RNA,具体方法参照说明书。为防止RNA降解,所用试验耗材(枪头、离心管)均为RNase-free,研钵与研磨棒用锡箔纸包裹后180 ℃干热灭菌4 h,冷却待用。利用琼脂糖凝胶电泳与紫外分光光度法检测RNA的浓度、纯度与完整度,保证RNA条带28S与18S的亮度在2 ∶1,5S条带亮度弱,D260 nm/D280 nm在1.9~2.1之间。采用EasyScript First-Strand cDNA Synthesis SuperMix(北京全式金生物技術有限公司)合成cDNA,具体方法参照说明书。采用PowerUPTM SYBRTM Green Master Mix(Thermo Scientific公司)进行基因表达分析,具体方法参照试剂盒说明书,在Applied Biosystems 7500上进行荧光定量PCR反应,所用引物序列见表1。每个样品设置3个生物学重复及3个机械重复,以actin为内参基因,以未进行低钾胁迫的样品作为参照,根据2-ΔΔCT法进行相对表达量的计算。
1.2.4 数据处理 采用SPSS 13.0进行数据分析,采用Duncan’s检测法进行差异显著性分析。
2 结果与分析
2.1 MaKUP基因家族成员的理化性质
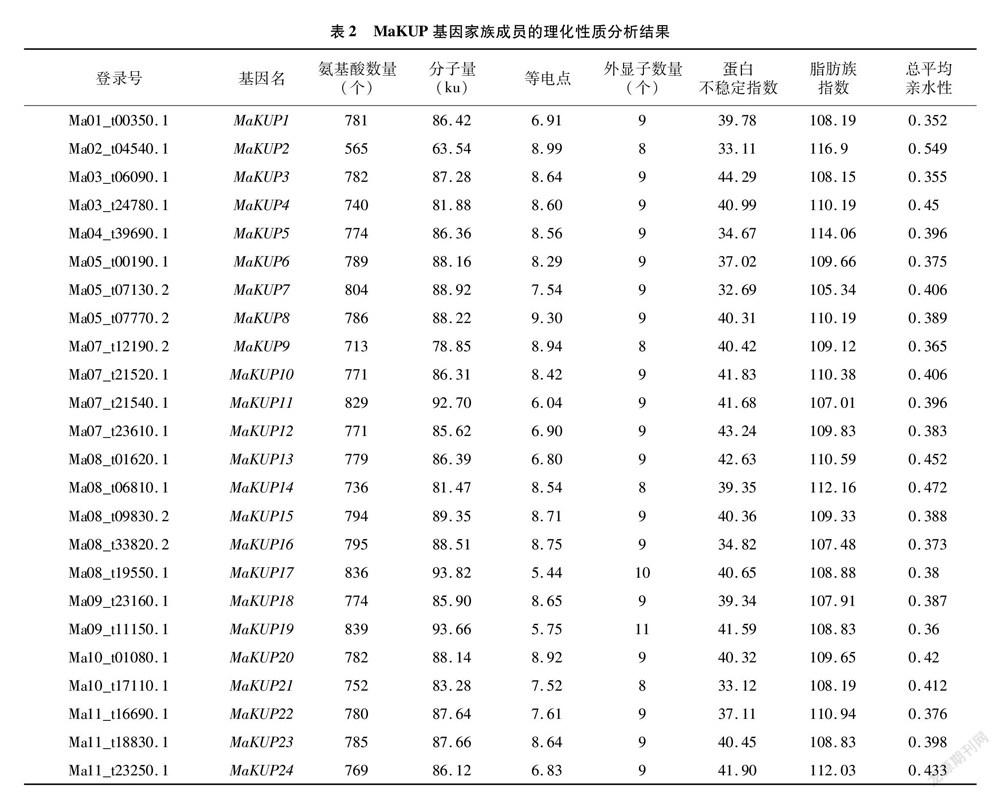
通过Blastp将拟南芥和水稻的KUP基因家族的氨基酸序列与香蕉A基因组数据进行比对,得到的候选基因进行保守结构域分析,共获得24个MaKUP基因家族成员,根据其在染色体上排列顺序,依次命名为MaKUP1~MaKUP24。香蕉MaKUP多肽链氨基酸数量为565~839个,平均值为772个;分子量为63.54~93.82 ku,平均值为86.09 ku;等电点为5.44~9.30,平均值为7.89;外显子数量为8~11个,都具有钾转运体结构域,蛋白不稳定指数为32.69~44.29,平均值为39.24,10个为稳定蛋白,14个为不稳定蛋白(蛋白不稳定指数>40);脂肪族指数为105.34~116.90,平均值为109.74;总平均亲水性为0.352~0.549,平均值为0.403,都为正值,表明MaKUP蛋白均表现为疏水性(表2)。
2.2 MaKUP基因家族成员在染色体上的定位
对MaKUP基因家族成员在染色体上的位置进行分析,发现24个MaKUP基因家族成员分布在10条染色体上。MaKUP1在chr01上,MaKUP2在chr02上,MaKUP3和MaKUP4在chr03上,MaKUP5在chr04上,MaKUP6、MaKUP7和MaKUP8在chr05上,MaKUP9~MaKUP12在chr07上,MaKUP13~MaKUP17在chr08上,MaKUP18和MaKUP19在chr09上,MaKUP20和MaKUP21在chr10上,MaKUP22~MaKUP24在chr11上。MaKUP4和MaKUP14,MaKUP6和MaKUP22,MaKUP15和MaKUP23,MaKUP16和MaKUP18存在基因共线性现象(图1)。
2.3 MaKUP基因家族成员的进化关系和保守基序
进化分析将MaKUP基因家族成员分为4个大类,MaKUP1、 MaKUP3、 MaKUP10、MaKUP12、MaKUP13、MaKUP18、和MaKUP24聚为一类,MaKUP4、MaKUP7、MaKUP8、MaKUP14、MaKUP15、MaKUP20和MaKUP23聚为一类,MaKUP2、MaKUP5、MaKUP6、MaKUP11、MaKUP16、MaKUP17、MaKUP19、MaKUP21和MaKUP22聚为一类,MaKUP9单独为一类(图2)。利用MEME在线工具对香蕉MaKUP蛋白的保守基序进行分析,得到10个保守基序,除了MaKUP2以外,都含有10个保守基序(图2)。
2.4 MaKUP基因家族成员在不同组织和果实发育不同时期的表达特征
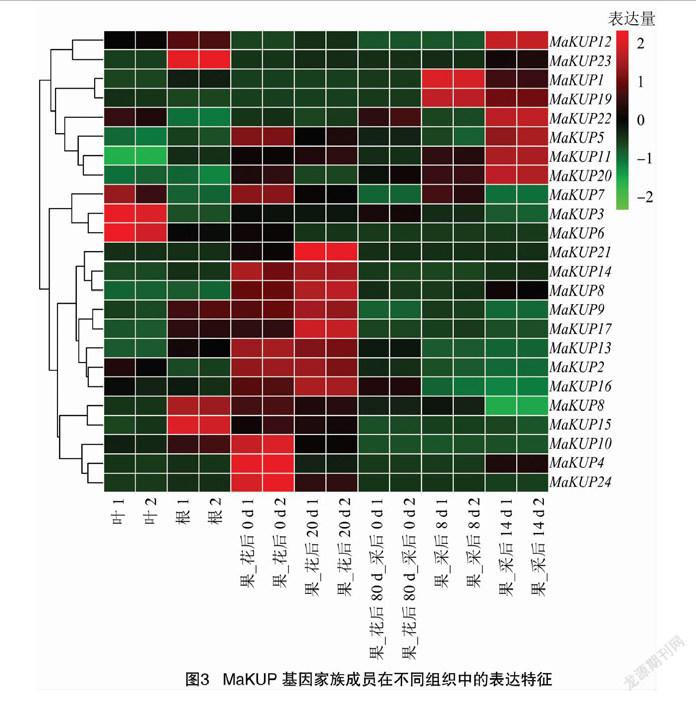
MaKUP基因家族成员在香蕉不同组织和果实不同发育时期表达量差异较大,其中MaKUP3、MaKUP6和MaKUP7在叶中的表达量较高,MaKUP8、MaKUP15和MaKUP23在根中的表达量较高,MaKUP2、MaKUP4、MaKUP10、MaKUP13、MaKUP14、MaKUP24在花后0 d表达量较高,MaKUP2、MaKUP9、MaKUP13、MaKUP14、MaKUP16、MaKUP17、MaKUP18、MaKUP21在花后20 d表达量较高,MaKUP1和MaKUP19在采后8 d的果中表达量较高,MaKUP5、MaKUP11、MaKUP12、MaKUP20和MaKUP22在采后14 d的果中表达量较高(图3)。
2.5 MaKUP基因家族成员在低钾胁迫下的表达特征
采用荧光定量PCR对低钾胁迫处理0、1、3、6、12、24 h后24个MaKUP基因家族成员在香蕉根尖中的表达特征进行分析,发现6个MaKUP基因家族成员受到低钾胁迫的诱导,其表达量逐渐升高,达到峰值后逐渐降低。其中MaKUP1、MaKUP3、MaKUP14、MaKUP20和MaKUP22在低钾胁迫处理3 h后相对表达量达到峰值,分别是对照的10、12、5、16、4倍;MaKUP21的相对表达量在低钾胁迫处理12 h后达到峰值,是对照的5倍,在低钾胁迫处理24 h又迅速降低(图4)。
3 讨论与结论
香蕉是重要的热带果树,其产量和品质与钾元素含量密切相关,KUP是编码植物钾吸收的重要转运体基因,已在水稻[6]、小麦[7]、棉花[9]等多个作物中被鉴定出来,而在香蕉中尚未见报道。本研究基于香蕉基因组数据筛选得到24个MaKUP基因家族成员,经过基因结构、保守结构域和保守基序分析,发现都含有典型的钾转运结构域,鉴定都是钾转运体。染色体定位发现24个MaKUP基因家族成员均
匀分布在10个染色体上,其中8个基因存在基因共线性,这可能是由于基因复制产生的。基因复制事件能够导致植物基因组中形成大量的重复基因,而重复基因的存在能够促进基因新功能的进化,增强植物对环境变化的适应性[18],8个共线性的基因可能是香蕉适应高钾需求的一种进化机制。进化树和保守基序分析发现MaKUP基因家族成员可分为4个亚类,除了MaKUP2以外,都含有10个保守基序,这表明MaKUP在进化中功能比较保守。
植物的KUP基因广泛分布在各个组织和器官中,在钾吸收和转运中起着重要的作用。在水稻中5个KUP基因(OsHAK2、OsHAK10、OsHAK15、OsHAK23和OsHAK25)在3个品种的所有组织中都有表达[19],在茶树中CsHAK3在8个组织中持续高表达[12]。本研究中发现MaKUP基因家族成员在香蕉的根、叶、不同发育时期和不同采后时期的果实中都有表达,不同成员在不同组织中表达差异较大,其中8个MaKUP基因家族成员在香蕉果实发育前期高表达,7个MaKUP基因家族成员在采后的香蕉果实中高表达,这表明MaKUP基因在果实发育成熟过程中和钾元素的转运中起重要作用,这可能也是香蕉果实钾含量高的主要原因。
在低钾胁迫下植物一方面通过增加根系面积提高与土壤的接触面积,另一方面通过激活高亲和钾吸收系统,增加对钾的获取能力[20]。KUP/HAK/KT转运体家族成员按照对钾的亲和性可分为高亲和性钾转运体、低亲和性钾转运体和双亲和性钾转运体3类,在植物钾吸收和长距离运输中起着重要的作用[2]。AtHAK5是典型的高亲和性钾转运子,主要定位在拟南芥根部的上皮细胞和中柱中,其表达受到低钾胁迫的诱导,对根系钾吸收起着重要的作用[21]。在茶树中的研究发现鉴定的21个KUP基因家族成员,其中CsHAK5、CsHAK7、CsHAK8、CsHAK11、CsHAK12、CsHAK18、CsHAK19、CsHAK20和CsHAK21的表达受到低钾胁迫的诱导[12]。在本研究中6个MaKUP基因(MaKUP1、MaKUP3、MaKUP14、MaKUP20、MaKUP21和MaKUP22)受到低钾胁迫的诱导,表明这6个MaKUP基因可能是高亲和钾转运体,在低钾胁迫下可以通过上调MaKUP基因的表达,提高香蕉对钾的吸收能力。KUP不仅在植物根吸收钾中起着重要的作用,还参与叶片对钾吸收的转运,在桃叶面喷施钾肥后PPeKUP1、PPeKUP2和PPeKUP7的表达量显著上调[22],在本研究中MaKUP3和MaKUP6在叶片中的表达量明显高于其他组织,表明这2个基因可能参与香蕉叶片对钾的吸收。
本研究采用生物信息学方法从香蕉基因组中鉴定出24个MaKUP基因家族成员,表达分析发现MaKUP基因家族成员在香蕉的根、葉和果中均有表达,其中15个MaKUP基因家族成员在果实发育中高表达,6个MaKUP基因家族成员受到低钾胁迫的诱导,表明MaKUP基因在香蕉果实发育和钾吸收中具有重要的作用。
参考文献:
[1]Wang M,Zheng Q S,Shen Q R,et al. The critical role of potassium in plant stress response[J]. International Journal of Molecular Sciences,2013,14(4):7370-7390.
[2]Li W H,Xu G H,Alli A,et al. Plant HAK/KUP/KT K+transporters:Function and regulation[J]. Seminars in Cell & Developmental Biology,2018,74:133-141.
[3]Epstein W,Kim B S. Potassium transport loci in Escherichia coli K-12[J]. Journal of Bacteriology,1971,108(2):639-644.
[4]Bauelos M A,Klein R D,Bowman S J A,et al. A potassium transporter of the yeast Schwanniomyces occidentalis homologous to the Kup system of Escherichia coli has a high concentrative capacity[J]. The EMBO Journal,1995,14(13):3021-3027.
[5]Quintero F J,Blatt M R. A new family of K+transporters from Arabidopsis that are conserved across phyla[J]. FEBS Letters,1997,415(2):206-211.
[6]Amrutha R N,Sekhar P N,Varshney R K,et al. Genome-wide analysis and identification of genes related to potassium transporter families in rice (Oryza sativa L.)[J]. Plant Science,2007,172(4):708-721.
[7]Cheng X Y ,Liu X D,Mao W W,et al. Genome-wide identification and analysis of HAK/KUP/KT potassium transporters gene in wheat (Triticum aestivum L.)[J]. International Journal of Molecular Sciences,2018,19(12):3969.
[8]晁毛妮,温青玉,张晋玉,等. 大豆KUP/HAK/KT钾转运体基因家族的鉴定与表达分析[J]. 西北植物学报,2017,37(2):239-249.
[9]Fan K,Mao Z J,Zheng J X,et al. Molecular evolution and expansion of the KUP family in the allopolyploid cotton species Gossypium hirsutum and Gossypium barbadense[J]. Frontiers in Plant Science,2020,11:545042.
[10]Feng X M,Wang Y J,Zhang N N,et al. Genome-wide systematic characterization of the HAK/KUP/KT gene family and its expression profile during plant growth and in response to low-K+stress in Saccharum[J]. BMC Plant Biology,2020,20(1):20.
[11]Shen C W,Yuan J P. Genome-wide investigation and expression analysis of K+-transport-related gene families in chinese cabbage (Brassica rapa ssp. pekinensis)[J]. Biochemical Genetics,2020,59(4):1-27.
[12]Yang T Y,Lu X,Wang Y,et al. HAK/KUP/KT family potassium transporter genes are involved in potassium deficiency and stress responses in tea plants (Camellia sinensis L.):expression and functional analysis[J]. BMC Genomics,2020,21(1):556.
[13]Qin Y J,Wu W H,Wang Y. ZmHAK5 and ZmHAK1 function in K+uptake and distribution in maize under low K+conditions.[J]. Journal of Integrative Plant Biology,2019,61(6):691-705.
[14]饶宝蓉. 香蕉不同基因型间钾素营养效率差异性研究[D]. 海口:海南大学,2010:20-22.
[15]陈海强,杨公明,梅为云,等. 不同品种香蕉果实成熟期主要营养与功能成分含量变化[J]. 广东农业科学,2014,41(22):24-28.
[16]杨苞梅,黄汉森,黄 强,等. 钾氮营养对香蕉抽蕾和产量的影响[J]. 中国土壤与肥料,2011(6):39-42.
[17]Chen C J,Chen H,Zhang Y,et al. TBtools:an integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant,2020,13(8):1194-1202.
[18]Panchy N,Lehti-Shiu M,Shiu S. Evolution of gene duplication in plants[J]. Plant Physiology,2016,171(4):2294-2316.
[19]Gupta M,Qiu X H,Wang L,et al. KT/HAK/KUP potassium transporters gene family and their whole-life cycle expression profile in rice (Oryza sativa)[J]. Molecular Genetics and Genomics,2008,280(5):437-452.
[20]陳 光,高振宇,徐国华. 植物响应缺钾胁迫的机制及提高钾利用效率的策略[J]. 植物学报,2017,52(1):89-101.
[21]Gierth M,Mser P,Schroeder J I. The potassium transporter AtHAK5 functions in K+deprivation-induced high-affinity K+uptake and AKT1 K+channel contribution to K+uptake kinetics in Arabidopsis roots[J]. Plant Physiology,2005,137(3):1105-1114.
[22]宋志忠,许建兰,张斌斌,等. 叶面喷施钾肥对霞脆桃果实品质及KUP基因表达的影响[J]. 江苏农业学报,2018,34(5):1107-1112.

