犊牛源雷氏普罗威登斯菌的分离鉴定及药物敏感性试验
王 娜,戴伶俐,乌云塔娜,毕力格,赵世华,达来宝力格
(1.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031;2呼伦贝尔市新巴尔虎右旗动物疫病预防控制中心,内蒙古 新巴尔虎右旗 021300;3.呼伦贝尔市新巴尔虎右旗农牧业事业发展中心,内蒙古 新巴尔虎右旗 021300)
1904年美国细菌学家RETTGE初次分离到雷氏普罗威登斯菌(Providencia rettgeri),为肠杆菌科,普罗威登斯菌属[1]。该菌为人畜共患条件病原菌,通过菌毛黏附于生殖道上皮引起尿路感染,也可引起伤口感染、菌血症、腹泻等多种疾病[1-2]。此外,雷氏普罗威登斯菌也能污染食品,造成人食物中毒,并能引发感染性腹泻[3-4]。
雷氏普罗威登斯菌可感染多种动物,如虾、鼠、羊、猪、龟、扬子鳄等。1997年我国学者战文斌等[5]首次从患病虾中分离到3株雷氏普罗威登斯菌,该菌致病性强,可引发败血病;2012年王建峰等[6]从外来船舶压舱水中分离到该菌;2015年王建昌等[7]从美国种猪新鲜粪便中分离到该菌,且该菌未携带blaNDM-1耐药基因;2015年李林俐等[8]从扬子鳄分离到该菌,扬子鳄感染该菌会出现精神萎靡、便血,严重者甚至会出现败血症;2016年Benedict等[9]从发病的鳄鱼中也分离到了2株雷氏普罗威登斯菌,这2株菌均能引发败血症,且具有较强的耐药性;2016年刘琨[10]从病死竹鼠内脏中分离该菌,竹鼠感染该菌后肺部出现肿胀,肠道有出血点,脾和肝存在结节;2016年芮萍等[11]从哺乳腹泻仔猪肠拭子中分离到该菌,该菌对13种药物表现为耐药,仅对美罗培南、乙酰甲喹敏感。2018年曹瑞勇等[12]从发病黑山羊鼻拭子中分离到该菌;2018年Newton等[13]从15岁短毛家猫中首次分离到该菌,该菌致病性强,可引发腹泻、发烧、胆囊炎、肝炎等病症,口服普拉多沙星治疗28 d,之后4个月无并发症状;2020年Ye等[14]从中国患病海龟中分离到致病性雷氏普罗威登斯菌,该菌含有多种致病因子、毒力因子及多重耐药基因。
该研究从腹泻犊牛肛拭子中分离到1株雷氏普罗威登斯菌,并进行药物敏感实验,为犊牛腹泻疾病的诊断提供理论依据,为后期的群体治疗提供技术指导。
1 材料与方法
1.1 材料
1.1.1 待检病料
从内蒙古呼伦贝尔市新巴尔虎右旗某家庭牧场1头腹泻犊牛中无菌采集肛拭子1份,装入采样袋,将其编号为HM-C-1。
1.1.2 试验试剂
细菌基因组DNA提取试剂盒,上海碧云天生物技术有限公司;TSA和TSB培养基,美国BD有限责任公司;EMB培养基和血平板,广东环凯有限责任公司;革兰染色液,北京索莱宝科技有限公司;17种药敏片,杭州滨和微生物试剂有限公司。
1.1.3 仪器设备
生化培养箱SPX-16B,吉林省安可科技有限责任公司;高速离心机pico17,赛默飞世尔科技(中国)有限公司;恒温水浴锅SH-WB-6GDN3,韩国三兴有限责任公司;恒温摇床TS-2112B,上海比朗仪器制造有限公司;旋涡振荡器VM-10,大韩科学有限公司;PCR仪ABI9902,电泳仪HE99X,全自动凝胶成像仪Type T2A,美国伯乐有限责任公司。
1.2 方法
1.2.1 病原菌分离培养
无菌条件将肛拭子接种于血平板、TSA平板、EMB平板,37℃培养16~24 h,挑取菌落镜检纯化,纯培养物接种TSB中,取1 mL提取基因组DNA,剩余菌液用60%的甘油1∶1保存。
1.2.2 菌株生理生化鉴定
参照文献[10][12][15]对分离菌株进行生化指标的测定。将对数期的细菌浓度调整为108CFU/mL,取60μL菌液悬空加入各微量生化反应管,37℃培养24 h,观察结果。
1.2.3 菌株16Sr DNA鉴定
使用细菌基因组提取试剂盒提取菌株DNA,引物27 F和1492 R根据文献[8]由生工生物工程(上海)股份有限公司合成。PCR扩增体系为50μL:mix酶25μL,上下游引物各1μL,模板2μL,无酶水21μL。PCR反应条件:94℃5 min;94℃30 s,55℃30 s,72℃90 s,30次循环;72℃7 min。PCR产物低温寄送到生工生物工程(上海)股份有限公司。
利用NCBI数据库进行序列比对,利用软件MegAlign构建菌株系统发育树。
1.2.4 药敏试验
使用17种药敏片进行体外抑菌试验,每种药敏片设置3个重复,参考CLSIM100(2020)标准进行结果判定,见表1。
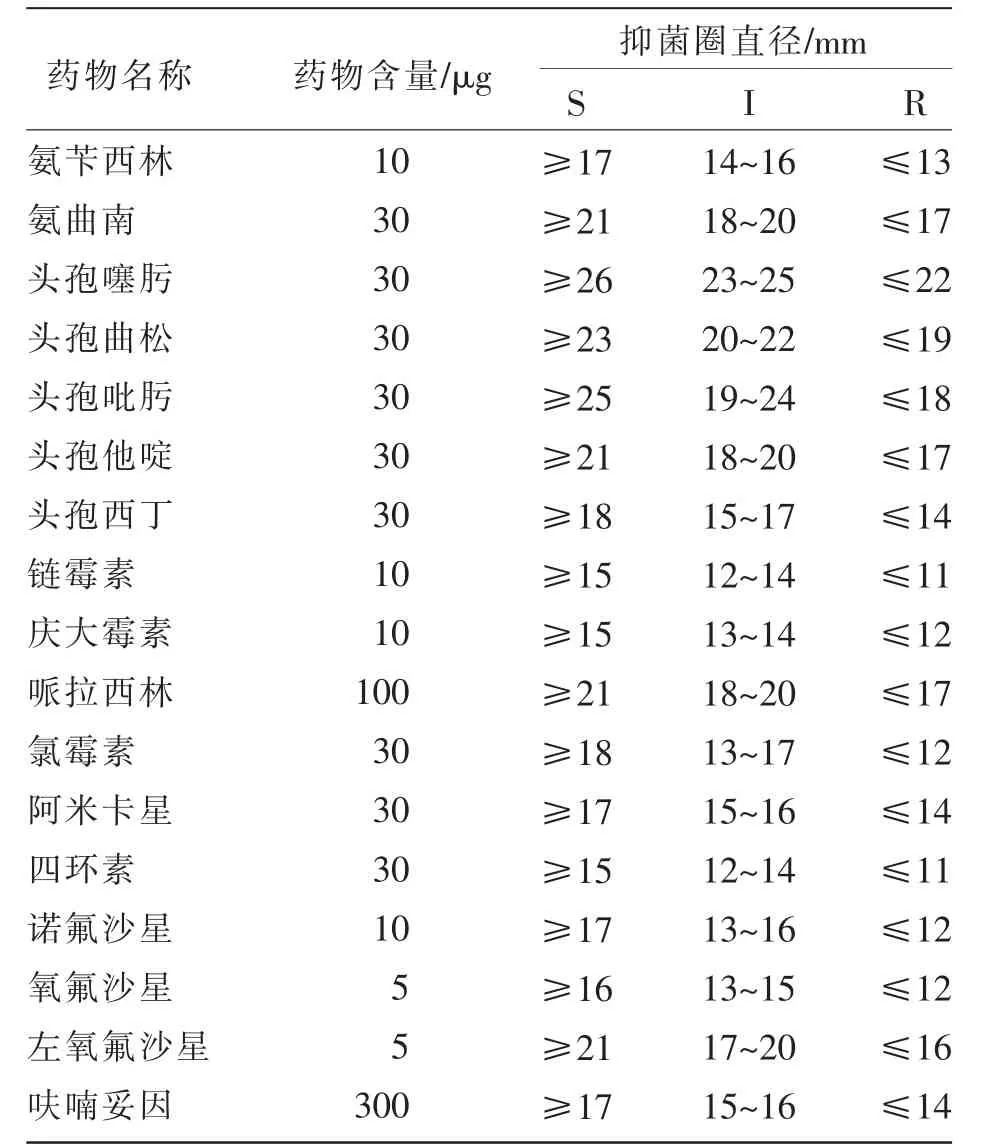
表1 17种药敏片体外评价标准
2 结果与分析
2.1 菌株培养特性
该菌株在血琼脂平板、TSA平板、EMB平板上生长良好,在血琼脂平板为灰白色透明菌落,且无明显的溶血环,表面光滑,圆形凸起,边缘整齐(见图1A);在TSA平板为白色透明菌落,表面圆形,湿润凸起,边缘整齐(见图1B);在伊红美蓝琼脂平板为半透明淡棕菌落,表面圆形凸起,湿润光滑(见图1C);挑取纯化菌落进行革兰染色,用1 000倍油镜观察为革兰阴性杆菌,并将该菌株命名为HMC-1。
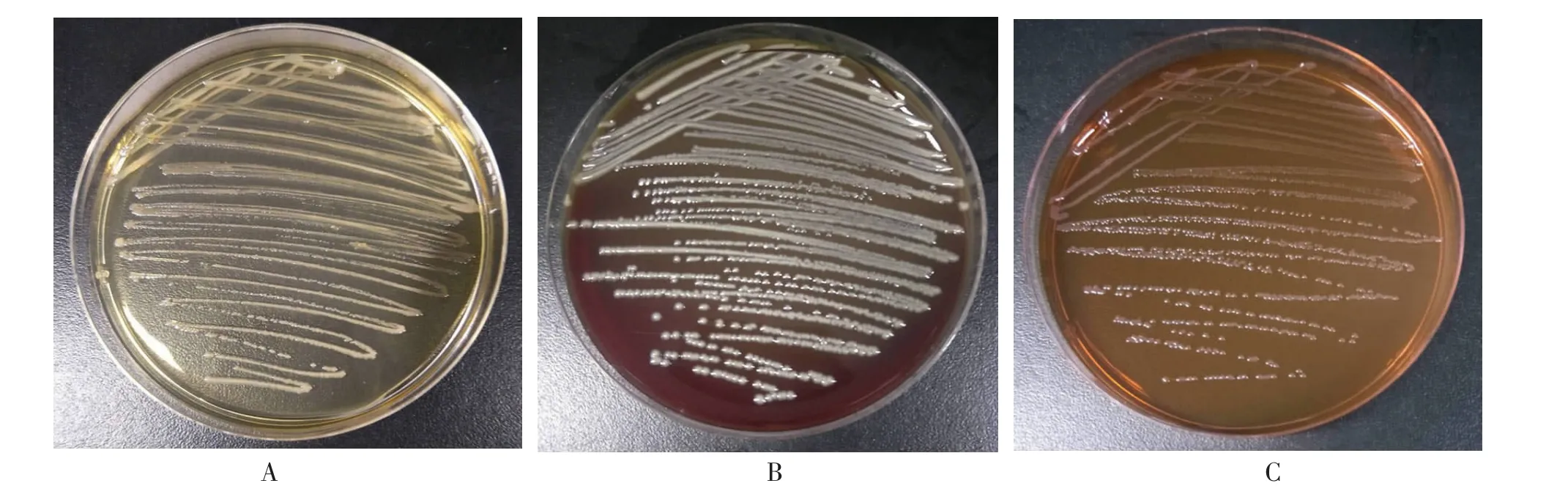
图1 分离菌株HM-C-1的菌落形态
2.2 菌株生化鉴定结果
严格按照细菌新型生化鉴定管使用说明书进行操作。由表2可知,分离菌株氧化酶、鸟氨酸脱羧酶、精氨酸双水解酶为阴性,硝酸盐还原试验、苯丙氨酸脱羧酶为阳性,符合雷氏普罗威登斯菌的理化特性,初步判断为雷氏普罗威登斯菌。
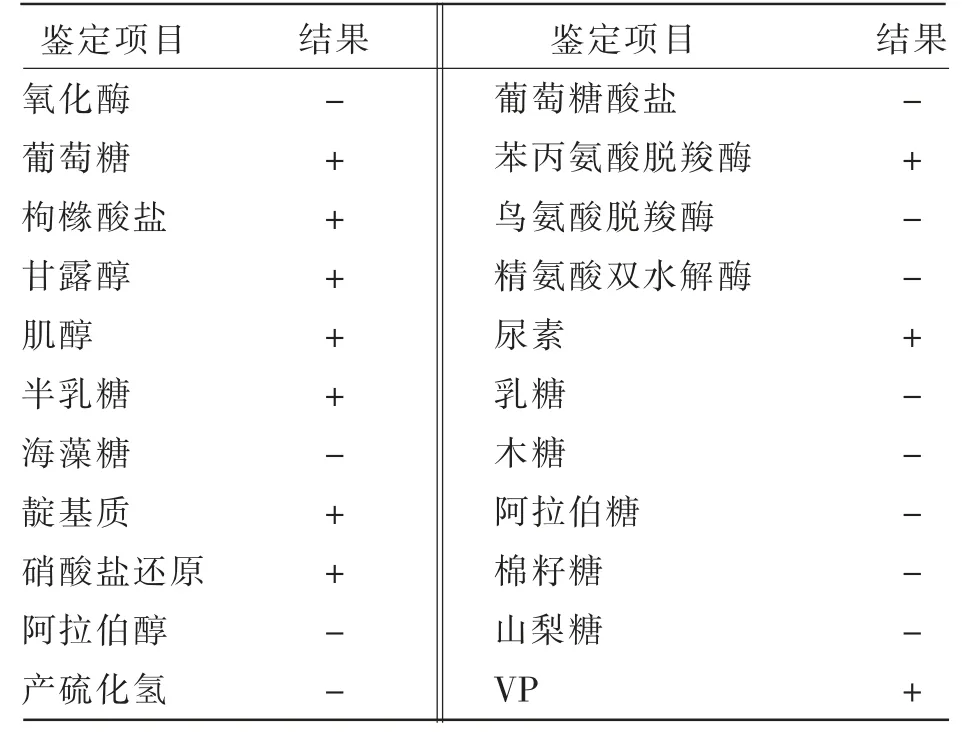
表2 菌株HM-C-1生化鉴定结果
2.3 菌株16Sr DNA鉴定
以菌株HM-C-1基因组DNA为模板进行PCR扩增,获得1 500 bp的扩增产物(见图2),经生工生物工程(上海)股份有限公司测序,通过NCBI比对构建系统发育树(见图3)及进行同源性分 析 (见 图 4), 分 离 株 HM-C-1与MT793534.1Providencia rettgeri相似度达到99.9%,因此,鉴定菌株HM-C-1为雷氏普罗威登斯菌。
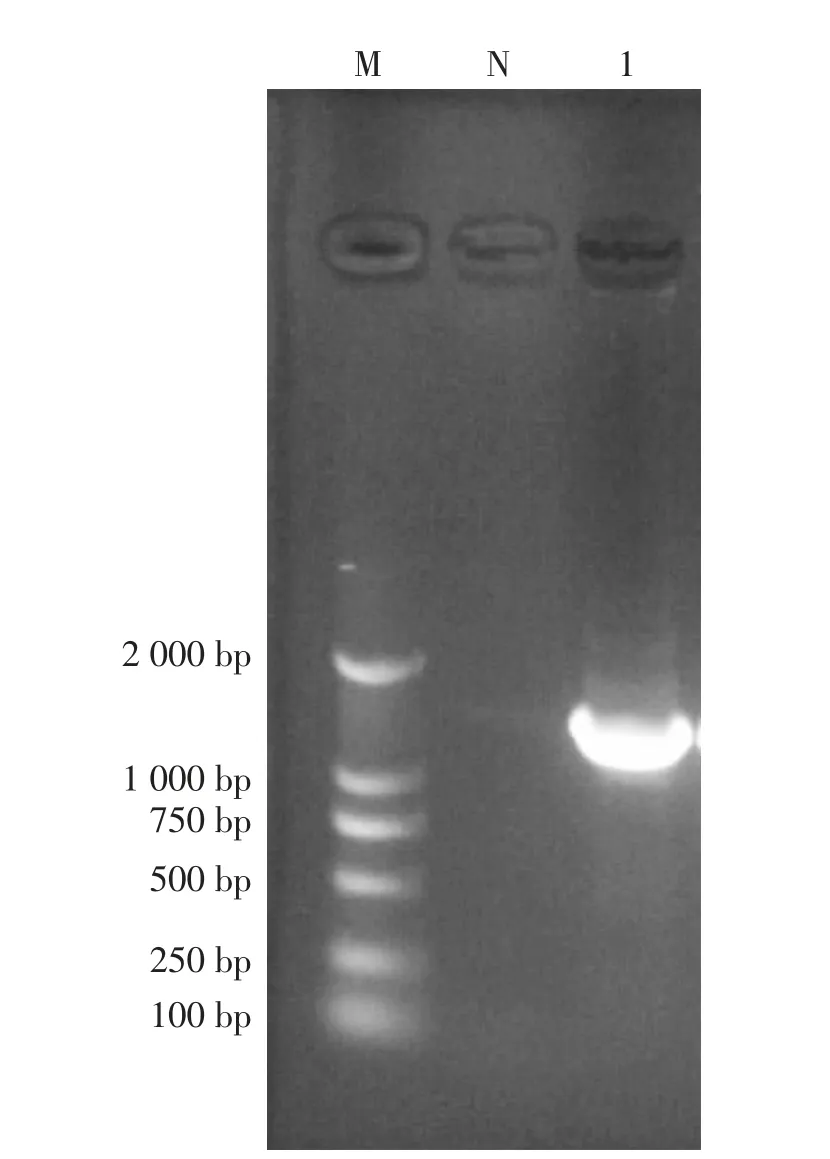
图2 菌株HM-C-1 PCR产物扩增电泳图
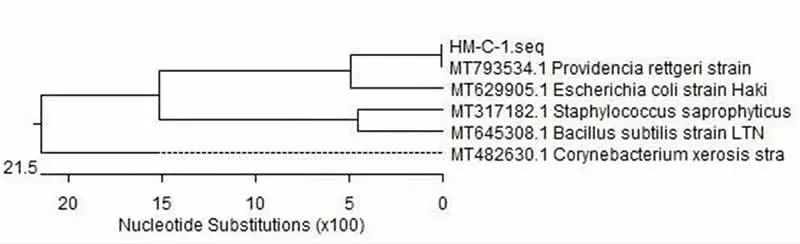
图3 菌株HM-C-1的系统发育树
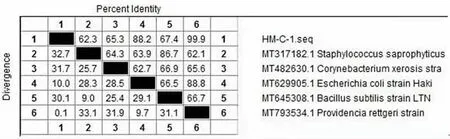
图4 菌株HM-C-1序列同源性分析
2.4 药敏试验结果
体外药敏试验显示,分离菌株HM-C-1对氨曲南、头孢他啶、头孢噻肟、头孢吡肟、头孢曲松、四环素、氯霉素、呋喃妥因8种药物表现为耐药;对氨苄西林、庆大霉素2种药物表现为中度敏感;对头孢西丁、链霉素、哌拉西林、阿米卡星、氧氟沙星、诺氟沙星、左氧氟沙星7种药物表现为敏感(见表3)。
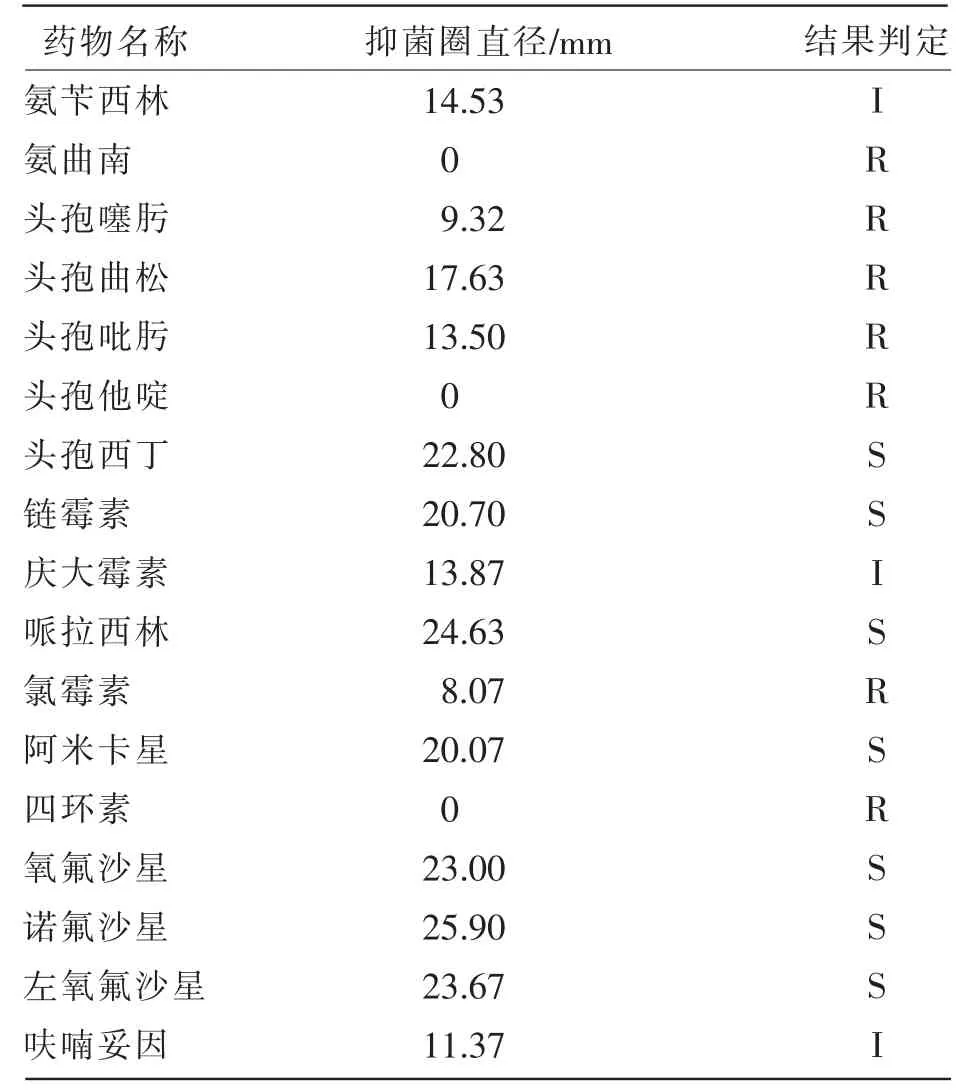
表3 菌株HM-C-1体外药敏试验结果
3 讨论
试验通过菌株分离培养、生理生化试验及分子生物学技术确定该菌为雷氏普罗威登斯菌,曹瑞勇等[12]也是采用上述3种方法相结合进行菌株鉴定。目前,国内未报道犊牛源雷氏普罗威登斯菌,但该试验从发病犊牛肛拭子中分离到该菌,是引起犊牛腹泻的主要病原菌,且该病原可能是由于牛马混群饲喂导致交叉感染。尽管该菌为条件致病菌,但养殖过程中随着产业的集约化,养殖密度增大,外加各种冷热应激及营养供给不足,致使犊牛自身免疫力下降,极可能会使该菌乘虚而入,导致大批犊牛发病甚至死亡,给养殖场带来较大的经济损失,
考虑牧户养殖过程中滥用抗生素,细菌极可能产生耐药性,所以笔者设计体外药敏试验。该分离株对头孢西丁、链霉素、哌拉西林、阿米卡星、氧氟沙星、诺氟沙星、左氧氟沙星7种药物敏感;李林俐等[8]分离的扬子鳄源雷氏普罗威登斯菌对阿米卡星、氧氟沙星、诺氟沙星、氯霉素等14种药物敏感;刘琨[10]分离的竹鼠源雷氏普罗威登斯菌对头孢曲松、头孢他啶、氧氟沙星、环丙沙星、氟苯尼考和阿米卡星6种药物敏感;芮萍等[11]分离的仔猪源雷氏普罗威登斯菌仅对美罗培南、乙酰甲喹敏感。综合分析,每株菌的耐药程度不同,养殖过程中如发生该病,应根据药敏试验结果科学用药,方能获得较好的治疗效果。

