艾地苯醌对帕金森病模型小鼠的神经保护作用及机制
何培坤 段青蕊 高玉元 聂坤 郭曼莉 王丽娟 王丽敏
帕金森病(Parkinson disease,PD)是以中脑黑质纹状体区多巴胺能神经元进行性丢失为特征的中枢神经系统神经退行性病变,多发于中老年人。PD的发病机制尚未清楚,研究表明多巴胺能神经元死亡可能与α-突触核蛋白毒性、神经炎症、线粒体凋亡等有关[1]。早期识别并启动疾病修饰治疗是PD患者理想的治疗方式,但目前临床尚缺乏具有循证医学依据、能够缓解疾病进展的疾病修饰治疗药物[2]。近来多个根据PD可能发病机制研发的、具有疾病修饰治疗潜能的药物临床试验正在开展[3],其中,艾地苯醌(idebenone)是潜在候选药物之一。
艾地苯醌是辅酶Q10的合成物,其作用机制主要是保护线粒体膜电位、维持线粒体能量代谢作用以及抵抗氧化应激等[4-5]。线粒体功能紊乱与氧化应激在PD发生发展中发挥重要作用,有临床研究结果显示,多巴丝肼联合艾地苯醌治疗相对于单独服用多巴丝肼治疗能够显著改善PD患者的临床症状[6],其机制可能与艾地苯醌抑制神经元凋亡有关[7],但艾地苯醌通过何种途径调控神经元凋亡有待进一步研究。
磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/AKT)通路是细胞重要的信号转导通路,与凋亡关系密切。PI3K是PI3K/AKT通路的上游因子,可通过磷酸化Thr308、Ser473位点激活AKT。AKT是重要的效应激酶。被激活后的AKT可通过抑制与Bcl-2相关的促凋亡基因(Bcl-2 associated agonist of cell death gene,Bad)、半胱氨酸天冬氨酸蛋白酶-9(Caspase-9)、糖原合成酶-3β(glycogen synthase kinase-3 beta,GSK-3β)以及叉头框蛋白O1(forhead box protein O1,FoxO1),激活抗凋亡蛋白-B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)和Bcl-2样因子1(Bcl-2 like 1,Bcl-xL),从而抑制凋亡[8]。本研究通过构建1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methy-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)诱导的PD动物模型,探讨了艾地苯醌是否通过PI3K/AKT通路发挥治疗PD的作用机制。
1 材料和方法
1.1 实验动物48只6周龄雄性C57BL/6J小鼠(SPF级),体重19~21 g,由华南理工大学实验动物中心提供,本研究动物实验过程遵守华南理工大学实验动物中心相关规定,伦理号为2019034。小鼠置20~26℃、相对湿度为40%~70%环境适应饲养1周,自由饮水和进食。将小鼠随机分为正常对照组、PD模型组、艾地苯醌低剂量组和高剂量组,每组12只。
1.2 主要试剂艾地苯醌(上海易恩化学技术有限公司)、MPTP(美国Sigma公司)、酪氨酸羟化酶(tyrosine hydroxylase,TH)抗体(Affinity Biosciences)、Bcl-2抗体、与Bcl-2相关的促凋亡调节因子X(Bcl-2 associated X,apoptosis regulator,Bax)、Caspase-3抗体、PI3K抗体、p-PI3K抗体、AKT抗体、p-AKT抗体(美国Cell Signal Technology公司)、HRP标记的山羊抗兔IgG(Affinity Biosciences)。
1.3 方法
1.3.1PD模型制备:MPTP造模剂量参考Wang等[9]研究,艾地苯醌剂量参考Jiang等[10]研究。按体重30 mg/kg给予造模小鼠腹腔注射MPTP,连续5 d,建立亚急性PD模型,对照组以相同方式给予等量生理盐水。于造模前5 d,分别按体重100 mg/kg和200 mg/kg给予艾地苯醌低、高剂量组小鼠艾地苯醌(用玉米油溶解)灌胃,连续11 d;正常对照组和PD模型组以相同方式给予等量玉米油。
1.3.2动物运动功能评价:参考Zhou等[11]方法对所有小鼠进行行为学检测,重复3次,取其均值。(1)爬杆实验:准备长50 cm的木杆装置,将小鼠头朝下置于杆顶部,记录小鼠爬完木杆的时间。于灌胃给药结束后,先对小鼠进行爬杆训练2 d,然后正式进行爬杆实验和倒挂实验。(2)倒挂实验:将直径为5 mm的铁丝水平放置,让小鼠双前爪抓住铁丝,观察10 s进行评分。评分标准:四肢均能抓住铁丝记4分;双前肢和1个后肢抓住铁丝记3分;双前肢抓住铁丝记2分;只有1个前肢抓住铁丝记1分;无法抓住铁丝记0分。
1.3.3免疫组化检测:PD造模后1周,处死小鼠取全脑(每组取4只小鼠),将全脑固定后进行石蜡包埋、切片,切片位置选取黑质切面,每只小鼠取相同位置切片。切片脱蜡至水、抗原修复、透化、封闭;加入一抗稀释液孵育过夜;次日加二抗稀释液孵育、DAB显色液显色,苏木素复染,脱水封片。置显微镜下观察并计数TH+神经元(呈棕黄色)。以TH+神经元代表存活的多巴胺能神经元。
1.3.4Western blot检测:PD造模后1周,每组取4只小鼠,将小鼠脱臼处死,冰上开颅取脑;加入RIPA裂解液提取组织蛋白,按照BCA说明书进行蛋白浓度定量并调整蛋白浓度,100℃蛋白变性10 min;经过SDS-PAGE凝胶电泳、转膜、封闭、一抗孵育、二抗孵育后曝光显色;Image J软件采集PVDF条带上的灰度值,分析脑组织Bcl-2、Caspase-3、PI3K、p-PI3K、AKT、p-AKT蛋白相对表达水平。
1.4 统计学处理采用GraphPad Prism v 8.0软件进行统计分析,采用Shapiro-Wilk法对数据进行正态性检验,采用Brown-Forsythe检验法进行方差齐性检验。符合正态分布的计量资料以均值±标准差表示,两组均数间比较采用独立样本t检验;多组均数间比较采用单因素方差分析,两两比较采用Dunnett法。以P<0.05表示差异有统计学意义。
2 结果
2.1 各组小鼠行为学比较与正常对照组相比,PD模型组爬杆时间延长(P<0.01),倒挂实验评分减少(P<0.001);与PD模型组相比,艾地苯醌高、低剂量组爬杆完成时间缩短(均P<0.01),艾地苯醌高剂量组倒挂实验评分增加(P<0.05)。结果见表1。
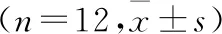
表1 各组小鼠行为学检测结果比较
2.2 各组小鼠多巴胺能神经元损伤比较与正常对照组相比,PD模型组黑质TH阳性神经元数目明显减少〔(127.3±9.3)个比(170.3±16.0)个;t=4.023,P=0.016〕;PD模型组及艾地苯醌高〔(169.7±6.1)个〕、低剂量组〔(149.3±4.7)个〕黑质TH阳性细胞数比较差异有统计学意义(F=27.63,P=0.001),两两比较结果显示,艾地苯醌高、低剂量组的黑质TH阳性细胞数目均较PD模型组增加(均P<0.05)。结果见图1。
2.3 各组小鼠Cleaved-Caspase-3/Caspase3及Bcl-2/Bax比值比较与正常对照组比较,PD模型组Bcl-2/Bax比值降低(P<0.01),Cleaved-Caspase-3/Caspase-3比值升高(P<0.01);与PD模型组比较,艾地苯醌高、低剂量组Bcl-2/Bax比值均增加(均P<0.05),Cleaved-Caspase-3/Caspase-3比值均明显降低(均P<0.01)。结果见表2、图2。

注:PD:帕金森病;TH:酪氨酸羟化酶
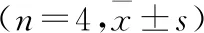
表2 各组小鼠Cleaved-Caspase-3/Caspase3及Bcl-2/Bax比值比较

注:PD:帕金森病;Bcl-2:B淋巴细胞瘤-2;Bax:Bcl-2相关的促凋亡调节因子X;Caspase-3:半胱氨酸天冬氨酸蛋白酶-3
2.4 艾地苯醌激活PI3K/AKT信号通路与正常对照组比较,PD模型组p-PI3K/PI3K、p-AKT/AKT比值降低(均P<0.01);与PD模型组比较,艾地苯醌高剂量组p-PI3K/PI3K、p-AKT/AKT比值升高(均P<0.05),而低剂量组p-PI3K/PI3K比值升高(P<0.01)。结果见表3、图3。
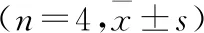
表3 各组小鼠p-PI3K/PI3K、p-AKT/AKT比值比较

注:PD:帕金森病;p-PI3K/PI3K:磷酸化磷脂酰肌醇3-激酶/磷脂酰肌醇3-激酶;p-AKT/AKT:磷酸化蛋白激酶B/蛋白激酶B
3 讨论
艾地苯醌是辅酶Q10的类似物,二者均有苯醌环样结构,所不同的是艾地苯醌水溶性更好,更容易透过生物膜和血-脑屏障[12]。艾地苯醌上的苯醌环结构具有转移电子的能力,能够参与细胞抵抗氧化应激以及保护线粒体膜电位的过程。已有多项研究报道艾地苯醌对PD的运动功能和学习 记忆功能有一定改善作用,其机制可能与艾地苯醌抵抗神经炎症[13]、减少脂质过氧化、提高细胞抗氧化能力[14]以及增加线粒体自噬[15]有关。但艾地苯醌调控神经元线粒体凋亡的机制仍未阐明。
该研究结果显示,与正常对照组比较,PD模型小鼠运动能力下降,中脑多巴胺能神经元细胞减少,而艾地苯醌能够改善PD小鼠的运动能力,提高PD小鼠脑内黑质TH阳性细胞数,提示艾地苯醌可减少PD模型小鼠多巴胺能神经元损伤,这与Yan等[13]研究结果一致。此外,该研究发现,低、高剂量艾地苯醌小鼠爬杆完成时间均值甚至短于与正常对照组,其原因可能与造模方式及实验误差有关。有研究结果表明[16],与正常对照组相比,MPTP诱导的PD亚急性模型小鼠在行为学实验中运动功能损伤不甚明显,从而增加实验误差。
在PD中,细胞凋亡是多巴胺能神经元丢失的重要病理机制。Bcl-2是抗凋亡蛋白之一,而Bax能够促进细胞凋亡,Caspase-3是细胞凋亡过程中关键执行者。有研究发现,MPTP诱导的PD模型小鼠大脑中除黑质区外,海马区亦可出现神经元凋亡[17],表明MPTP对黑质区以外的其他脑区也有影响。本研究通过提取全脑组织研究发现,艾地苯醌可增加PD小鼠Bcl-2/Bax的比值,抑制Caspase-3的激活,提示艾地苯醌可抑制MPTP诱导的细胞凋亡,发挥神经元保护作用。
PI3K/AKT通路是细胞内重要的传导通路,在细胞凋亡过程中发挥重要的作用。AKT与PD发病关系密切,激活AKT可减少中脑多巴胺能神经元损伤[18]。本研究发现艾地苯醌可增加PD模型小鼠脑内PI3K、AKT的磷酸化水平,而激活的AKT可通过抑制Bad以及Caspase-9的激活抵抗凋亡[8]。除此之外,AKT还可通过调控自噬清除异常聚集的α-突触核蛋白、减少神经炎症以及抵抗氧化应激等方式保护多巴胺能神经元[8]。
综上所述,本研究结果显示艾地苯醌可通过激活PI3K/AKT通路抑制神经元凋亡,保护多巴胺能神经元,进而改善PD小鼠的运动症状。但艾地苯醌治疗PD的临床疗效,以及艾地苯醌调节PI3K/AKT通路的具体机制仍需更多研究进一步证明。

