微生物群落对厌氧干发酵挥发性脂肪酸抑制的响应
王思淇,张克强,孔德望,高文萱,韦红,梁军锋,李佳佳,杜连柱*
(1.农业农村部环境保护科研监测所,天津 300191;2.杭州能源环境工程有限公司,杭州 310020;3.华标(天津)科技有限责任公司,天津 300392)
厌氧干发酵具有节水、低能耗、低污染负荷、反应器体积小以及产气效率高等优势,是有机固体废弃物转化为生物能源的重要手段。2010—2015年,欧洲厌氧干发酵处理能力增长了50%,处理量占厌氧发酵总量的35%。在我国,厌氧干发酵逐渐引起重视,有望成为畜禽养殖粪便、作物秸秆等有机废弃物处理和资源化利用的主流工艺。厌氧干发酵按照发酵温度可分为中温(30~40℃)、嗜热(50~60℃)发酵,按照发酵过程可分为一阶段、两阶段或多阶段消化。LIAO等在厌氧消化反应器中采用改进的搅拌方式,与传统的低固厌氧消化(总固体含量为4.2%±0.4%)相比,高固厌氧消化(总固体含量为15.7%±0.4%)沼气产量提高了1.85倍。VOELKEIN等的研究结果表明,55℃、高有机负荷率[挥发性固体(VS)含量3~4 kg·L·d]下,单位质量VS的日甲烷产率高达405 L·kg。ZHANG等评估餐厨垃圾与园艺废物的三阶段高温厌氧共消化产气性能,结果表明三级嗜热反应器中的平均甲烷产率分别比一级、二级高约45%和31%。
然而,厌氧干发酵由于有机负荷高、传质效率低,常常导致启动慢、效率低、周期长等问题,其中,挥发性脂肪酸(Volatile fatty acid,VFA)的积累引起的对产甲烷菌的抑制是主要原因之一。如何解除酸抑制是国内外研究的重点,目前已开发出了添加外源物质(如碱性试剂、微量元素等)、生物强化(添加或富集某种特定的菌)和消化液循环等多种技术。如WEI等的研究结果表明,加入微量元素可以缓解酸抑制作用,产甲烷量从0.13 L·g增加至0.44 L·g。ZHANG等的研究表明,添加NaOH调节初始pH至7.5,足以抵消厌氧消化系统pH值的下降,确保微生物的最适生长范围,从而有效缓解酸抑制效应。李丹妮等研究了蛭石、海泡石和生物炭对混合厌氧发酵过程中酸抑制的缓解效应,结果显示添加剂比例达到20%时可获得最大累积甲烷产量,并且生物炭的效果最优。LU等在接种物中添加乙酸溶液以富集耐酸性产甲烷菌,试验结果表明,在适应酸40 d后,接种抗酸接种物使得启动阶段产甲烷量显著提升。XUE等在玉米秸秆的厌氧消化中将50%的消化液再循环,该反应器产沼气量比对照组高33.3%,平均沼气产量和甲烷产量分别比对照组高58.4%和61.5%。同时,已有大量文献报道微生物群落在厌氧共消化过程中的作用,如WANG等在对比玉米秸秆和猪粪共消化与单独消化微生物群落动态变化的实验中,采用16SrRNA测序技术,阐明共消化系统获得高甲烷产量的内在原因。本课题组前期研究结果表明,分层接种能促进系统内乙酸和丁酸的分解转化,即使在较低接种比下,仍能缩短厌氧干发酵迟滞期,提高甲烷产率,体系中较好的产甲烷性能是由于氢营养型产甲烷途径占主导地位。上述研究为缓解酸抑制、提高厌氧干发酵产气性能提供了有益借鉴。由于对酸抑制发生过程及与酸抑制密切相关的细菌、古菌的结构及功能缺乏深入研究,导致酸抑制解除技术措施缺乏足够的理论依据,效果尚有待进一步提升。
本研究以猪粪为主要原料,开展批式厌氧干发酵实验,对比酸抑制下猪粪秸秆混合发酵、猪粪单独发酵产气性能。采用MiSeq高通量测序技术并结合生物信息学,分析酸抑制下细菌和产甲烷古菌群落多样性,阐明群落结构组成和变化特征,明晰引起细菌和产甲烷古菌群落变化的主控环境因子,揭示酸抑制对厌氧干发酵体系中微观结构的影响,以期为揭示厌氧干发酵酸抑制机理、开发酸抑制防控技术提供科学依据。
1 材料与方法
1.1 实验装置与样品采集
本实验装置和所取样品与文献[14]一致。实验装置为有机玻璃材质的自制立式厌氧反应器,其有效高度为750 mm,有效内径为20 mm。装置侧面于垂直方向上设多个直径为15 mm的取样口,并用橡胶塞密封。装置顶部设有阀门控制的排气口并接铝制集气袋。猪粪和玉米秸秆均取自天津市西青区某规模化养殖场,新鲜猪粪当日采集后置于冰箱冷藏[(4±1)℃]存放,玉米秸秆自然风干后粉碎至1 mm,置于通风处干燥;接种物取自实验室上一批次实验剩余物。相关理化性质见表1。

表1 底物和接种物的理化指标Table 1 Characteristics of substrates and inoculum
1.2 实验设计
本实验以猪粪为主要原料,以酸抑制下的厌氧干发酵系统为研究对象。设置猪粪单独发酵(P)、猪粪秸秆混合发酵(M)两组发酵系统。每组发酵原料的总进料量均为10.22 kg,总固体(TS)为20.3%,接种比为25%(以VS计),其中M发酵组中粪秆比为1∶1(以VS计)。每组发酵方式设3组平行。装料后检测气密性,向各反应器中通入氮气以创造厌氧环境,室温[(25~35)℃]下进行发酵。
1.3 理化参数测定
采用集气袋法收集气体,每1~2 d测定沼气产量和甲烷百分含量;每2~3 d从反应器侧面取样冷藏以供理化指标测定;并根据产气情况及理化指标变化,在发酵过程中的0 d(初始阶段)、13 d(Ⅰ阶段)、33 d(Ⅱ阶段)、45 d(Ⅲ阶段)和78 d(Ⅳ阶段)从反应器侧面取发酵样品冷冻保存以供微生物分析。TS和VS含量、沼气产量、沼气组分和发酵体系VFA质量分数分析测量方法见文献[14],将取回的固体样品稀释10倍,振荡混匀后用pH计测定pH值。
1.4 DNA提取与PCR扩增
采用E.Z.N.AMag-Bind Soil DNA Kit(OMEGA bio-tek,USA)试剂盒提取样品DNA,利用琼脂糖凝胶检测DNA完整性,并用Nanodrop 2000分光光度计(Thermo Fisher Scientific,美国)测定DNA含量。
针对细菌和古菌16Sr RNA基因的V3~V4高变区序列,分别进行PCR扩增。利用Qubit3.0 DNA检测试剂盒对基因组DNA精确定量,以确定PCR反应加入的DNA量。细菌第一轮扩增引物为341F(CCCTA⁃CACGACGCTCTTCCGATCTG(barcode)CCTAC⁃GGGNGGCWGCAG)和805R(GACTGGAGTTCCTTG⁃GCACCCGAGAATTCCAGACTACHVGGGTATCTAATCC),第二轮扩增引入Illumina桥式PCR兼容引物。古菌引用槽式PCR扩增三轮,第一轮使用扩增引物M-340F(CCCTAYGGGGYGCASCAG)和GU1ST-1000R(GGCCATGCACYWCYTCTC);第二轮使用第一轮PCR产物进行扩增,扩增引物为349F(CCCTA⁃CACGACGCTCTTCCGATCTN(barcode)GYGCASCAG⁃KCGMGAAW)和806R(GACTGGAGTTCCTTG⁃GCACCCGAGAATTCCAGGACTACVSGGGTATCT⁃AAT);第三轮扩增中引入Illumina桥式PCR兼容引物。对于细菌和古菌扩增的PCR产物和正常扩增片段在400 bp以上的PCR产物,选用0.6倍的磁珠(Agencourt AMPure XP)进行DNA纯化回收。利用Qubit3.0 DNA检测试剂盒对回收的DNA精确定量,按照1∶1的等量混合后测序,测序平台为MiSeq 2×300。
1.5 数据分析
使用Excel 2020和Origin 8.5进行理化指标统计并绘制图表。在QIIME中调用Uclust(1.1.579)软件,设置97%相似性,对有效DNA序列数据进行OTU分类,并对测序序列随机抽样,将抽到的序列数与其代表的OTU数目构建稀释曲线。采用Mothur软件进行Alpha多样性分析,计算Chao、ACE、Shannon、Simpson和Coverage指数。利用RDP软件比对Silva数据库进行物种分类,在门和属水平上统计样本中物种的相对丰度。选取属水平OTU丰度前50的代表性序列与数据库中与其种属信息一致的序列,使用MUSCLE进行多序列比对后,采用FastTree根据最大似然法(Approximately-maximum-likelihood phylogenetic trees)构建系统进化树,推测未被分类菌属在发酵体系中的作用。利用Canoco 5.0软件进行冗余分析(Redundancy analysis,RDA),评价发酵系统中环境因子对主要微生物群落结构的影响。
2 结果与讨论
2.1 酸抑制下厌氧干发酵的产气性能
图1为日甲烷产量(以VS计,下同)和沼气中甲烷含量随发酵时间的变化图。P组的产甲烷性能在70 d前要优于M组。由图可知,P组的启动时间长,前28 d日甲烷产量低于0.59 mL·g,之后明显升高,47 d时达到3.32 mL·g,但峰值出现时间短,峰谷差较大,产气性能不稳定。与P组相比,10~70 d内M组的日甲烷产量相近,但在28~70 d内明显低于P组。与日甲烷产量相对应,P组的甲烷含量在28~48 d内逐渐升高至66.80%,M组甲烷含量56 d前低于30%,之后明显上升,70 d时高于50%。这表明P组和M组发酵产气受到明显抑制,M组抑制作用更强。KAIN⁃THOLA等的研究结果表明,厌氧共消化可以减小甲烷产生速率的峰谷差,从而确保稳定的甲烷产量。但本实验中M组产甲烷性能明显较P组差,日甲烷产量一直处于低水平状态,这可能是由于M组体系中酸化作用显著,产气效率受到影响。56 d后M组甲烷含量明显升高,表明共消化体系中的产甲烷作用得到恢复,与JIANG等研究结果相似。
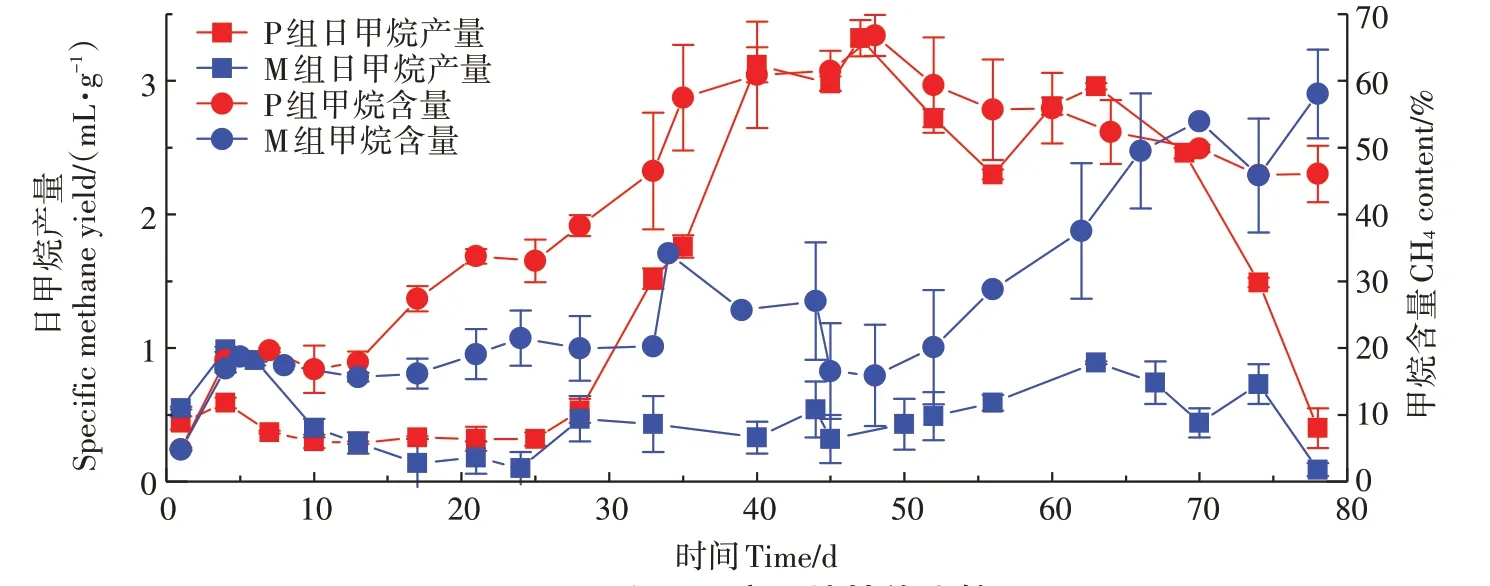
图1 P组和M组产甲烷性能比较Figure 1 Comparison of methane production performance between Pand Msystems
2.2 厌氧干发酵酸抑制过程中pH与VFA的变化
两组发酵体系过程中pH变化如图2所示。反应初期,有机物被水解型细菌水解为VFA,而产甲烷古菌对有机固废有一定的适应期,推测此时水解型细菌生长速率大于产甲烷古菌,出现酸积累,pH值相应降低。随着发酵过程的进行,产甲烷古菌能及时将体系内VFA转变为甲烷,P组的pH值于30 d后开始升高,结合图1,此时P组产甲烷速率和甲烷产量均呈上升趋势。而M组的pH值总体上无明显升高趋势,并且体系中产气性能较差。虽然稀释固态样品测得的pH值会有一定偏差,但总体变化趋势仍能反映体系中总挥发性有机酸(TVFAs)的大致情况,以便后续对体系中VFA的变化进行深入分析。
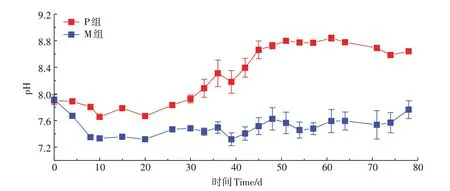
图2 厌氧干发酵过程中pH变化Figure 2 Variations of pH during the experiment
两组发酵体系过程中VFA质量分数变化如图3所示。第8 d起,M组VFA质量分数开始高于P组,之后两组间的VFA质量分数差呈现递增趋势,并至61 d质量分数差最大,达17.23 mg·g。8~78 d M组与P组的VFA质量分数差主要来源于丁酸,丁酸质量分数差介于2.14~11.97 mg·g。DEMIREL等得出结论,当丙酸质量浓度超过951 mg·L时会抑制产甲烷菌的生长,而此时加入丁酸可在一定程度上改善其抑制作用。WANG等的研究中,丁酸质量浓度最高至1 800 mg·L时对产甲烷菌的活性没有明显抑制。本实验中P组丁酸质量分数自第45 d起开始下降,并至54 d消耗完全;M组丁酸质量分数自第15 d起直至发酵结束一直保持在9.49~12.68 mg·g,结合图1可知,本实验中丁酸可能不是引起酸抑制效应的原因。

图3 厌氧干发酵过程中VFA质量分数变化Figure 3 Variations of concentration of VFA during the experiment
由于高质量浓度的丙酸积累意味着消化失衡,在P组消化过程的后期(48 d后),丙酸作为体系中VFA的主要组成成分,会破坏厌氧消化的性能,使得产气性能大幅度下降。前期研究表明,厌氧发酵体系中最适的丙酸质量浓度范围在800~3 000 mg·L,超过此范围不利于产甲烷菌降解利用。本实验中,P组的丙酸质量分数在10~78 d超出抑制质量浓度(3 000 mg·L),且P组丙酸质量分数在第61 d时迅速增加至9.89 mg·g,发酵结束时到达峰值10.58 mg·g。而在45 d后,P组乙酸质量分数从5.01 mg·g骤降至0.58 mg·g,结合图1,说明本实验中P组酸抑制的主体可能是高质量分数的丙酸。M组的丙酸质量分数虽然在8~78 d超出抑制质量浓度,但在15 d至发酵结束时丙酸质量分数在5.18~7.33 mg·g范围内波动,而乙酸质量分数却在第48 d时下降了28.88%,结合图1,说明本实验中M组酸抑制的主体可能是高质量分数的乙酸。M组前期酸化严重,阻碍了产甲烷菌的生长,而水解产酸菌对pH的耐受范围更广,对VFA耐受能力更强,因此M组前期水解过程未受到明显抑制,从而加重了混合发酵体系中的酸抑制效应。有研究报道,相比于单独消化,共消化具有多种优势,可以改善C/N并丰富微生物群落,但本研究中M组酸抑制效应更强。可能是系统有机负荷过高,水解产酸菌会产生大量VFA,而产甲烷古菌代谢速率较为缓慢,无法在短时间内快速利用产生的VFA,从而造成酸抑制现象,因此仍需从微生物角度分析本实验产生酸抑制效应的原因。结合前期的研究,分层接种的发酵方式可以促进体系内乙酸和丁酸的分解转化,缩短发酵迟滞期,进一步证实本实验中M组发酵启动困难与体系中VFA的积累有关。
2.3 古菌和细菌多样性分析
在OTU为97%的相似性水平下,对2组发酵体系中古菌群落的多样性进行分析。由表2可见,所有样本均有99%的覆盖率,Shannon指数稀释曲线(图4a)随着序列数的增加迅速趋于平缓,表明每个样品中的主要微生物种群均具有可靠的测序深度。Chao指数和ACE指数与微生物群落的丰富度呈正相关,第Ⅰ阶段两组发酵体系的菌群丰富度都有一定的下降,可能是由于体系中VFA质量分数突然增加使得物种仍处在适应期。随着发酵时间的延长,P组的物种丰富度基本呈现逐渐升高的趋势,而M组末期(第Ⅳ阶段)群落丰富度显著下降。Shannon指数与Simpson指数体现了局域均匀环境下的微生物群落的多样性,Shannon指数与多样性呈正相关,Simpson指数与之相反;前者强调丰富性,后者侧重于均匀性。总体上,M组的物种多样性不如P组,且发酵中后期(Ⅲ~Ⅳ阶段)OTU分布的均匀度显著降低。上述结果表明,混合发酵体系中古菌群落结构发生显著变化,物种多样性和分布均匀度都明显下降。表明VFA积累抑制了产甲烷过程,使古菌多样性下降。

表2 古菌群落多样性指数Table 2 Richnessand diversity of archaeal communities
图4 古菌和细菌的Shannon指数稀释曲线图Figure 4 Shannon rarefraction plot of archaeal and bacterial communities
P组与M组发酵体系中古菌群落在门、属水平上的分布结果如图5所示。在门水平上主要有2种优势菌门,其中广古菌门(Euryarchaeota)占绝对优势,相对丰度在95.41%~99.66%,泉古菌门(Crenarchaeota)约占0.23%~4.08%。目前已知的产甲烷古菌主要属于Euryarchaeota,能将厌氧消化过程中分解大分子有机物产生的乙酸、H、CO和甲基类小分子物质转变成甲烷。在属水平上,专性乙酸营养型的甲烷丝菌属()与氢营养型的甲烷微菌属()、甲烷球形菌属()以及甲烷短杆菌属()是2个体系中的优势菌属。其中,在PⅠ中升高至45.48%后保持相对稳定,而在M组中从M0的43.04%降低至MⅠ、MⅡ中的28.23%和21.49%。HINSBY等的研究表明,当相对丰度增加时,能够促进厌氧干发酵产甲烷过程,结合图1,M组中期甲烷含量较低,且该菌的相对丰度与日甲烷产量呈正相关,这与前期的研究结果一致。相对丰度在2个发酵组中随着时间的延长呈现先增加后减少的趋势,结合图2可知,阶段Ⅰ~Ⅱ中VFA质量分数处于较高水平(P组:22.35~26.34 mg·g;M组:24.58~32.17 mg·g),此时对应的该菌相对丰度较大(P组:21.96%~22.97%;M组:37.06%~38.32%),可见相对丰度与VFA质量分数呈正相关。只能专性利用H/甲醇产甲烷,无法利用乙酸和H/CO等物质,因此随着发酵过程中VFA的积累,2个体系中该菌的相对丰度均呈现降低趋势。对酸性不敏感且代谢类型多样,因此在2个体系的发酵后期均逐渐富集,其在厌氧发酵过程中相对丰度的变化没有特定的规律可循,仍需进一步的研究。此外,随着消化过程的进行,M组群落中氢营养型产甲烷菌(、、、和)总体相对丰度范围在57.09%~77.19%,这表明M组发酵体系中以氢营养型产甲烷途径为主。有研究表明,氢营养型产甲烷菌比乙酸营养型产甲烷菌有更高的活性,且在高VFA环境压力下大多数产甲烷菌会经历氢营养型产甲烷途径,推测在酸抑制环境下氢营养型产甲烷菌的占比与厌氧干发酵系统的产气性能密不可分。
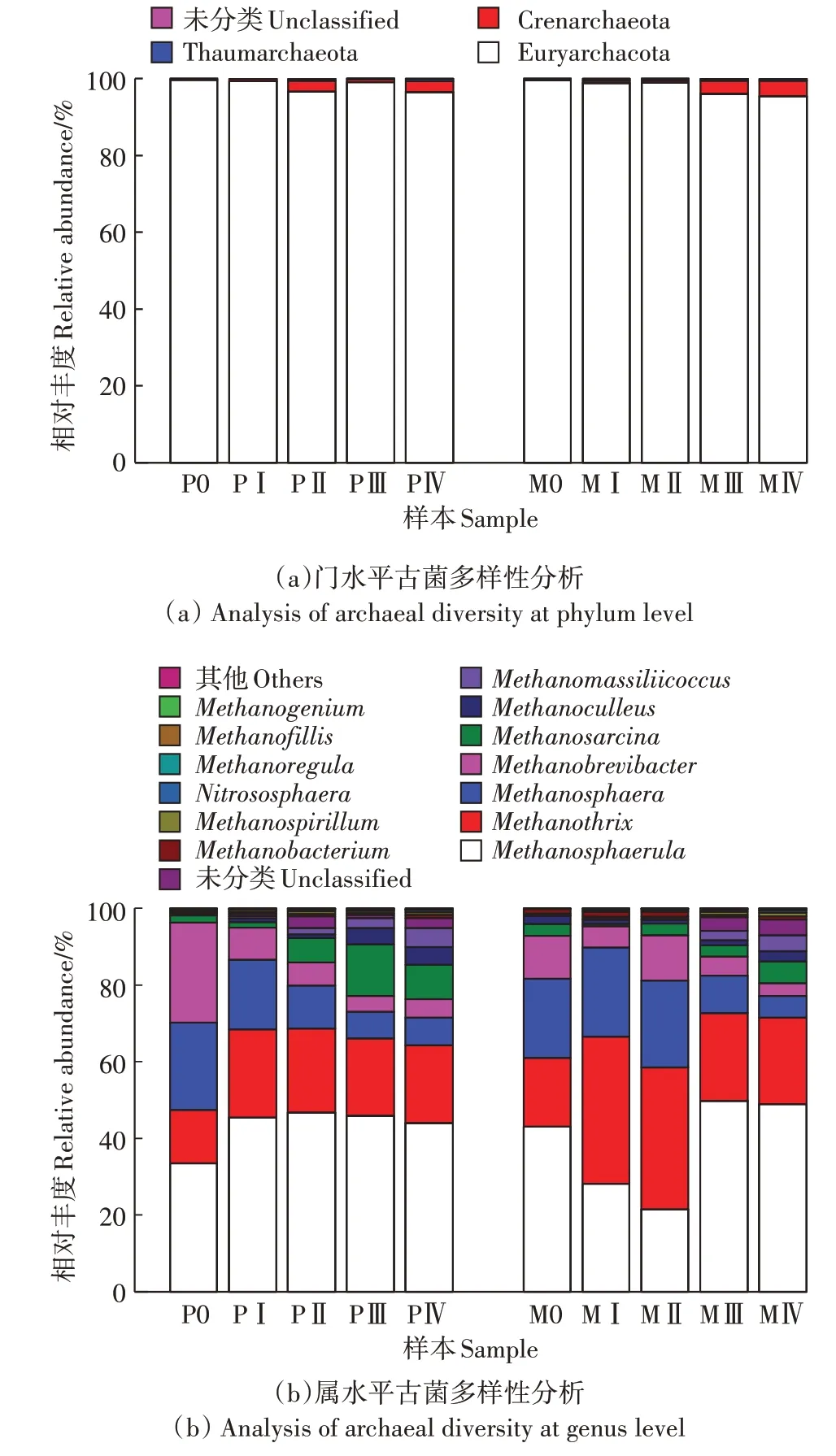
图5 古菌在门水平和属水平上群落结构多样性分析Figure 5 Analysis of archaeal diversities at the phylumand genus level
同古菌分析方法一致,细菌群落多样性指数见表3,Shannon指数稀释曲线(图4b)表明测序深度可靠。随着发酵时间的延长,M组中细菌丰富度逐渐增加并高于P组,可见混合原料发酵可以改善发酵系统中C/N,平衡营养,给予微生物充足的微量元素。总体上来说,较低的Simpson指数表明单独发酵的OTU分布更均匀。在厌氧发酵体系中,微生物群落多样性越高,产气性能越好。M0~Ⅱ阶段Shannon指数均分别低于P0~Ⅱ,可见M组前期的水解酸化阶段加重了体系内酸抑制效应。对比表2和表3,无论是单独发酵还是混合发酵体系,细菌群落多样性和丰富度均明显高于古菌。

表3 细菌群落多样性指数Table 3 Richness and diversity of bacterial communities
P组与M组发酵体系中细菌群落在门、属水平上的分布结果如图6所示。厚壁菌门(Firmicutes)是主要的优势菌门,相对丰度均在73%以上,最高达92%。其次是拟杆菌门(Bacteroidetes),占0.99%~16.51%,变形菌门(Proteobacteria)最高也有6.76%的占比。Firmicutes门多为水解型细菌,主要功能是将纤维素、木质素以及脂肪和蛋白质水解成为小分子酸;Bacteroidetes则可以将蛋白质等水解酸化为小分子有机酸。Firmicutes在M0~Ⅱ的相对丰度逐渐增加,说明玉米秸秆、粪便被较好地分解利用,秸秆的加入增加了接种物中潜在的电子供体含量,极大地刺激了微生物活性。此外,有研究报道Firmicutes能够形成内生孢子以抵御不良环境,因此即使在酸化严重的环境下该菌门的相对丰度依然很高。两个体系中,发酵末期(第Ⅳ阶段)Firmicutes相对丰度最低,而Bacteroidetes明显升高,这可能与大分子底物被分解消耗、小分子有机酸逐渐积累有关。Proteobacteria和绿弯菌门(Chloroflexi)常见于厌氧发酵体系,能够水解一定的有机大分子化合物,2菌门相对丰度在M组的发酵前期(Ⅰ~Ⅱ阶段)均呈现下降趋势(前者较初始阶段减少约588%,后者减少约113%),而在第Ⅲ阶段有一定程度回升(前者较第Ⅱ阶段增加2.50倍,后者增加4.20倍)。螺旋体门(Spirochaetes)能够水解利用半纤维素,M组末期(第Ⅳ阶段)该菌门相对丰度较前期(第Ⅰ阶段)增加约18.78倍。互养菌门(Syn⁃ergistetes)在厌氧发酵中也起到促进有机物的水解和酸化作用。有研究表明,在产酸阶段Synergistetes门的许多菌属可以与产甲烷菌共培养,将含4~8个C的直链脂肪酸降解为丙酸酯、乙酸盐和甲烷,同时可以通过与产甲烷菌的协同作用,将蛋白质降解成所需底物。而本研究中M组前期(Ⅰ~Ⅱ阶段)Syner⁃gistetes的相对丰度与M0时基本一致,仅占0.13%左右,而PⅡ阶段该菌相对丰度比P0时增加约1.56倍。在AKYOL等的研究中,对照厌氧消化池中前20 d VFA质量分数比经真菌预处理组高,此时对照组中Synergistetes相对丰度仅占0.1%,而在预处理组中占6.4%~7.5%。因此推测高VFA环境不利于Syner⁃gistetes生长代谢,阻碍了与产甲烷菌的协同作用,造成产气困难。

图6 细菌在门水平和属水平上群落结构多样性分析Figure 6 Analysis of bacterial diversities at the phylumand genuslevel
在2个发酵体系中,狭义梭菌属是绝对优势菌属,占32.74%~51.98%。该属不仅能够水解多糖促进产酸,还可以分泌降解复杂碳水化合物所需的酶。在2个体系中随着发酵时间的延长,的相对丰度均呈现先增加后减少的趋势。这是因为随着时间延长,该属生长代谢所利用的多糖被大量消耗,导致PⅢ阶段菌群减少,水解速率降低,而乙酸又被产甲烷古菌大量利用,结合图3,可以解释48 d乙酸质量分数显著降低。由于M组底物中添加了玉米秸秆,增加了纤维素含量,所以M组各时期该菌的相对丰度均高于P组。可以利用发酵体系中的葡萄糖产生氢,主要的代谢产物包括乙酸盐、甲酸盐和乳酸盐。在M组中,随着纤维素等多糖类被水解为葡萄糖,使得该菌在第Ⅳ阶段相对丰度最高,达12.68%。随着P组发酵后期丙酸质量分数的升高,相对丰度明显降低;同样,M组中也能观察到类似的现象,推测高质量分数丙酸对的生长代谢起抑制作用。因其参与初期的蛋白质水解代谢,在2个体系中发酵初期丰富度最高,占11.34%~13.69%,而PⅠ阶段下该菌相对丰度为6.68%,是MⅠ阶段下的1.87倍,可见高VFA环境会加速其失活。值得注意的是,unclassified菌属相对丰度最高可达12.11%(PⅢ样本中),因此仍需通过系统进化进一步分析其在发酵过程中的作用。
2.4 微生物系统进化分析
图7为前50个OTU代表性序列与数据库序列系统发生进化树环状图。根据分支情况和树枝长短情况来看,图a中,OTU为4、12、13的unclassified菌属与亚硝化球菌属()亲缘关系较近,对发酵体系的产甲烷性能没有明显的贡献。图b中,OTU45的unclassified菌属与可利用糖类产酸的、可分泌脲酶降解尿素的以及可参与初期蛋白质水解代谢的等菌同属一个分支,可见细菌属中检测出的这些未被分类的菌可能具有分解底物中有机物、加速水解酸化的作用。值得注意的是,被证实在厌氧消化中积极参与产酸过程,并转移电子给产甲烷古菌,可以增加甲烷产量;OTU38的unclassified菌属与同属一个分支,表明它可能具有增加甲烷产量的作用。

图7 古菌与细菌的系统发生进化树环状图Figure 7 Ring diagramof phylogenetic tree of archaea and bacteria
2.5 冗余分析
采用冗余分析对P组和M组的微观群落结构和宏观环境因子进行相关性研究,选取pH、SCOD、总酸、丙酸和乙酸5个理化指标(总酸、丙酸和乙酸均为质量分数,其中总酸指TVFA)。剔除不显著因素后,RDA模型结果见图8。对于P组,轴1和轴2分别解释了66.45%和25.97%的变异性,总体上微生物群落演变解释度为丙酸>SCOD>pH>总酸,因此影响P组微观生态的主要环境因子为丙酸。从样方分布来看,稳定产气阶段分布在二、三象限,且发酵第45 d与第78 d群落结构相似度较高。环境因子间的相关性表明,丙酸与pH的相关度较高,这与P组后期丙酸积累过多有关。物种与环境因子的相关性表明,和与TVFA和乙酸均呈极显著正相关,说明它们的存在促进体系中乙酸的增加,是分解纤维素产酸的主要贡献者。与丙酸呈极显著负相关,说明P组环境中逐渐积累的丙酸会抑制该菌的生长,进而影响体系的产气性能。丙酸的积累同样对和产生负面作用。对于M组,轴1和轴2分别解释了77.81%和18.86%的变异性。环境因子对M组微生物群落演变的解释度为pH>SCOD>总酸>乙酸,并且随着发酵的进行,样品从横轴的正端向负端移动,pH为该体系微生物结构变化的主要驱动因子,其解释度为45.3%。在轴2方向上,总酸、SCOD和乙酸对微生物群落结构的影响均较大,证明M组酸抑制作用明显,且体系中酸抑制主体为乙酸。对比P组,M组中和与乙酸呈负相关,说明酸抑制环境下乙酸质量分数的升高会对氢营养型产甲烷途径产生抑制作用。在轴1方向上,pH更多地解释了厌氧发酵过程中主要微生物菌群的变化。随着发酵时间的延长,M组中古菌主要优势菌属发生了演替,由转变为和。体系中的产甲烷途径从以乙酸营养型为主转变为氢营养型与乙酸营养型相结合的方式。结合图8a与图8b可知,厌氧干发酵过程中酸抑制的主体总是与体系中初始阶段的优势菌群呈负相关,因此酸抑制的发生对菌群结构的演替有很大影响。
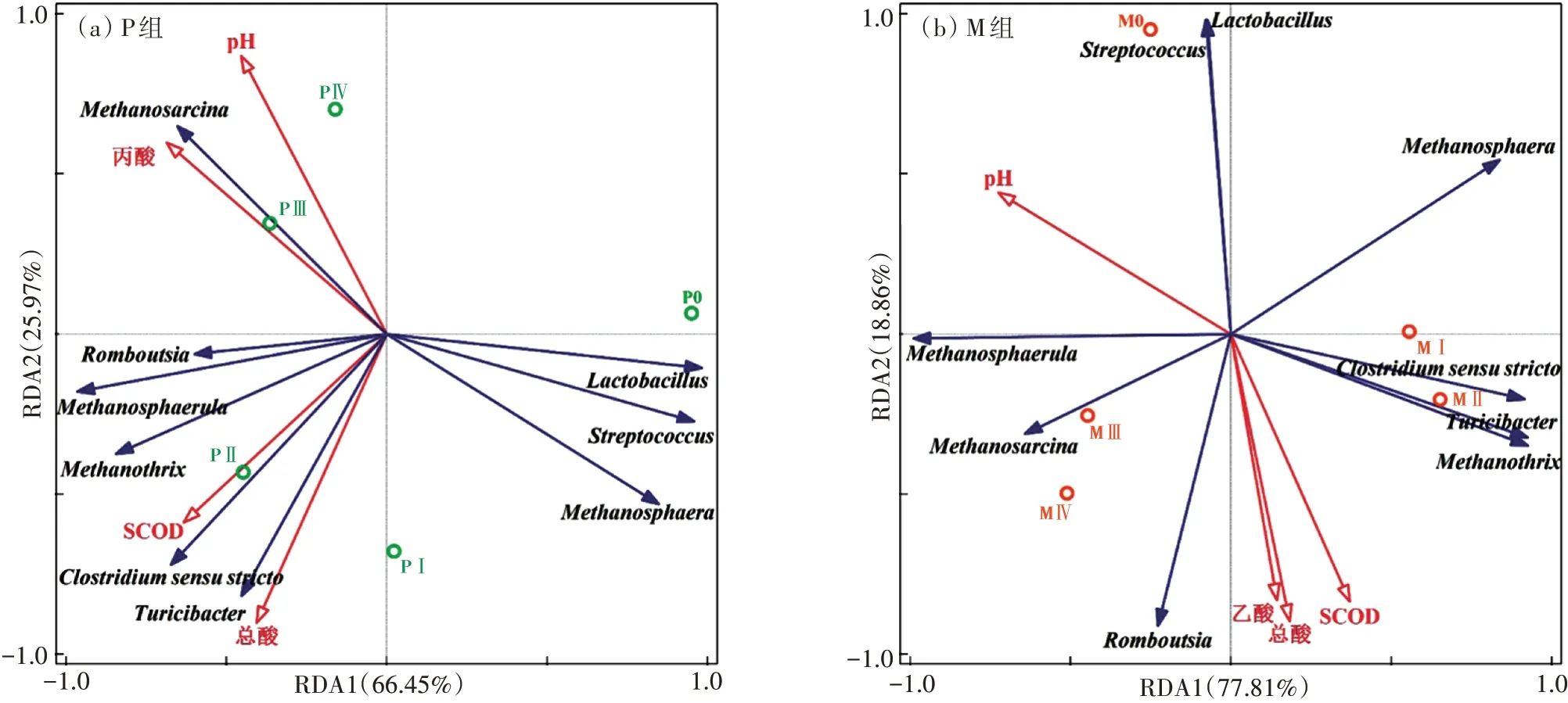
图8 单独发酵与混合发酵系统的冗余分析Figure 8 Redundancy analysis of mono-fermentation and co-fermentation systems
3 结论
(1)混合发酵体系中酸抑制效应严重,M组(猪粪秸秆混合发酵)前期产气性能明显较差,甲烷含量在56 d后呈明显上升趋势,表明体系中产甲烷菌可能在高VFA质量分数下逐渐恢复活力。
(2)可以促进厌氧干发酵体系产生甲烷,其相对丰度与日甲烷产量呈正相关;而相对丰度与VFA质量分数呈正相关。M组发酵体系中以氢营养型产甲烷途径为主。
(3)古菌中OTU为4、12、13的unclassified菌属,对发酵体系的产甲烷性能没有明显的贡献。而细菌中未被分类的OTU45和OTU38菌属应引起重视。
(4)影响2组发酵体系的主要酸抑制种类不同,逐渐积累的丙酸会影响P组(猪粪单独发酵)的产气性能,M组中酸抑制的主体为乙酸。酸抑制的发生对菌群结构的演替有很大影响,可见如何避免酸抑制是提高厌氧干发酵产气性能的关键。

