不同水分处理对华中地区稻田土壤酶活性的影响
鄢紫薇,高璟赟,张秀玲,杜丽君,徐晗,王玺,胡岚,林杉,胡荣桂*
(1.华中农业大学资源与环境学院,农业部长江中下游耕地保育重点实验室,武汉 430070;2.天津市生态环境监测中心,天津 300191;3.河北旅游职业学院,河北 承德 067000)
农田生态系统是陆地生态系统中最活跃的碳库,土壤中的有机碳受到土壤类型、生物活动和管理方式等因素的影响更易参与到碳循环过程中,从而使土壤中的有机碳在特定微生物的分解作用下产生大量的CO,进而对全球温室效应产生显著影响。水稻是世界上重要的粮食作物之一,我国水稻种植面积和产量均居世界前列,2019年我国稻田面积高达2 970万hm,因此,稻田碳库对陆地碳循环具有重要意义。
土壤酶活性和有机碳转化受到多种环境因素的影响,目前关于稻田土壤酶活性的研究多集中在种植模式、水肥管理、温度和改良剂添加等方面,而土壤氧化酶对不同稻田土壤有机碳及其相关性影响的研究相对较少。土壤酶主要由土壤微生物和动植物分泌以及通过分解动植物残体形成,其活性是评估土壤生态功能的重要指标,可以反映土壤中物质转化、积累、分解等生物化学过程的动向和强度。土壤有机碳可以作为酶的载体,在一定程度上刺激土壤微生物的活性以及酶的合成。相应地,酶可以促进土壤中秸秆等物质的分解,从而增加土壤中的矿质养分和有机碳成分。氧化酶可以在一定程度上促进土壤中有机物质的分解,从而释放出营养物质,对土壤中总有机碳的损耗和储存具有重要影响。其中酚氧化酶可以通过解聚或聚合土壤中的木质素分子以及酚类化合物,从而影响土壤有机碳的合成和分解。孔爱辉等对栎林和油松林土壤酶活性的研究结果表明,土壤可溶性有机碳(DOC)含量与酚氧化酶活性呈显著正相关。土壤含水率会在一定程度上影响酶的活性,含水率降低可以抑制植物生长,降低土壤中植物来源养分的输入,进而抑制微生物分泌胞外酶。土壤中的过氧化氢酶能促进土壤中过氧化氢的分解,是土壤合成腐殖质和缓解过氧化氢对土壤酶毒害作用的重要氧化还原酶系,可在一定程度上反映土壤中腐殖质的再合成强度和有机质的积累程度。对于庐山不同林分类型的土壤,过氧化物酶与DOC均呈现一定的负相关性,但不显著;而官会林等基于不同复种模式对烟地土壤酶活性的研究发现,提高酶活性可以促进土壤微生物生物量碳(MBC)与有机碳的积累。
综上所述,酚氧化酶和过氧化物酶对土壤有机质合成和分解具有重要意义,其活性直接影响着土壤有机碳的积累,进而对陆地生态系统的碳循环产生一定影响。因此,本研究以湖北省咸宁市贺胜桥镇和湖南省长沙市黄花镇稻田土壤为对象,研究不同水分处理下酶活性对土壤碳循环相关的土壤DOC的影响,旨在探究不同水分管理措施对稻田土壤碳循环过程的影响,为稻田不同管理措施对土壤肥力维持的评估提供指导依据。
1 材料与方法
1.1 试验区概况
用于试验的稻田土壤采自湖南省长沙市黄花镇(113°22′E,28°23′N)和湖北省咸宁市贺胜桥镇(114°38′E,30°03′N),两地均处于我国华中地区,属亚热带季风性气候,四季分明,雨量多集中于夏秋两季。其中长沙年平均气温16.8~17.2℃,年平均降水量1 422.4 mm,全年无霜期约275 d;咸宁年平均气温约16.8℃,年平均降水量约1 500 mm,全年无霜期约256 d。长沙土壤属红壤母质发育的红壤亚类,咸宁土壤属红壤母质发育的棕红壤亚类。供试土壤基本理化性质见表1。
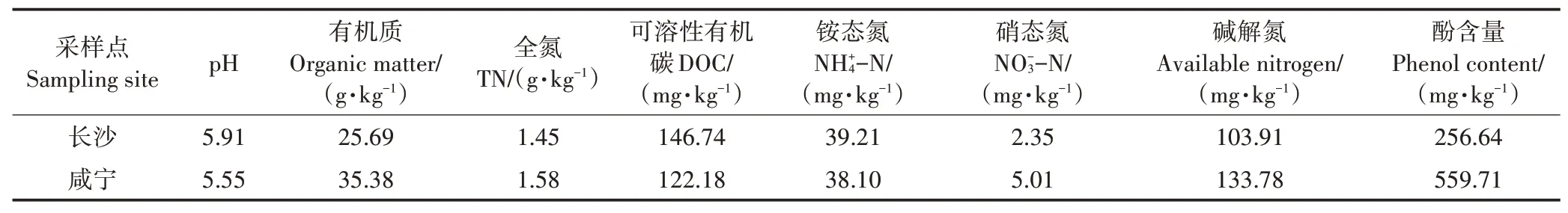
表1 供试土壤基本理化性质Table 1 Basic properties of the sampled paddy soils
1.2 试验设计
于早稻播种前采集试验点水稻田表层0~20 cm土壤,各土样均按S形5点取样法采集,随后用“四分法”混合均匀,并除去可见的动植物残体。部分土样过2 mm筛,于4℃冰箱中保存用于测定土壤氧化酶活性及土壤DOC、铵态氮、硝态氮、酚类物质的含量;其余土样自然风干,部分过2 mm筛后用于室内培养试验,另取部分风干土样过0.149 mm筛用于土壤总有机碳的测定。
取10 g土样于50 mL塑料离心管中测定土壤DOC含量,先加入少量蒸馏水使土壤持水量达到田间持水量的40%,用扎有些许小孔的封口膜封住离心管,放入30℃的恒温生化培养箱中,保水通气预培养10 d以消除干湿效应。预培养结束后,再向4个离心管中按称重法用胶头滴管进行水分补充,调整最终土壤水分含量分别为土壤田间持水量(WHC)的40%、70%、100%和200%,每个处理3个重复。继续放入培养箱中培养,并以水分调节充分后培养2 h的样品测定值作为培养初始值。在试验的第0、1、3、5、8、15、22、29、36、42 d采集土壤样品并进行分析,培养过程中,每隔2~3 d采用称重法用胶头滴管进行水分补充,保持土壤含水率。
土壤田间持水量的测定:将过2 mm筛的土样置于用棉球塞住的漏斗中,加去离子水浸泡2 h,加盖,除去棉塞,让水分自由下渗,放置过夜后,测定的土壤质量含水量即为田间持水量。土壤有机质采用重铬酸钾-浓硫酸外加热法测定;土壤全氮采用半微量开氏法测定;土壤pH采用酸度计电位法测定(水土比为2.5∶1);土壤铵态氮采用2 mol·LKCl浸提,靛酚蓝可见分光光度法测定;土壤硝态氮采用2 mol·LKCl浸提,氨基磺酸紫外分光光度法测定;土壤碱解氮采用碱解扩散法测定;土壤DOC含量采用德国El⁃ementer Vario TOC仪液体模块测定;土壤酚类物质(Phenolics)采用2%NaCO溶液2.5 mL和1 mol·LFolin-Ciocalteau试剂(Sigma)0.5 mL处理后分光光度计测定;酚氧化酶和过氧化物酶活性均采用L-DOPA法进行测定。
1.3 数据统计分析
采用Excel 2010对数据进行预处理,使用SPSS 22.0软件进行单因素方差分析(ANOVA)、多重比较和数据相关性分析,并用Origin 9.0软件进行图形绘制。文中处理间差异显著指<0.05,极显著指<0.01。
2 结果与分析
2.1 土壤含水率对土壤氧化酶活性的影响
2.1.1 对土壤酚氧化酶活性的影响
培养期间,两种土壤均是较高含水率的土壤酚氧化酶活性较高,较低含水率的酚氧化酶活性较低(图1)。较高水分条件下(100%WHC和200%WHC),有机质含量较高的咸宁水稻土酚氧化酶活性在培养的第3~15 d较高,在第5 d时200%WHC处理下达到峰值,为260.76 nmol·g·h,在培养第22 d后逐渐下降;有机质含量较低的长沙水稻土酚氧化酶活性在培养的第3~36 d较高,但其峰值较咸宁水稻土低,在第15 d时200%WHC处理下达到峰值,仅为107.10 nmol·g·h,在培养的第42 d时4种水分处理下酚氧化酶活性均趋于稳定。低水分条件下(40%WHC和70%WHC),两种土壤的酚氧化酶活性均较稳定,活性范围为20~50 nmol·g·h。4种水分含量处理下,土壤有机质含量高的水稻土酚氧化酶活性均高于有机质低的水稻土。
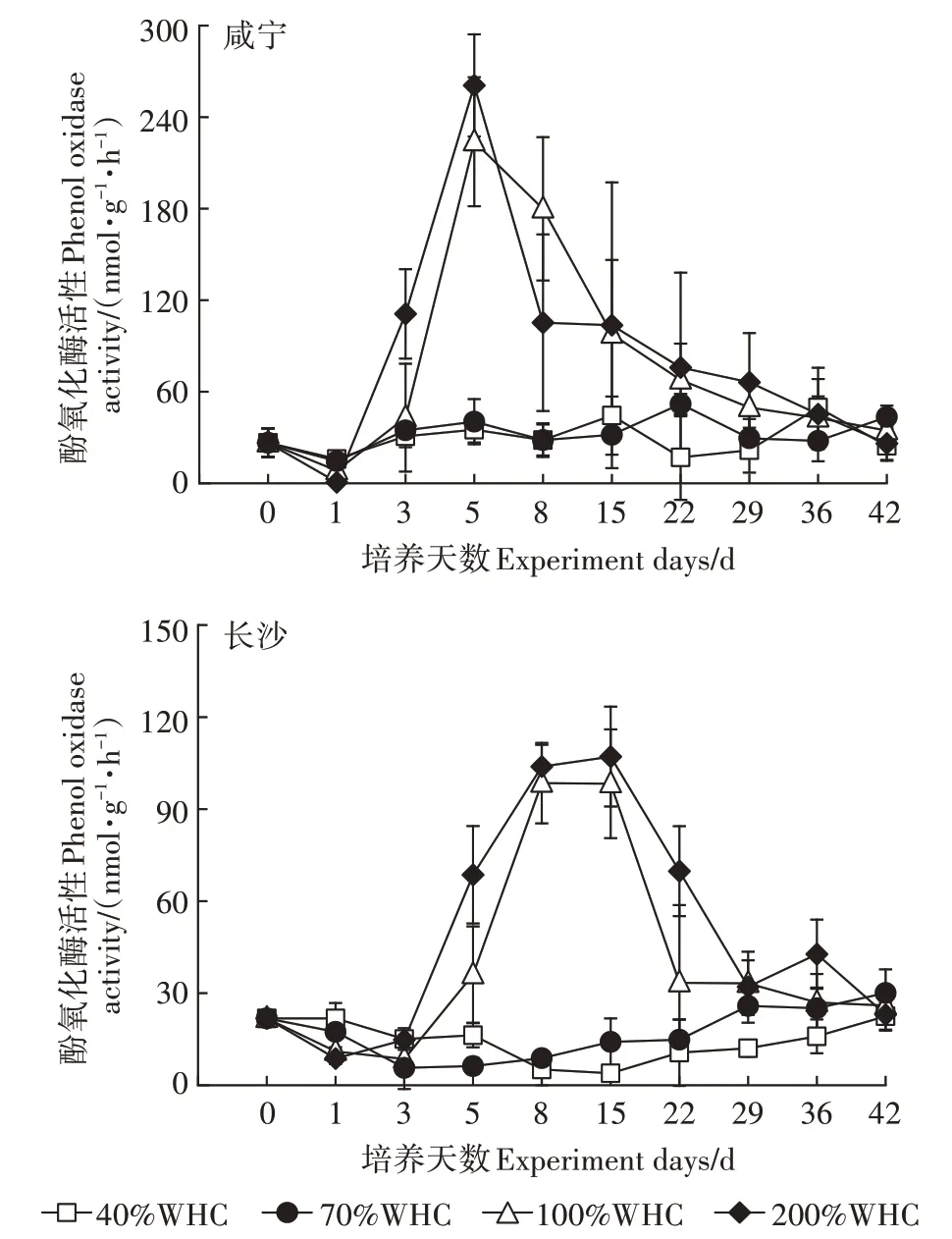
图1 不同土壤含水率对土壤酚氧化酶活性的影响Figure 1 Effects of different soil moisture on soil phenol oxidase activity
2.1.2 对土壤过氧化物酶活性的影响
如图2所示,培养期间两种土壤的过氧化物酶活性对不同水分处理的响应与酚氧化酶相似,均随含水率的增加而增加,但整体上过氧化物酶活性比酚氧化酶活性高,对水分的敏感性更强。较低水分(40%WHC和70%WHC)处理下,两种土壤中的过氧化物酶活性均处于较低水平,且随培养时间延长其含量始终较稳定,活性范围为10~60 nmol·g·h。在较高水分(100%WHC和200%WHC)处理下,两种土壤的过氧化物酶活性随培养时间延长均呈现出先增加后降低的趋势。200%WHC处理在整个培养过程中的过氧化物酶活性均大于其余3种水分处理,咸宁水稻土的过氧化物酶活性在第1~36 d均较高,在第5 d达到峰值,为929.66 nmol·g·h,长沙水稻土的过氧化物酶活性在第3~29 d较高,在第15 d达到峰值,为544.46 nmol·g·h。4种水分含量处理下,土壤有机质含量较高的咸宁水稻土的过氧化物酶活性平均值均高于有机质含量低的长沙水稻土。

图2 不同土壤含水率对土壤过氧化物酶活性的影响Figure 2 Effects of different soil moisture on soil peroxidase activity
2.2 土壤含水率对土壤酚类物质含量的影响
如图3所示,整个培养期间各水分处理下两种水稻土的土壤酚类物质含量整体均处于上下波动状态。对于不同水分处理,土壤中的酚类物质含量整体表现为40%WHC最高,而200%WHC最低。两种水稻土的土壤酚含量在第0~22 d变化波动较大,其中在第5 d时,两种土壤中40%WHC处理下的土壤酚类物质含量均达到峰值,在咸宁水稻土中峰值达到525.35 mg·kg,在长沙水稻土中达到270.00 mg·kg,而在第22~42 d各水分处理下土壤酚类物质均处于动态平衡状态,其中咸宁水稻土中土壤酚类物质稳定在317.77~410.79 mg·kg,长沙水稻土含量则较低,稳定在178.28~267.25 mg·kg。4种水分含量处理下,土壤有机质含量较高的咸宁水稻土的土壤酚类物质含量平均值均高于有机质含量较低的长沙水稻土。
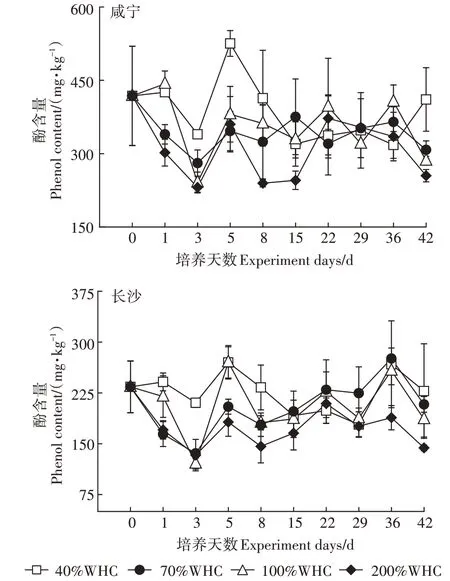
图3 不同土壤含水率对土壤酚类物质含量的影响Figure 3 Effects of different soil moisture on soil phenolic substances
2.3 土壤含水率对土壤DOC含量的影响
土壤DOC含量随水分的变化如图4所示,两种水稻土整体上均呈现先下降再上升再下降的趋势。咸宁水稻土中DOC含量在不同水分处理下表现为200%WHC处理下最高,70%WHC处理下最低,而在长沙水稻土中则为100%WHC处理下DOC含量最高,70%WHC处理下含量最低,说明土壤DOC含量也在较高含水率条件下较高,在含水率较低条件下较低。培养期间,两种水稻土的DOC含量在第0~15 d呈较稳定波动,从第22~29 d开始逐渐上升,咸宁水稻土在第29 d达到峰值,在200%WHC处理下为265.85 mg·kg,长沙水稻土在第22 d出现峰值,100%WHC处理下达到287.45 mg·kg,分别较DOC含量最低的70%WHC处理下增加了0.63倍和1.26倍。4种水分处理下,采自咸宁的水稻土与采自长沙的水稻土的DOC含量平均值没有显著差异。
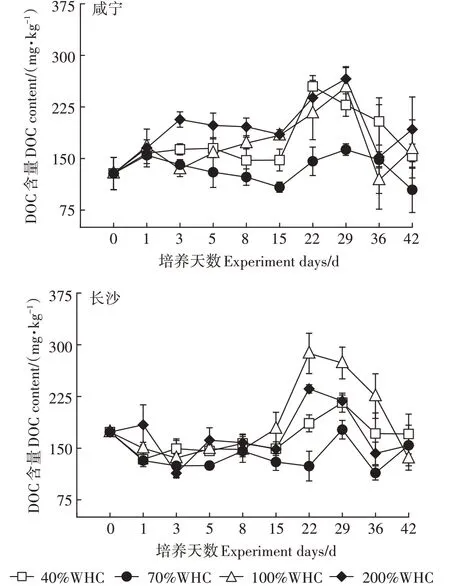
图4 不同土壤含水率对土壤DOC含量的影响Figure 4 Effects of different soil moisture on soil DOCcontent
2.4 酶活性与土壤DOC含量的相关性
从表2中可以看出,华中地区稻田土壤酚氧化酶与过氧化物酶活性呈极显著正相关(<0.01),且两种氧化酶活性均与酚类物质含量、土壤含水率、DOC含量呈极显著正相关,土壤酚类物质含量与DOC含量无显著相关性。

表2 土壤酶活性与DOC含量的相关性Table 2 Correlation between soil enzyme activity and DOCcontent
3 讨论
氧化还原酶与土壤有机质的转化、腐殖质及其各组分的形成都密切相关,其活性受土壤水分状况、质地和腐殖质含量等诸多因子的影响。本研究表明,有机质含量较高的咸宁市水稻土的氧化酶活性显著高于长沙市水稻土,这可能是因为较高的有机质提供了土壤物质循环的基质,促进了微生物活性,殷陶刚等也发现有机质含量与土壤酶活性密切相关。本研究中含水率与酚氧化酶活性、过氧化物酶活性均呈极显著正相关,土壤含水率的改变会影响土壤温度、土壤孔隙度、pH、土壤养分等,从而影响土壤中微生物生物量,进而影响酶的活性。在较高含水率下酚氧化酶和过氧化物酶活性均显著提高,而较低含水率下酶活性显著降低,这与叶德练等对稻田土壤进行节水灌溉处理后发现土壤酚氧化酶活性显著降低的结果一致。但也有研究表明土壤含水率增加会降低土壤中多酚氧化酶和过氧化物酶活性,这可能是不同类型和地域的土壤理化性状差异较大而造成的。酚氧化酶和过氧化物酶一方面会参与木质素的分解,加快被木质素包裹的纤维素的释放,从而为酶提供充足底物,进一步促进活性有机碳的形成;另一方面酚氧化酶和过氧化物酶会加快芳香族化合物的氧化,将土壤中的简单芳香族化合物氧化成醌类,与土壤中的蛋白质、糖类反应生成复杂有机物,有利于土壤中活性有机质的保留,为微生物提供碳源和养分,从而促进土壤中活性有机碳的积累。本研究中酚氧化酶活性和过氧化物酶活性呈极显著正相关,两者变化趋势基本一致,均随培养时间延长而先降低后增高再降低,这是由于随着培养的进行,土壤生物、理化性质等发生变化,土壤还原性增强,从而使得土壤酶活性受到相应的影响而呈现先增后降的趋势。
过氧化物酶活性较酚氧化酶活性对土壤含水率变化的响应更显著。王杰等对草原土壤酶活性的研究发现过氧化物酶活性在不同水分条件下无明显差异,但水分处理显著影响了酚氧化酶活性,表明酚氧化酶相比过氧化物酶对水分的敏感性更强,这与本研究结果不同,可能是由于不同水分处理以及不同土壤类型改变了土壤的通气状况,使好氧微生物作用发生变化,导致在通气状态下土壤不同酶分解有机质的速率不同,故土壤优势酶活性发生改变。本研究中的土壤酚类物质含量随土壤含水率变化差异不明显,总体呈波动状态,因为酚类物质的产生是由过氧化物酶和酚氧化酶在一系列氧化还原反应后共同作用的结果,故酚类物质的聚合和解聚作用处于动态平衡。土壤有机碳可以作为酶的载体,较高有机碳可以促进土壤中微生物的活动和酶的合成,复杂有机物通过聚解形成的DOC具有生物有效性,可以改变土壤中微生物的活性以及数量进而影响酶的活性。万忠梅等在研究湿地土壤酶活性以及DOC变化趋势时发现淹水条件下土壤DOC含量高于相对干燥的土壤,这与本研究中DOC含量在培养后期随含水率升高而增加的结论一致,同时DOC含量在不同土壤含水率下与氧化酶活性的变化趋势一致,说明酶活性越高,土壤中的碳矿化分解量越多,这是由于淹水提高了土壤有机碳的溶出,导致团聚体的分散,从而增加了表层DOC含量。
酶活性还受到微生物种类、土壤类型、施肥方式等多方面因素的影响,本研究只分析了在不同土壤含水率下酶活性、DOC含量的变化趋势以及相关性,对其他方面的影响还有所局限,未来应进一步分析不同环境因子对土壤酶活性的影响以及其对不同有机碳的响应机理,以期为不同水分条件下氧化酶活性对DOC含量的影响提供理论依据,为更加深入了解稻田碳循环过程提供思路。
4 结论
(1)有机质含量高的土壤酚氧化酶活性、过氧化物酶活性、酚类物质含量均显著高于有机质低的土壤。
(2)较高土壤含水率(100%WHC、200%WHC)可显著提高土壤的酚氧化酶活性和过氧化物酶活性,且在较高土壤含水率条件下土壤酚类物质含量和可溶性有机碳含量均较高。
(3)酚氧化酶活性、过氧化物酶活性、可溶性有机碳含量均与土壤含水率呈极显著正相关,且两种氧化酶含量与可溶性有机碳含量间呈极显著相关,表明氧化酶含量和土壤含水率均对土壤碳循环有一定影响。

