甘薯紫外光受体IbUVR8基因克隆及表达特性分析
李国良,林赵淼,张 鸿,许泳清,邱永祥,邱思鑫
(福建省农业科学院作物研究所,农业农村部南方薯类观测试验站,福州 350013)
光是影响植物生长和发育最重要的环境因子之一,不仅可以为植物进行光合作用提供辐射能量,而且可以作为信号分子调控其生长发育过程[1]。位于紫外区的UV-B对植物的生长发育具有双重作用,高强度的UV-B对植物体产生损伤,影响植物正常的生理功能,是逆境因子;但低强度的UV-B可以调控植物光形态建成和生理反应,是信号调控因子[2]。植物体内含有多种可以感受光照并产生信号传递的光受体,目前已经发现的植物光受体包括感受红光和远红光的光敏色素(phytochromes,phyA-E)、感受蓝光/UV-A的隐花色素(cryptochromes,cry1和cry2)和向光色素(phototropins、phot1和phot2)[3-4],以及感受中波紫外线(UV-B)的受体UVR8(UV RESISTANCE LOCUS8)[5]。自从拟南芥UVR8基因被第一个克隆鉴定以来,玉米[6]、番茄[7]、白桦树[8]、胡杨[9]、苹果[10]和紫花苜蓿[11]等越来越多植物的UVR8基因也被相继克隆出来,并被证实与其体内类黄酮物质的合成调控密切相关。
甘薯属于旋花科番薯属植物,是中国传统的粮食经济作物[12]。叶菜型甘薯是指以幼嫩茎叶等作为食用部位的一种蔬菜专用型甘薯品种。研究表明,甘薯茎叶含有丰富的蛋白质、碳水化合物、氨基酸、维生素以及矿物质等[13]。福建省农业科学院作物研究所于2016年育成了国内第一个紫叶叶菜型甘薯品种‘福菜薯23号’,因其叶片含有大量花青苷类物质而呈紫色,是研究甘薯花青素形成机理的优良材料。已有研究表明,紫外光UV-B对植物花青素的积累有促进作用,植物通过UVR8接收到UV-B信号后,引起了体内MYB、bHLH和WD40等3种转录因子响应,从而激活花青素合成途径中的结构基因,最终促进花青素的合成[14-15]。目前,UV-B对甘薯叶片花青素合成是否具有相同的作用尚不清楚,本研究从‘福菜薯23号’中分离到IbUVR8的基因全长序列,为深入研究IbUVR8在甘薯中的花青素合成调控作用奠定基础。
1 材料和方法
1.1 试验材料
试验材料为福建省农业科学院作物研究所选育的叶菜型甘薯品种‘福菜薯23号’(紫叶)和‘福菜薯18号’(绿叶)、以及‘观赏黄叶’(黄叶)3种不同叶色甘薯均种植于科研育种基地内。为了研究3种叶色甘薯不同组织及胁迫处理后IbUVR8的表达,将生长一致的3种叶色甘薯种植于培养盆中,放置在生长室(28 ℃,70%湿度,14 h光照和10 h黑暗)中培养。
大肠杆菌E.coli JM109、TransStart Top Green qPCR SuperMix、RNA提取试剂、Trans 2K DNA Marker、pEASY-T1载体等购自北京全式金生物科技有限公司。PCR扩增引物(表1)和DNA测序由上海生工生物科技有限公司完成。其他常规化学药品及试剂,除特别说明外,均购自Sigma公司或国产AR级试剂。
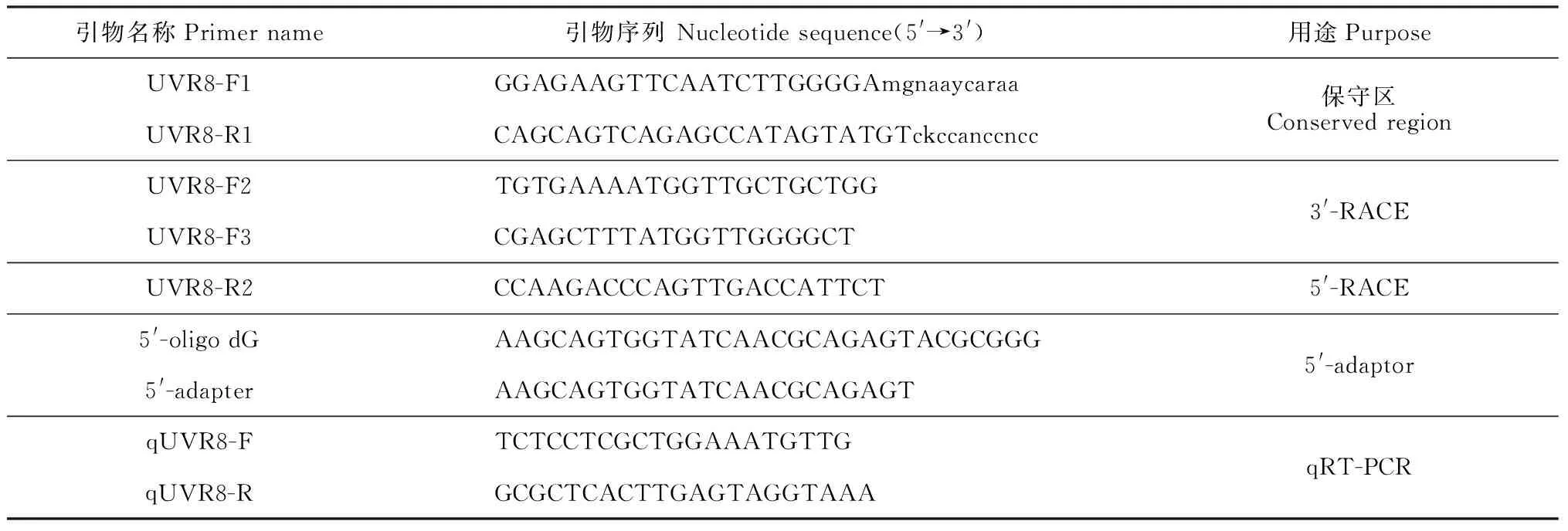
表1 试验中所涉及到的引物及其核苷酸序列
1.2 试验方法
1.2.1 甘薯cDNA第一链的合成液氮研磨后, 参照TaKaRa RNAiso plus提取甘薯叶片的RNA。采用Thermo Fisher RevertAid First Strand cDNA Synthesis Kit合成甘薯cDNA第一链, 逆转录的程序为:42 ℃孵育60 min,72 ℃变性5 min, -20 ℃保存。
1.2.2IbUVR8保守序列的同源克隆根据NCBI公布的马铃薯UVR8序列,采用CODEHOP方法设计简并引物。以‘福菜薯23号’cDNA为模板进行扩增,PCR反应程序:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min,35个循环,最后再72 ℃延伸10 min。扩增得到DNA片段回收纯化后,连接到pMD18-T载体,转化鉴定后测序。
1.2.3IbUVR8 3′和5′端的扩增根据已知UVR8基因片段和3′-RACE原理,以‘福菜薯23号’cDNA为模板进行IbUVR8的3′端的扩增,设计2条巢式引物UVR8-F2和UVR8-F3。PCR反应条件:94 ℃预变性4 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,35个循环,最后72 ℃延伸5 min。取1 μL第一轮PCR产物作为第二轮PCR反应的模板,以3′-F2和接头为引物扩增,将扩增的DNA片段连接到T载体、转化鉴定后测序。
按照5′-RACE原理,设计引物5′-oligo dG代替随机引物,采用Thermo Fisher RevertAid First Strand cDNA Synthesis Kit合成甘薯cDNA第一链,逆转录的程序为:42 ℃孵育60 min, 72 ℃变性5 min,-20 ℃保存。
设计特异性引物5′-adapter和UVR8-R2,采用Touch down PCR:94 ℃变性30 s,72 ℃延伸3 min,共5个循环,94 ℃变性30 s,70 ℃退火30 s,72 ℃延伸3 min,共20个循环。将扩增到的DNA片段连接到T载体、转化鉴定后测序。
1.2.4 生物信息学分析基因序列的编码区预测分析利用DNASTAR和NCBI的ORFfinder工具,同源性比较使用NCBI在线分析软件Blast(http://blast.ncbi.nlm.nih.gov),多重序列比对使用DNAMAN软件,蛋白质结构分析利用在线分析软件Protparam对IbUVR8蛋白的理化性质进行分析;ProtScale对IbUVR8蛋白进行亲水/疏水性分析;TMHMM 2.0进行跨膜结构预测和分析;COILS进行卷曲螺旋预测和分析;SOPMA分析蛋白的二级结构;SWISS-MODEL进行三维结构预测(https://www.expasy.org/),系统进化树使用Cluster X2和MEGA5.1软件构建。
1.2.5IbUVR8在不同组织的表达分别取生长1周后3种甘薯的根、茎和叶片,将所有样品在液氮中冷冻并保存在-80 ℃的冰箱中以备后用。每个处理3次重复。
1.2.6 非生物胁迫下IbUVR8的表达特性甘薯生长1周后开始进行胁迫处理:1)向土壤中添加0.5 mol/L NaCl 进行盐胁迫;2)向土壤中添加20%PEG6000 进行渗透胁迫;3)将植物移至温度为6 ℃的生长室中进行低温胁迫;4)向土壤中添加100 mg/L CuSO4进行重金属胁迫;5)土壤中添加100 mg/L GA3处理。每种胁迫分别处理0、4、8 h,所有样品在液氮中冷冻并保存在-80 ℃的冰箱中备用。每个处理3次重复。
1.2.7IbUVR8原核表达将IbUVR8通过同源重组构建到原核表达载体pGEX-4T-1上,并转化表达大肠杆菌BL21。然后进行IPTG浓度和诱导温度优化,最终获得IbUVR8蛋白,并进行SDS-PAGE电泳。
2 结果与分析
2.1 IbUVR8的全长cDNA克隆及生物信息学分析
2.1.1IbUVR8理化性质分析试验结果显示,从‘福菜薯23号’得到了全长为1 539 bp的cDNA片段,经NCBI-Blast分析表明,该序列为甘薯UVR8基因cDNA序列,并命名为IbUVR8,NCBI登录号KT749986。该基因ORF长度为1 329 bp,共编码了441个氨基酸,相对分子量为47 745.20 Da,理论等电点为5.72。
2.1.2 IbUVR8蛋白结构预测疏水作用是维持蛋白质结构最重要的作用力,对蛋白质的构象稳定性和功能具有重要意义。如图1所示,数据统计发现IbUVR8蛋白有198个亲水区域,67个疏水区域,蛋白平均疏水性为-0.362,为亲水性蛋白。
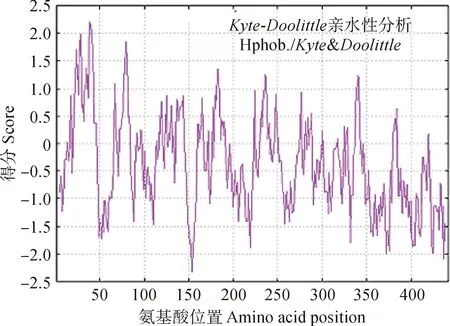
图1 IbUVR8亲/疏水性分析Fig.1 IbUVR8 hydrophilicity and hydrophobicity analysis
利用TMHMM 2.0对IbUVR8蛋白进行跨膜结构域的预测,如图2所示,该蛋白在24~46aa位置有1个明显的跨膜特征区域。蛋白质二级结构指的是蛋白质骨架结构中有规律重复的构象,SOPMA分析IbUVR8二级结构中α-螺旋、延伸带和无规卷曲各占13.12%、28.96%和57.92%。
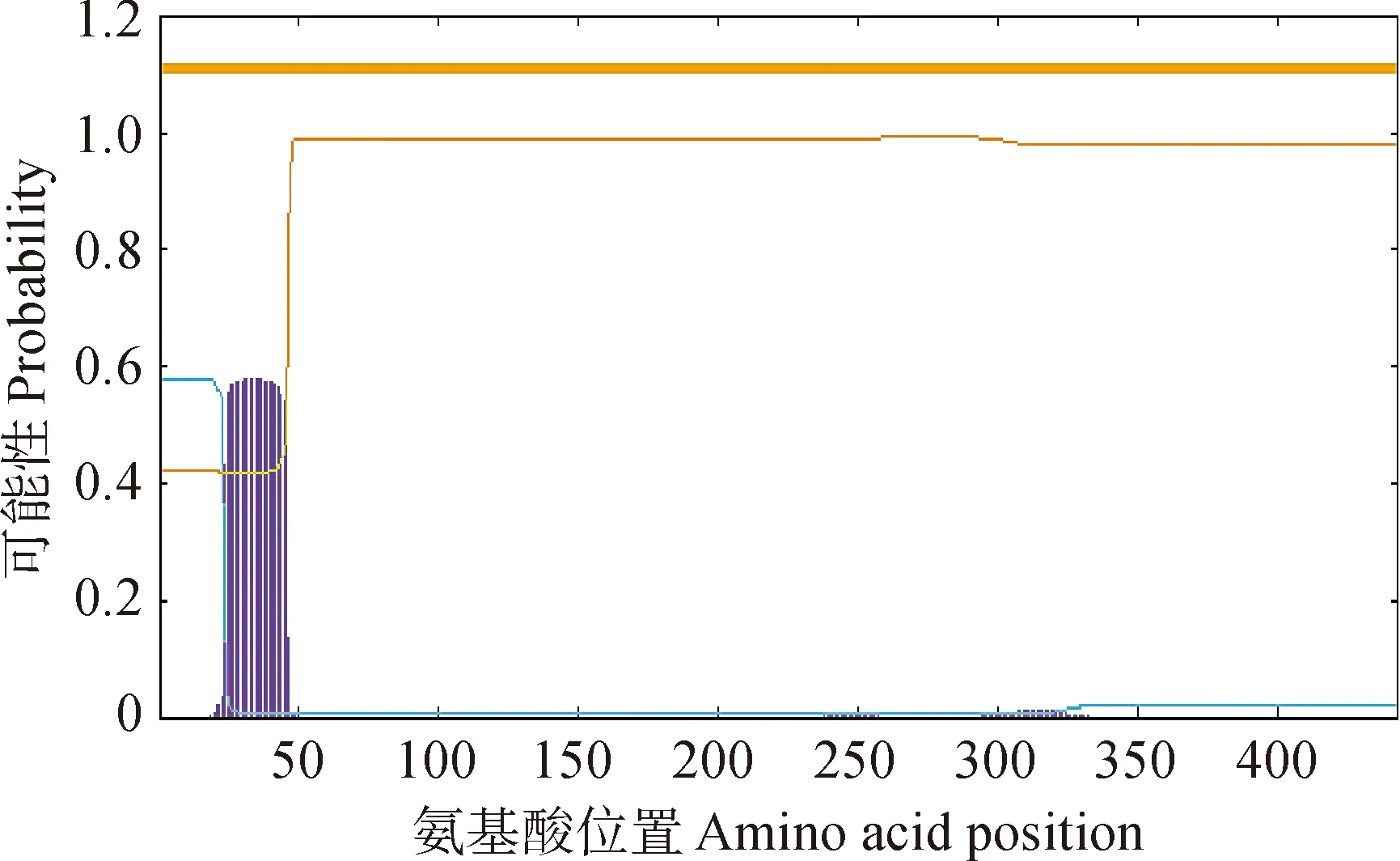
图2 IbUVR8的跨膜结构域分析Fig.2 Transmembrane domain analysis of IbUVR8
SWISS-MODEL预测IbUVR8的三级结构为类似拟南芥UVR8的结构,均由7个片状的β-螺旋纵向排列成环形结构,中空形成流水通道(图3)。WoLF PSORT预测IbUVR8亚细胞定位于细胞核。
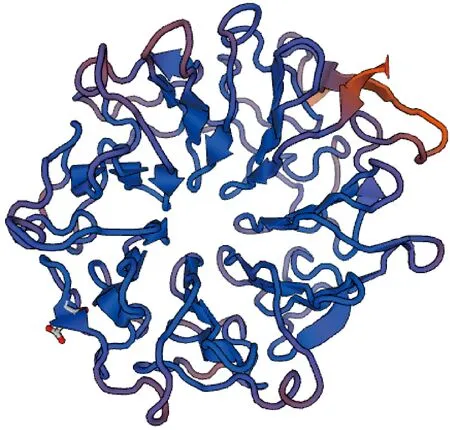
图3 IbUVR8的三级结构预测Fig.3 The predicted tertiary structure of IbUVR8
2.2 IbUVR8的同源性及进化分析
蛋白序列对比结果显示,甘薯UVR8与番茄、马铃薯UVR8亲缘关系较近,序列相似性在85%以上;与拟南芥、芜菁等亲缘关系较远,可分为两个大类,序列相似性在70%以上,说明UVR8的蛋白序列进化相对保守(图4、图5)。
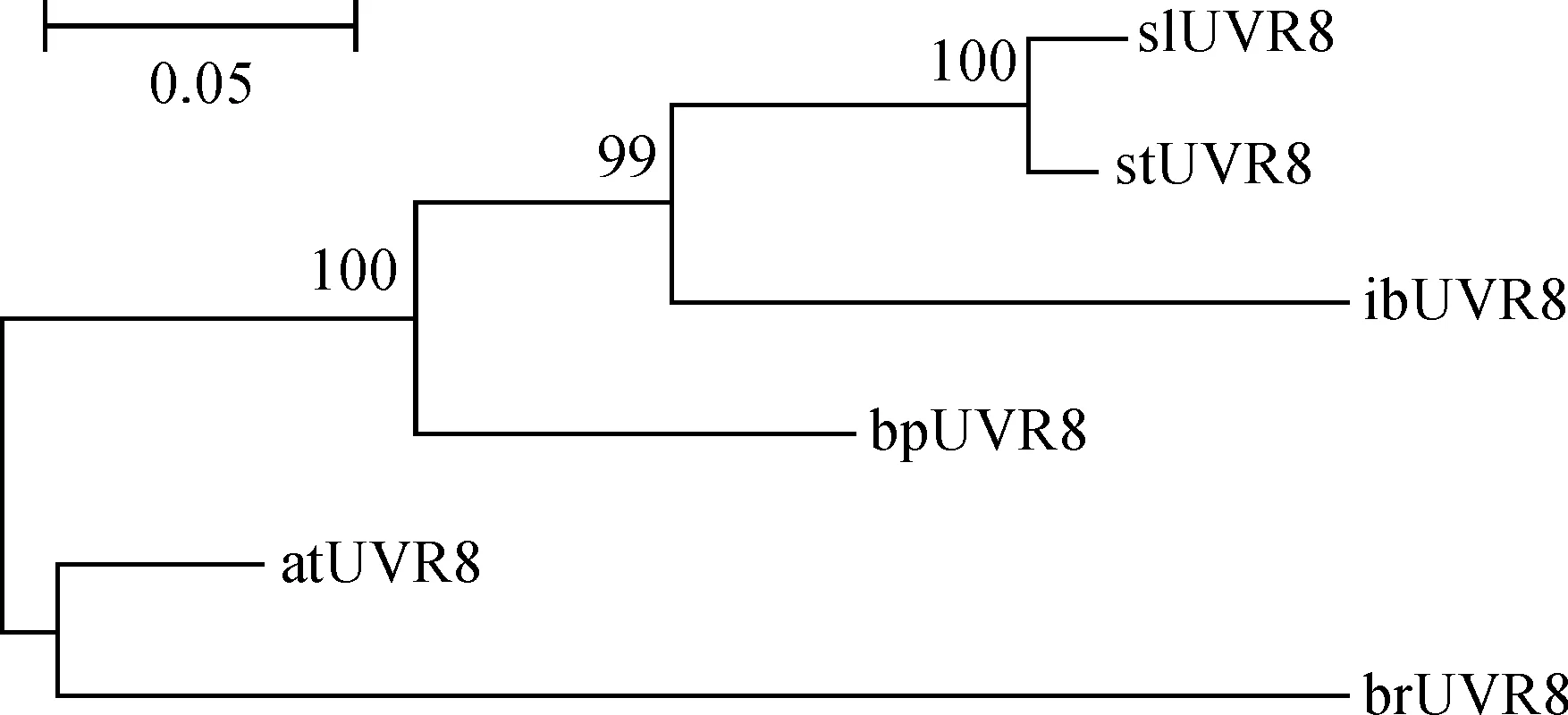
slUVR8. 番茄;stUVR8. 马铃薯;ibUVR8. 甘薯;bpUVR8. 白桦树;atUVR8. 拟南芥;brUVR8. 芜菁图4 IbUVR8的聚类分析slUVR8. Solanum lycopersicum; stUVR8. Solanum tuberosum; ibUVR8. Ipomoea batatas; bpUVR8. Betula platyphylla; atUVR8. Arabidopsis thaliana; brUVR8. Brassica rapaFig.4 Cluster analysis of IbUVR8
UVR8在植物体内的进化十分保守,不仅是被子植物,且苔藓植物、石松植物和绿藻植物与拟南芥UVR8氨基酸序列相似性都较高,尤其是关键氨基酸的位置和数目,包括盐桥网络中的色氨酸和精氨酸[16]。拟南芥UVR8具有吸收UV-B的特性,这个功能主要由色氨酸残基(W233和W285)完成,IbUVR8对应的色氨酸残基为W240和W292。拟南芥UVR8中的R286和R338的氢键作用对二聚体结构的稳定十分重要,IbUVR8对应为R293和R350[17]。
2.3 IbUVR8组织器官表达特性
qRT-PCR 结果显示,IbUVR8在3种叶色甘薯中的表达趋势一致,叶片表达量最高,茎段次之,根部表达量最低,且不同组织间的表达量差异显著,表明叶片是紫外光UV-B的主要响应部位。不同品种在同一组织部位表达量也有差异,黄叶甘薯叶片IbUVR8表达量高于另外两个品种,推测黄叶甘薯对紫外光UV-B比另外两种甘薯更加敏感(图6)。
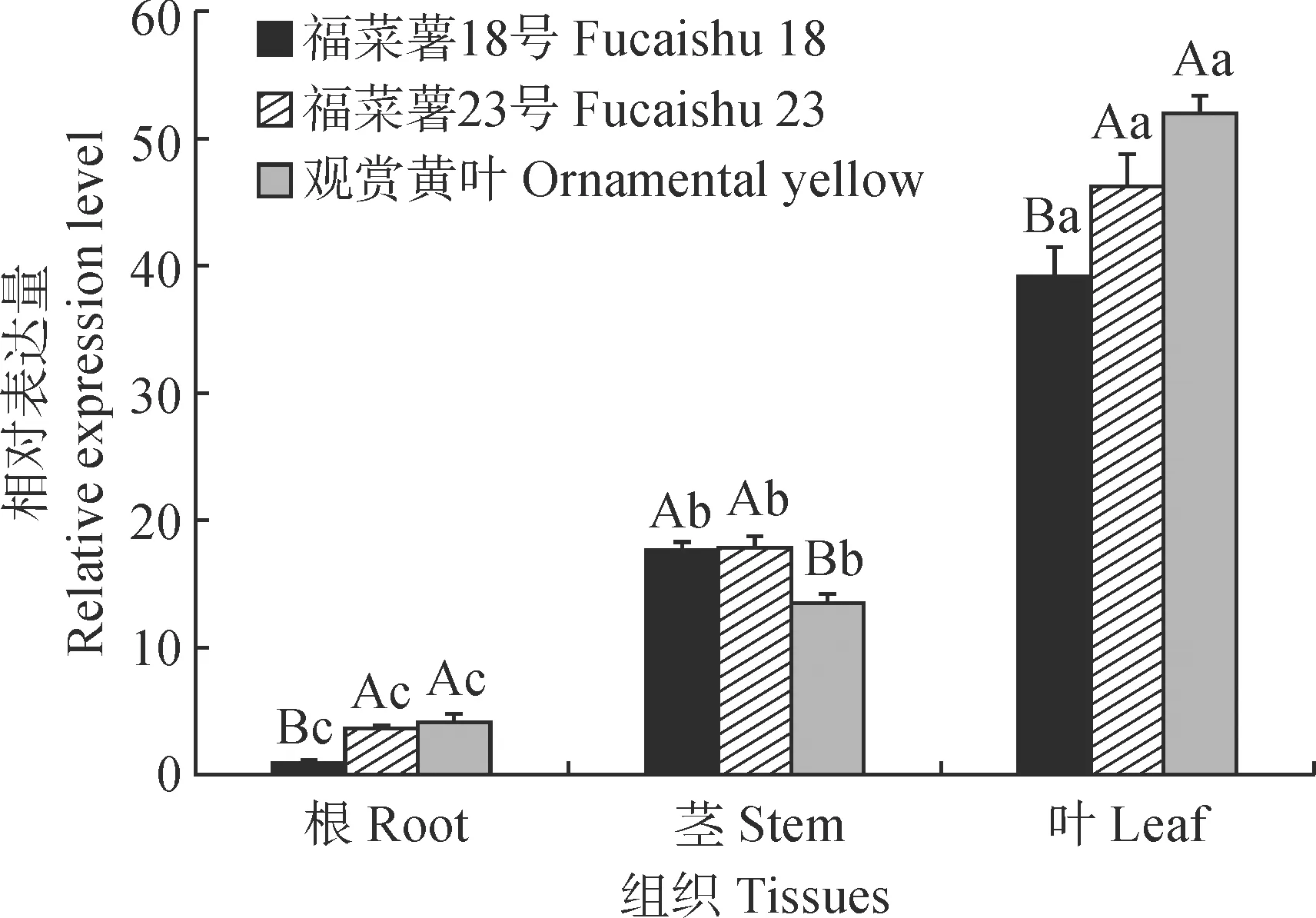
小写字母表示同一品种不同组织间在0.05水平差异显著,大写字母代表同一组织不同品种间在0.05水平差异显著图6 IbUVR8在3种甘薯不同组织中的表达Different normal letters indicate significant difference in different tissues for the same variety at 0.05 level; different capital letters indicate significant difference in the same tissue for different varieties at 0.05 levelFig.6 Expression of IbUVR8 in different tissues of three leaf-colored sweet potato varieties
2.4 IbUVR8在非生物胁迫下的表达特性
在不同胁迫处理下,IbUVR8的表达结果如图7所示,低温、干旱和盐胁迫处理下,3种不同叶色甘薯的IbUVR8表现趋势一致,均上调表达,但品种间在同一胁迫时间有显著性差异,如‘福菜薯23号’在干旱胁迫8 h的IbUVR8表达量显著高于其他两个品种,‘福菜薯18号’在盐胁迫8 hIbUVR8表达量显著低于另外两个甘薯品种。激素GA3处理下,在‘福菜薯18号’和‘观赏黄叶’中IbUVR8表现为先上调后下降,‘福菜薯23号’表现为上调趋势,胁迫8 hIbUVR8的表达量最大,且与另外两种甘薯有显著差异。在重金属铜胁迫下,3种叶色甘薯IbUVR8表达差异较大,‘福菜薯18号’的IbUVR8表达缓慢上调,‘福菜薯23号’表现为先上调后下降,胁迫4 h表达量最大;‘观赏黄叶’表现为胁迫8 hIbUVR8表达量迅速上升到最大值,造成3种叶色甘薯表达差异的可能是对铜盐的敏感性不同所致。
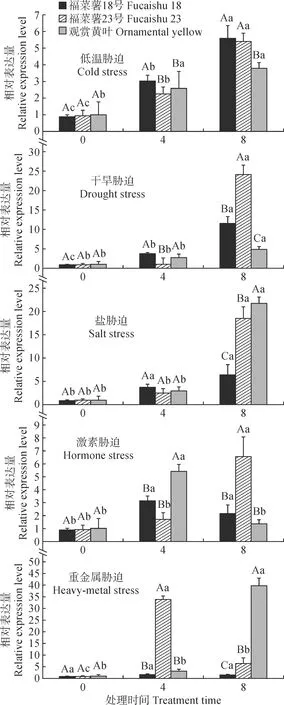
小写字母表示同一品种不同胁迫时间在0.05水平差异显著,大写字母代表同一胁迫时间不同品种间在0.05水平差异显著图7 IbUVR8在非生物胁迫下的表达Different normal letters indicate significant difference at different stress time points for the same variety at 0.05 level; different capital letters indicate significant difference at the same time point for different varieties at 0.05 levelFig.7 Expression of IbUVR8 under abiotic stress
2.5 IbUVR8原核表达
将IbUVR8构建到原核表达载体pGEX-4T-1上,并转化表达大肠杆菌BL21。经过IPTG浓度和诱导温度优化后,在0.5 μmol/L IPTG、16 ℃诱导14 h后,获得IbUVR8-GST融合蛋白,经SDS-PAGE电泳显示GST蛋白为29 kD,IbUVR8-GST大小约为80 kD(图8)。
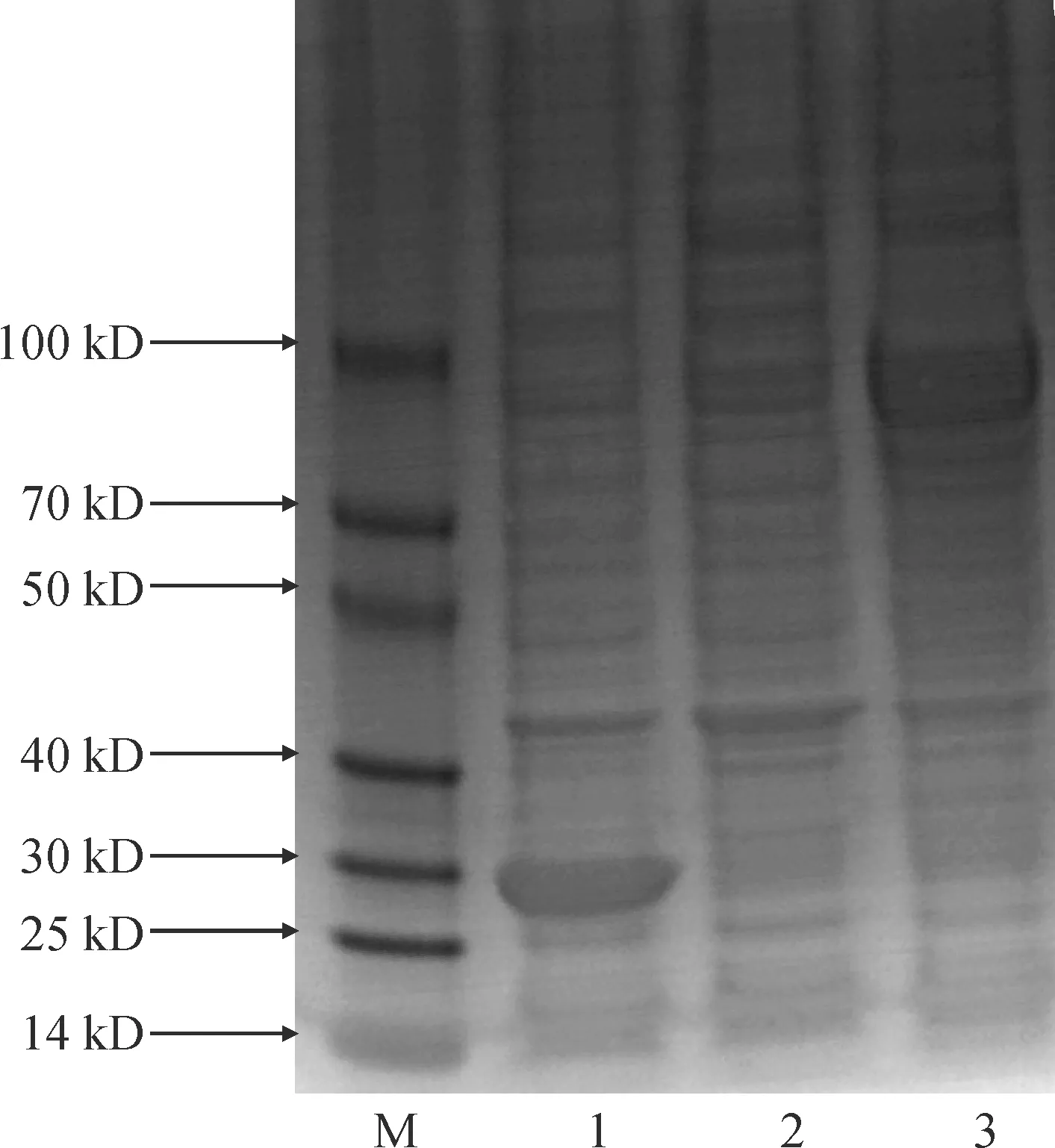
M. Marker;1. BL21(pGEX-4T-1)诱导的GST蛋白;2. BL21(IbUVR8-pGEX-4T-1)未诱导蛋白;3. BL21(IbUVR8-pGEX-4T-1)诱导的IbUVR8-GST融合蛋白图8 IbUVR8 SDS-PAGE电泳图M. Marker; 1. BL21 (pGEX-4T-1)-induced GST protein; 2. BL21 (IbUVR8-pGEX-4T-1) uninduced protein; 3. BL21 (IbUVR8-pGEX-4T-1)-induced fusion proteinFig.8 IbUVR8 SDS-PAGE electropherogram
3 讨 论
UV-B辐射调控植物形态发生是一个复杂的信号调节系统。UV-B信号通路分为特异性和非特异性两类,特异性信号通路与植物形态建成相关,而非特异性信号通路大多与胁迫信号相关[18]。UVR8是目前植物体内唯一发现的一种特异性吸收UV-B的光受体,自然状态下的UVR8为二聚体,在接收到UV-B信号后解聚成单体与COP1结合,并激活下游的bZIP转录因子HY5,诱导多个代谢通路基因的表达[5, 19-20]。拟南芥UVR8由440个氨基酸残基组成,其中,W285和W233为UVR8蛋白的关键发色团,R286和R338对维持UVR8的片层结构稳定十分重要[16]。甘薯UVR8则由441个氨基酸残基组成,具有与拟南芥相同的色氨酸发色团和片层结构,表明UVR8功能氨基酸区域和蛋白结构进化保守。早期研究发现拟南芥突变体uvr8-1表现为对UV-B敏感,查尔酮合酶(CHS)表达量低于野生型,推测拟南芥UVR8调控花青素合成基因的表达[5];通过基因芯片技术证实拟南芥成熟叶片多个类黄酮合成途径基因受到拟南芥UVR8的调控[21];MYB13是近期发现的拟南芥UV-B信号通路另外一个正调控因子,UV-B信号诱导MYB13在子叶中特异地表达,并与UVR8形成复合体,促进MYB13结合类黄酮合成途径基因如CHS、CHI和FLS的启动子[22]。拟南芥中的RUP1和RUP2是两个负调控因子,通过与UVR8蛋白的C27片段结合来抑制UVR8复合体的形成,并促进UVR8恢复成二聚体,影响其下游调控基因[23]。因此,推测IbUVR8可能通过多个路径影响体内类黄酮合成基因的表达,但是否与拟南芥通过相同的调控路径则需要进一步研究。
研究证实UV-B胁迫与其他非生物胁迫因子信号转导通路存在交互作用[24]。植物中非特异性UVR8信号途径能够与ABA途径联合作用来增强植物的抗旱性和抗高剂量UV-B辐射[25]。UV-B通过UVR8信号通路有效抑制高温诱导的植物热形态发生[26]。脱落酸(abscisic acid, ABA)和NaCl处理影响了白桦BpUVR8启动子的活性,导致BpUVR8表达量快速上升[8]。UV-B、镉、低温和盐胁迫均诱导了萝卜芽RsUVR8表达量升高,外源添加H2O2和硝普钠(NO供体)也能诱导RsUVR8表达升高,这种反应被H2O2清除剂和NO清除剂抑制[27]。本研究表明,IbUVR8表达具有组织特异性,在叶片中的表达量最高,叶片是UV-B信号直接接收部位。IbUVR8也受到低温、干旱和盐胁迫等的表达,呈现上升趋势;在GA3和Cu2+的胁迫下,但由于品种的耐性差异,导致不同品种IbUVR8表达趋势有所差异,研究表明UV-B可以通过改变赤霉素信号来影响拟南芥的根生长[28],外源施加赤霉素是否影响植物体内UVR8响应UV-B信号通路则需要进一步研究。
综上所述,本研究从甘薯中克隆获得了IbUVR8基因序列,并进行了逆境胁迫应答分析和原核蛋白表达,研究结果为深入研究IbUVR8基因的功能及利用IbUVR8进行甘薯叶花青素合成调控研究奠定了基础。

