禽腺病毒血清4 型SYBR Green Ⅰ荧光定量PCR 检测方法的建立与应用
卢清侠,金前跃,冯丽丽,柴永笑,5,郭振华,邢广旭,张改平
(1. 河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002;2. 河南省农业科学院 中英禽病国际研究中心,河南 郑州 450002;3. 江苏高校动物重要疾病与人兽共患病防控协同创新中心,江苏 扬州 225009;4. 河南省农业科学院 农业经济与信息研究所,河南 郑州 450002;5. 西北农林科技大学 动物医学院,陕西 杨凌 712100)
禽心包积液-肝炎综合征(Hydropericardiumhepatitis syndrome,HHS)是一种由禽腺病毒血清4型(Fowl adenovirus serotype 4,FAdV4)引起的急性传染病[1],主要临床症状表现为病鸡精神萎靡、嗜睡、食欲不振、拉绿色粪便,死亡率可达30%~80%,剖检可见病死鸡心包膜内出现大量淡黄色液体,肝脏发黄、肿大等。由于该病于1987年首次暴发于巴基斯坦的安卡拉地区,因此,也被称为“安卡拉”病。此后逐渐蔓延至世界多个国家和地区[2-4]。我国于2015 年7 月份左右首先在山东、河南等地暴发该病,随后全国多个地区先后报道了该病的出现,其导致的高死亡率对养鸡业造成了沉重的打击[5-10]。该病主要感染3~5 周龄的肉鸡,也可感染蛋鸡、鸭、鹅、鸽等[11-13]。同时,该病还会与其他禽病出现混合感染,秦玉华[14]通过临床流行病学调查发现,FAdV4和鸡传染性法氏囊病毒(Infectious bursal disease virus,IBDV)、鸡传染性贫血病毒(Chicken anemia virus,CAV)发生混合感染的比例较高。因此,精准快速的诊断对于临床该病的预防和控制尤为重要。
目前,针对禽腺病毒的检测方法较多,其中病毒分离鉴定、血清中和试验、琼脂扩散试验等传统检测方法虽具有一定的优势,但由于检测周期长、操作繁琐等,不适用于临床大规模检测应用。酶联免疫吸附试验(ELISA)和聚合酶链式反应(PCR)技术常作为疾病早期快速诊断的有力工具,其中PCR技术,特别是近年来发展迅速的荧光定量PCR,因其灵敏度高、特异性好、检测速度快和检测通量大等优点,适合大规模样本早期快速诊断。唐熠等[15]通过对建立的PCR、Real-time PCR、套式PCR 和LAMP 等4 种检测Ⅰ群禽腺病毒核酸的方法进行比较,发现Real-time PCR 检测具有最高的灵敏度。招丽婵等[16]针对Hexon基因建立了检测FAdV4 的TaqMan 荧光定量PCR 方法,其最低检测限为7.3×101拷贝/μL。刘琳等[17]也建立了最低检测限为5.0×101拷贝/μL 的TaqMan 荧光定量检测方法。但由于特异性探针的使用,其检测费用相较于SYBR Green染料法更高,这也成为其临床大规模应用的短板。
为了建立一种特异、敏感和廉价的FAdV4 临床检测方法,本研究基于不同血清型毒株Hexon基因的碱基差异[18],针对FAdV4Hexon基因保守区域进行扩增,以期建立一种荧光定量PCR 检测方法,为FAdV4 临床大规模早期快速诊断、疫病净化以及流行病学调查提供技术支撑。
1 材料和方法
1.1 病毒和细胞
FAdV4 ZZ 株(GenBank 登 录号:MN337322.1)由本实验室分离鉴定并保存,禽腺病毒血清8b 型(FAdV8b)、禽腺病毒血清11 型(FAdV11)、低致病性禽流感H9病毒(H9N2)、鸡新城疫病毒(NDV)、鸡传染性法氏囊病毒(IBDV)、鸡马立克氏病毒(MDV)、鸡传染性支气管炎病毒(IBV)以及鸡肝癌细胞系(LMH)均由本实验室保存。
1.2 主要试剂
FastStart Universal SYBR Green Master(ROX)购自Roche 公司;病毒基因组提取试剂盒(MiniBESTViral RNA/DNA Extraction Kit Ver.5.0)、DL2000和DL5000 DNA Marker购自TAKARA 公司;Q5®超 保 真2× 预 混 液 购 自NEW ENGLAND BIOLABS 公司;pEASY®-Blunt Cloning Kit 购自北京全式金生物技术有限公司;通用型DNA 纯化回收试剂 盒(Universial DNA Purificitation Kit)购 自TIANGEN 公 司;DME/F12 培 养 基 购 自HyClone 公司;青链霉素混合液和胰蛋白酶购自Solarbio 公司;胎牛血清购自Gibco 公司;0.22 μm 滤器购自Merck Millipore公司。
1.3 引物设计
参考GenBank 公布的FAdV4 全基因组序列,利用Primer Premier 5.0 软件设计FAdV4Hexon基因扩增引物(Hexon-F/R)和荧光定量PCR 引物(HeDL-F/R),片段大小分别为2 814 bp 和95 bp(表1),由上海生工生物工程有限公司合成。
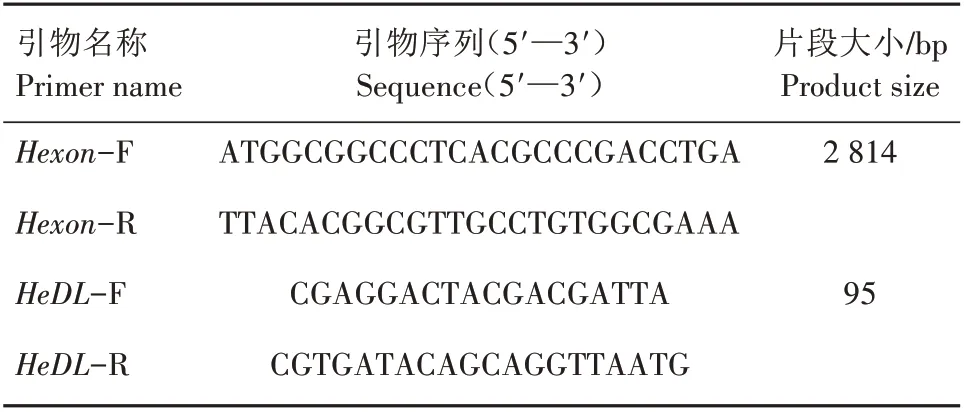
表1 引物序列Tab.1 Sequences of primers
1.4 病毒核酸提取
将试验所需病毒液反复冻融3 次后10 000 r/min 离心5 min,取上清液200 μL,按照TAKARA MiniBESTViral RNA/DNA Extraction Kit 产品说明书进行DNA抽提。
1.5 标准品的制备
以FAdV4 DNA 为模板,利用Hexon-F/R 引物进行PCR 扩增。反应体系:2×EasyTaq PCR SuperMix 10 μL、模板1 μL、上下游引物各1 μL,灭菌超纯水加至20 μL,于PCR 仪上进行扩增。PCR 反应条件:98 ℃预 变 性5 min;98 ℃15 s,58 ℃30 s,72 ℃1 min,30 个循环;72 ℃延伸10 min;停止于16 ℃。PCR 扩增产物经1%的琼脂糖凝胶电泳进行检测。阳性PCR 产物经胶回收后,与pEASY-Blunt 载体进行连接,并转化至DH5α感受态细胞,挑取单克隆后进行菌液PCR 鉴定及测序分析。将测序正确的阳性质粒命名为pEASY-Blunt-Hexon,并利用扩增引物和定量引物分别进行PCR鉴定。
使用超微量分光光度计NanoDrop 2000 对阳性质粒标准品进行浓度测定,并计算DNA拷贝数。
1.6 荧光定量PCR标准曲线的建立
将标准品质粒依次做10 倍梯度稀释,得到102—108拷 贝/μL 的 质 粒,以 此 作 为 模 板,采 用SYBR Green Master(ROX)中建议的反应体系和反应程序进行荧光定量PCR 反应,并利用软件进行分析,绘制标准曲线。
1.7 敏感性试验
将标准品质粒pEASY-Blunt-Hexon进行10 倍梯度稀释至101—107拷贝/μL作为模板,以无菌无酶水作为阴性对照,进行SYBR Green Ⅰ实时荧光定量PCR反应,每个浓度设3次重复,同时使用相同浓度的质粒进行常规PCR 反应,比较2 种方法的敏感性。
1.8 特异性试验
选取部分禽源病毒,包括禽腺病毒血清8b 型、禽腺病毒血清11型、低致病性禽流感H9病毒、鸡新城疫病毒、鸡传染性法氏囊病毒、鸡马立克氏病毒和鸡传染性支气管炎病毒,利用试剂盒进行核酸抽提,分别取等量的核酸作为模板进行荧光定量PCR检测,以FAdV4 病毒DNA 为阳性对照、无菌无酶水为阴性对照,每个样品做3个重复,考察检测方法的特异性。
1.9 重复性试验
分别取标准品浓度为7.1×107、7.1×106、7.1×105、7.1×104、7.1×103拷贝/μL的样品作为模板,进行批内重复性试验,即1 次检测进行3 个重复;批间重复性试验以上述样品为模板,进行3 次独立的荧光定量PCR 检测。最后根据Ct值计算其变异系数,验证检测体系的重复性。
1.10 病毒增殖检测
将FAdV4 ZZ 株接种于12 孔板单层LMH 细胞中,置于37 ℃、5% CO2培养箱中培养,分别于24、48、72 h 收集细胞与培养液于干净的2 mL 离心管中,反复冻融3次后,10 000 r/min离心5 min,将所收集的病毒液于超净台中过0.22 μm滤器,-80 ℃保存备用。使用上述核酸提取方法对各时间点病毒进行核酸提取,并应用建立的SYBR Green Ⅰ实时荧光定量PCR检测方法对其进行检测。
同时,取各时间点病毒液做连续10 倍稀释,并将稀释好的病毒接种于长满LMH 细胞的96 孔细胞培养板上,每个稀释度接种一纵排8 孔,每孔100 μL,逐日观察细胞病变并记录结果,观察5~7 d,最后根据Reed-Muench 法计算TCID50。对上述2种方法的检测结果进行比较,分析FAdV4 ZZ 株在LMH细胞上的增殖特性。
2 结果与分析
2.1 荧光定量PCR标准质粒的制备
将测序正确的标准质粒pEASY-Blunt-Hexon利用扩增引物和定量引物分别进行PCR 扩增,结果如图1 所示,扩增片段大小分别为2 814 bp 和95 bp左右,与预期片段大小一致,该结果表明成功构建了pEASY-Blunt-Hexon阳性质粒标准品。

图1 pEASY-Blunt-Hexon阳性质粒标准品鉴定Fig.1 Identification of pEASY-Blunt-Hexon positive plasmid standards
使用试剂盒提取阳性标准品质粒,利用NanoDrop 2000 测定其质量浓度为52.9 ng/μL,计算出其拷贝数为7.1×109拷贝/μL,-80 ℃保存备用。
2.2 荧光定量PCR标准曲线的建立
将标准品进行10倍梯度稀释,并对浓度为7.1×102—7.1×108拷贝/μL 的标准品进行荧光定量PCR检测,每个浓度设3 个重复,生成标准曲线(图2)。标准曲线的回归方程:y=-3.319x+38.737,R2=0.999,扩增效率(E)为100.122%。从溶解曲线(图3)可以看出,所有标准样品均在78 ℃出现单一峰,表明反应没有引物二聚体和非特异性扩增。
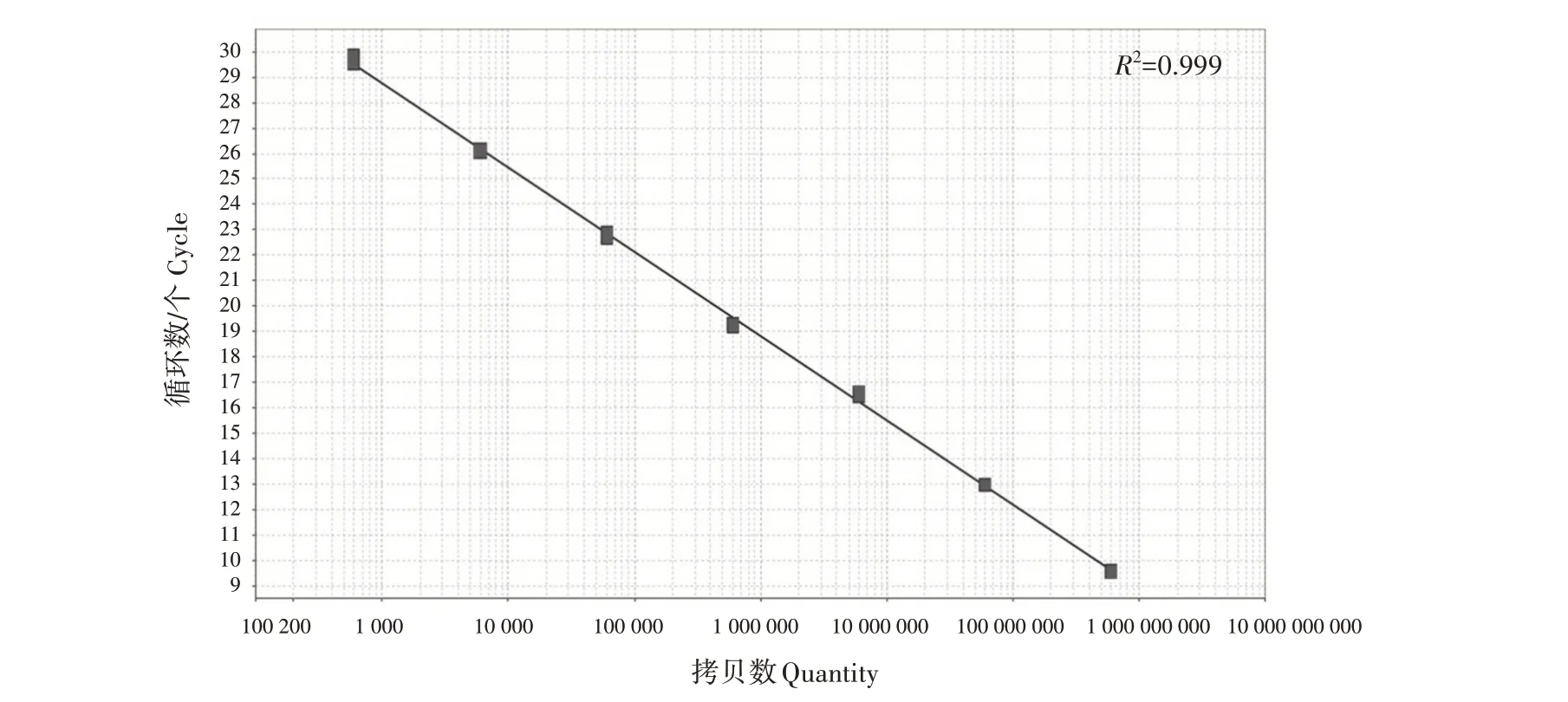
图2 FAdV4荧光定量PCR标准曲线Fig.2 Standard curve for fluorescent quantitative PCR of FAdV4
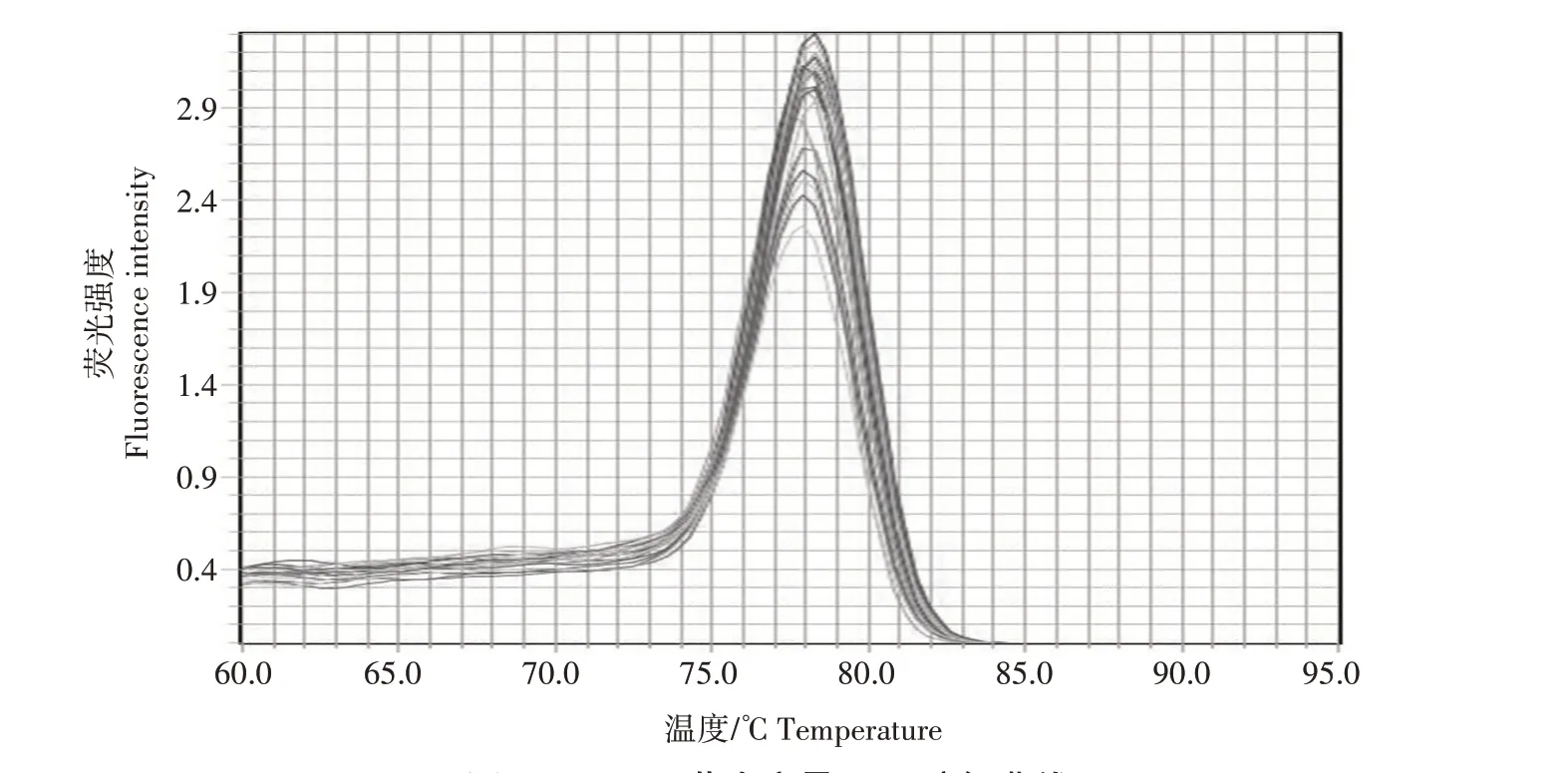
图3 FAdV4 荧光定量PCR溶解曲线Fig.3 Solubilization curves for fluorescence quantitative PCR of FAdV4
2.3 荧光定量PCR敏感性试验结果
从图4 可以看出,本研究建立的荧光定量PCR检测方法最低检测限为7.1×102拷贝/μL;而对相同模板所进行的常规PCR 结果显示,其检出的最低模板量为7.1×104拷贝/μL(图5)。表明本研究建立的荧光定量PCR 检测方法的灵敏度为常规PCR 的100倍。
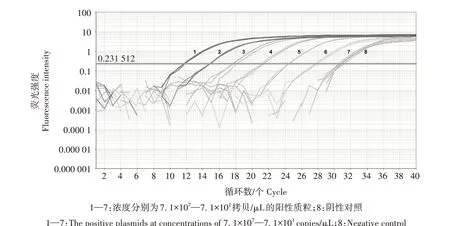
图4 FAdV4荧光定量PCR检测灵敏度Fig.4 The sensitive assay of fluorescence quantitative PCR of FAdV4
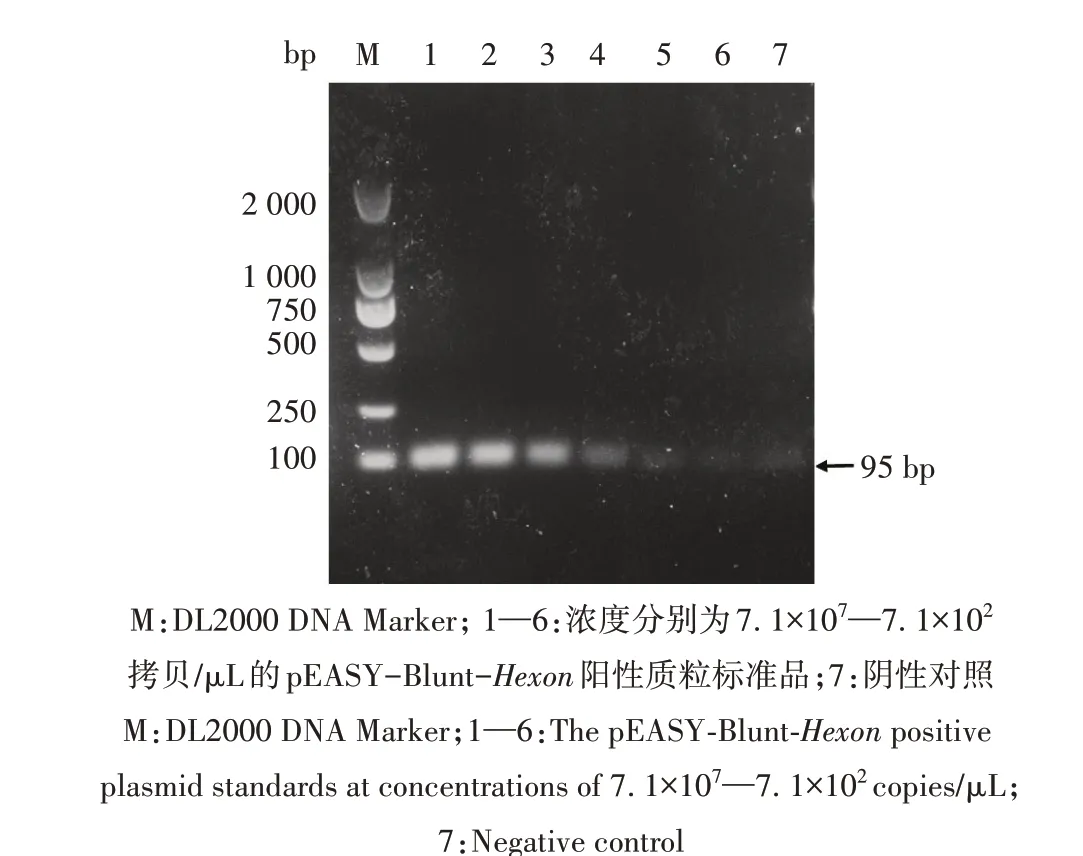
图5 FAdV4常规PCR检测灵敏度Fig.5 The sensitive assay of conventional PCR of FAdV4
2.4 荧光定量PCR特异性试验结果
利用所建立的荧光定量PCR 方法,在相同的体系及反应条件下,分别以FAdV4、FAdV8b、FAdV11、AIV(H9N2)、NDV、IBDV、MDV、IBV 的DNA 或cDNA 为模板,无菌无酶水为阴性对照,进行荧光定量PCR 检测,结果显示,除FAdV4 有明显的扩增曲线外,其他7 种病毒检测结果均为阴性(图6)。表明本研究建立的方法具有良好的特异性。

图6 FAdV4荧光定量PCR检测特异性Fig.6 The specific assay of fluorescence quantitative PCR of FAdV4
2.5 荧光定量PCR重复性试验结果
选取5 个标准品分别进行批内(表2)和批间(表3)重复性试验,对其结果进行统计分析,结果显示,批内和批间标准偏差均小于0.4,变异系数均小于2%,证明本研究建立的荧光定量PCR 检测方法重复性良好。

表2 荧光定量PCR批内重复性试验结果Tab.2 Intra-assay reproducibility of fluorescent quantitative PCR

表3 荧光定量PCR批间重复性试验结果Tab.3 Inter-assay reproducibility of fluorescent quantitative PCR
2.6 病毒增殖检测结果
对不同时间点所收集的病毒液进行核酸提取后,采用建立的荧光定量PCR 方法进行病毒拷贝数检测,同时使用相同的病毒液进行TCID50测定,根据结果绘制曲线(图7)。结果显示,随着病毒在细胞上增殖时间的延长,2 种方法所检测的结果均呈上升趋势,表明建立的荧光定量PCR 方法可用于病毒增殖的检测。

图7 FAdV4 ZZ株在LMH细胞上增殖后病毒滴度和病毒拷贝数检测结果Fig.7 Detection of virus titer and virus copy number of FAdV4 ZZ strain after proliferation on LMH cells
3 结论与讨论
2015 年以来,随着Ⅰ群禽腺病毒在我国鸡群中的不断蔓延流行,该病已成为当前危害我国养禽业健康发展的重要疫病[19],尤其HHS 通常以急性感染为主,临床上具有传播速度快、流行范围广和死亡率高的特点[20]。目前,荧光定量PCR 检测方法被广泛应用于动物疫病检测,特别是病毒性疾病的实验室检测,其不仅具有灵敏度高、特异性强等优点,还可以快速、准确地对病毒核酸进行定量[21]。常用的荧光定量PCR 技术主要有TaqMan 探针法和SYBR Green Ⅰ荧光染料法。TaqMan 探针法虽然具有高特异性和高灵敏性的特点,但荧光探针的使用也不可避免地增加了检测的成本。
本研究通过对FAdV4Hexon基因序列进行分析,针对其保守区域设计引物,成功建立了SYBR Green Ⅰ实时荧光定量PCR 检测方法,该检测方法与常规PCR 相比,不仅极大缩短了检测时间,而且灵敏性提高,最低检测限为7.1×102拷贝/μL;但与已有的探针法荧光定量检测方法相比[15,16],灵敏度略低,提示在引物设计方面还有进一步优化的空间。同时,也应注意到染料法荧光定量检测方法中,SYBR Green Ⅰ染料与双链DNA 的结合是非特异性的,这就要求引物设计时需特别注意避免引物二聚体的产生,以免引起假阳性的产生。本研究设计的引物在75~85 ℃出现单一的主峰,两侧无杂峰出现,说明不存在引物二聚体的产生和非特异性的扩增。本研究进一步评估了建立的荧光定量PCR检测方法的特异性和稳定性,结果显示,建立的检测方法不与FAdV8b、FAdV11、AIV(H9N2)、NDV、IBDV、MDV、IBV 等病毒发生交叉反应,批间重复分析显示变异系数均小于2%,提示本研究建立的检测方法具有良好的特异性和重复性。流行病学研究表明,我国流行的HHS 和包涵体肝炎(Inclusion body hepatitis,IBH)主要由Ⅰ群禽腺病毒的4 型(FAdV4)、8b 型(FAdV8b)以及11 型(FAdV11)引起[22-25],因此选择FAdV8b、FAdV11 血清型用于荧光定量PCR 特异性考察,结果表明,该方法可用于临床多种血清型混合感染时FAdV4 的鉴别诊断。此外,利用建立的荧光定量PCR 检测方法,评估了细胞培养液中病毒DNA 的含量,发现本方法测定的病毒DNA 含量与细胞培养液中的病毒滴度之间具有良好的相关性。因此,本研究建立的检测方法为快速评估病毒体外培养物和临床样品中的病毒载量提供了技术支撑。
综上所述,本研究建立了快速、特异和稳定的SYBR Green Ⅰ荧光定量PCR 检测方法,为FAdV4临床早期快速鉴别诊断、流行病学监测以及生物学研究提供了良好的技术支撑。

