气生微藻Heveochlorella sp. Yu作为生物柴油生产原料的特性研究
封雍婕,崔 娜,赵 鹏
(昆明理工大学 生命科学与科技学院,昆明 650500)
近年来,微藻产生的油脂和生物活性物质受到国内外研究者们的广泛关注[1-2]。微藻油脂作为第三代生物柴油的原料,具有环境友好、可持续再生等优点,但由于其产率低和微藻采收成本高,制约了微藻生物柴油的大规模工业化生产[3]。微藻油脂积累能力受微藻菌株差异性影响较大,常见产油微藻如:Endogenouschlorellasp.培养后生物量为2.14 g/L,油脂含量为10.80%,油脂产率为21.60 mg/(L·d)[4];ChlorellasorokinianaCY-1培养后生物量为1.68 g/L,油脂含量为15.07%,油脂产率为18.08 mg/(L·d)[5];Scenedesmusobliquus培养后生物量为2.32 g/L,油脂含量为25.00%,油脂产率为41.37 mg/(L·d)[6]。因此,选择合适的微藻菌株是提高微藻油脂积累能力的关键。
微藻因其在培养基中浓度低,体积小,细胞表面带负电荷等原因,其采收成本高,占生物柴油生产总成本的20%~30%,严重制约了微藻生物柴油的商业化[7]。因此,选择合适的采收方法,降低微藻的采收成本,是实现微藻生物柴油可持续发展的关键。目前,常见的微藻采收方法有离心法、过滤法、气浮法等[8-9]。但这些方法都存在能耗高、步骤多、成本高等缺点。近年来,絮凝法开始运用于微藻采收。絮凝法有化学絮凝法、生物絮凝法和自发絮凝法[9-10]。添加化学絮凝剂(化学絮凝法)或生物絮凝剂(生物絮凝法)虽然能提高微藻采收效率,却增加了工艺步骤和添加剂成本,并容易造成水体二次污染[11]。自发絮凝法是一种很好的微藻采收方法,在培养结束后,微藻细胞自发絮凝沉降,整个过程中无需添加任何外源添加剂,具有无毒、无二次化学污染、成本低等优点[12]。研究发现,细胞外聚合物(EPS)是影响微藻自发絮凝的关键因素之一[13]。EPS是一种由微生物分泌的胞外高分子聚合物,主要包括多糖和蛋白质,可以改善细胞黏附力,促进絮凝物形成,对絮凝有积极作用。EPS可以分为可溶性EPS(S-EPS),松散附着EPS(LB-EPS)和紧密黏附EPS(TB-EPS)3类[3]。各类EPS对微藻自发絮凝会产生不同程度的影响。
具有自发絮凝能力的微藻菌株有ScenedesmusobliquusAS-6-1、ChlorellavulgarisJSC-7、AnkistrodesmusfalcatusSAG202-9及EttliatexensisSAG79.80等[13-16],但是这些菌株的油脂积累能力并不理想。因此,找寻同时具有自发絮凝能力与较高油脂积累能力的微藻菌株将有利于降低微藻油脂的生产成本。
目前,微藻油脂的研究对象主要集中在水生微藻,而对气生微藻研究颇少。气生微藻主要存在于树木、岩石和土壤的表面[17]。研究表明,气生微藻不仅能够积累油脂,还能分泌大量的EPS来适应陆地生活[18]。气生微藻的多样性为找寻同时具有自发絮凝和高油脂积累能力的微藻菌株提供了可能。
微藻也是生物活性物质的来源之一[17]。γ-氨基丁酸(GABA)是一种非蛋白氨基酸,主要存在于动物、植物与微生物中,在微藻中鲜有报道[19]。GABA作为生物体的信号分子,调节多种生理信息,对多种精神疾病也有一定的疗效,具有较高的药用价值[20-21]。
本文对气生微藻Heveochlorellasp. Yu的生物量、油脂含量、油脂产率、沉降率以及GABA含量进行检测,旨在开发具有高油脂积累能力、细胞自发絮凝能力和生物活性物质潜力的微藻,拓宽可为生物柴油生产提供油脂原料的微藻菌株资源。
1 材料与方法
1.1 实验材料
气生微藻Heveochlorellasp. Yu(GenBank:MK829186),由昆明理工大学生物炼制课题组提供。Tris-醋酸-磷酸盐(TAP)培养基,pH调至7.0后121℃高温灭菌20 min。实验所用试剂均为分析纯。
恒温光照振荡摇床,90plus PALS Zeta电位分析仪,冷冻干燥机,超低温冰箱,高效液相色谱仪,高速冷冻离心机,Specord Plus分光光度仪,血细胞计数板,GC-MS分析仪。
1.2 实验方法
1.2.1 微藻的培养
将微藻接种到含有300 mL TAP培养基的500 mL锥形瓶中,初始细胞浓度为4.00×106个/mL,于25℃、150 r/min恒温摇床上进行培养。
1.2.2 生长曲线的绘制和生物量的测定
通过血细胞计数板对微藻细胞计数并绘制微藻的生长曲线。
将微藻培养至稳定期后,于13 000×g离心5 min,去除上清液后,用去离子水反复冲洗沉淀并离心,重复3次后得湿藻体,冷冻干燥后称重,计算生物量(以每升培养基中所含干藻体的质量表示)。
1.2.3 油脂的提取及油脂产率的测定
取1.2.2获得的干藻体,采用Bligh & Dyer法[22]提取油脂,按式(1)、式(2)分别计算微藻油脂含量和油脂产率。
CL=mL/mA×100%
(1)
式中:CL为油脂含量;mL为提取油脂的质量,mg;mA为干藻粉的质量,mg。
PL=mACL/(VT)
(2)
式中:PL为油脂产率,mg/(L·d);V为培养基体积,L;T为培养时间,d。
1.2.4 微藻油脂脂肪酸组成分析及相关指标测定
取100 mg微藻油脂,加入2 mL 3%硫酸-甲醇溶液,充分混合后,于70℃水浴中冷凝回流4 h,再加入2 mL正己烷,置于室温且转速为100 r/min的摇床上振荡萃取4 h,静置后取上清液(微藻油脂脂肪酸甲酯)用0.45 μm有机相滤膜过滤,进行GC-MS分析(分析条件见文献[23])。采用面积归一化法对脂肪酸进行定量。
微藻油脂脂肪酸甲酯的十六烷(CN)值和冷滤点(CFPP)等相关指标按照Ramos等[24]的方法进行测定。
1.2.5 微藻沉降率的测定
在自然条件下,将培养至稳定期的藻液移至英霍夫沉降管(Imhoff Cones)中,沉降2 h后,取藻液液面下5 cm的藻液样于1 cm光程750 nm波长下进行比色,按式(3)计算沉降率(η)。
η=(Da-Db)/Da×100%
(3)
式中:Da为开始沉降时藻液的光密度;Db为沉降2 h时藻液的光密度。
1.2.6 不同类型EPS的去除
根据Zhao等[25]的方法去除EPS。藻液于2 500×g离心15 min,获得的上清液为可溶性EPS(S-EPS)溶液。将沉淀(微藻细胞)重新悬浮在0.05%的氯化钠溶液中,于6 000×g离心15 min,获得的上清液为松散附着EPS(LB-EPS)溶液。然后,将沉淀重复悬浮过程,在磁力搅拌器混合搅拌30 min后,于11 000×g离心20 min,得到的上清液为紧密黏附EPS(TB-EPS)溶液。每步的沉淀用蒸馏水重悬测定微藻沉降率,可得到不同类型EPS对微藻沉降的影响。
1.2.7Zeta电位的测定[3]
采用Zeta电位分析仪测定微藻液的Zeta电位。
1.2.8 GABA含量的测定
采用高效液相色谱(HPLC)法测定微藻中的GABA含量[26]。
2 结果与讨论
2.1 微藻的油脂产率
微藻在不同的生长阶段,积累油脂的能力有很大差异。大量实验认为,微藻在稳定期前期油脂积累能力较强[27]。按照1.2.1和1.2.2的方法绘制气生微藻Heveochlorellasp. Yu的生长曲线,结果见图1。由图1可见,气生微藻Heveochlorellasp. Yu在第9天进入稳定期。
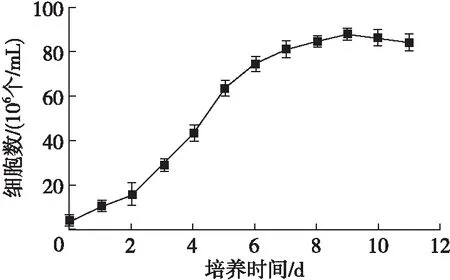
图1 Heveochlorella sp. Yu的生长曲线
按1.2.1方法将气生微藻Heveochlorellasp. Yu培养9 d,测定其生物量和油脂产率,结果见表1。

表1 不同微藻的生物量、油脂含量以及油脂产率
由表1可见,Heveochlorellasp. Yu的生物量为4.14 g/L,油脂含量为39.43%。微藻的生物量和油脂含量并无关联,且往往不是同步增加的,如:Aphanothece具有5.00 g/L的生物量,而油脂含量仅为8.00%[28];Neochlorisoleabundans则具有56.00%的油脂含量,但生物量仅为0.09 g/L[29]。因此,将油脂产率作为衡量微藻油脂生产能力的综合性指标已经成为广大科研者的共识。由表1还可看出,与其他研究相比,Heveochlorellasp. Yu显示出较高的油脂产率(181.38 mg/(L·d)),具有较好的开发潜力。
2.2 微藻油脂脂肪酸组成
Heveochlorellasp. Yu油脂脂肪酸组成及含量见表2。
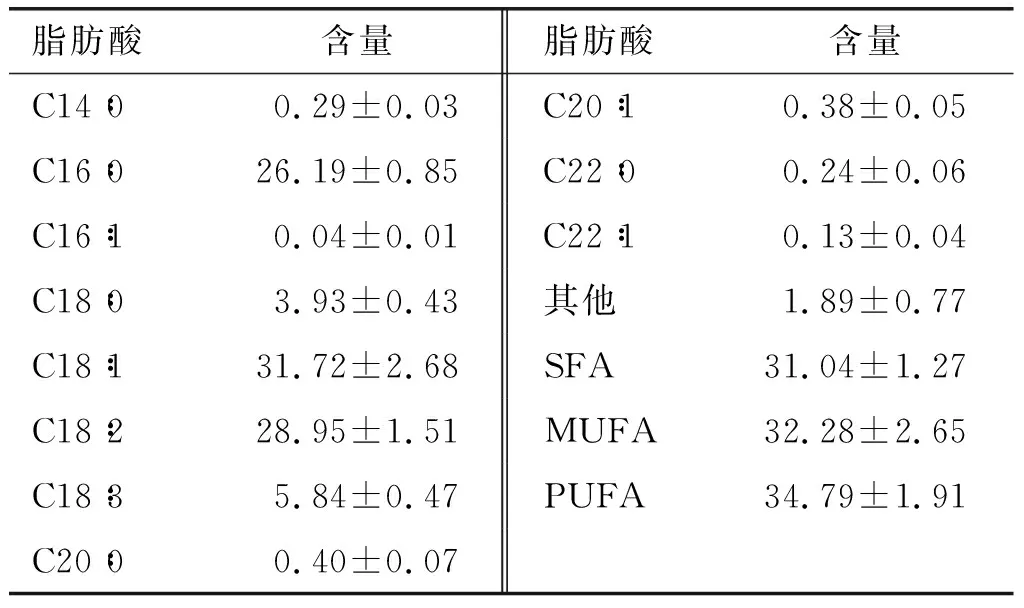
表2 Heveochlorella sp. Yu油脂脂肪酸组成及含量%
从表2可以看出,Heveochlorellasp. Yu油脂的主要脂肪酸是棕榈酸(C16∶0)、油酸(C18∶1)和亚油酸(C18∶2),均为16~18个碳原子的脂肪酸,符合生产生物柴油的要求。十六烷(CN)值是评价生物柴油燃料性能和抗爆的指标,按照生物柴油标准《生物柴油调合燃料(B5)》(GB 25199—2017)规定B5普通柴油CN值不低于45。经测定,Heveochlorellasp. Yu油脂脂肪酸甲酯的CN值为50.91,完全符合国家标准。冷凝点(CFPP)是衡量生物柴油低温下防冻性能的重要指标,CFPP值越低,则生物柴油的低温流动性越好,越利于运输和储存。根据所处的气候环境不同,各国对CFPP值有不同的规定。经测定,Heveochlorellasp. Yu油脂脂肪酸甲酯的CFPP值为-15.66℃,低温流动性较好,能够满足绝大部分国家标准中的规定。
2.3 微藻沉降率
采用絮凝法采收微藻,可使水体大幅浓缩,为下一步采用成熟的采收技术如离心等创造了较好的条件,有利于降低采收成本。已有许多研究者对微藻的絮凝进行了大量研究,如:Tan等[33]报道Scenedesmusdimorphus的自然沉降率为40%,加入高岭土絮凝剂后沉降率达到93%;Zhu等[34]在Chlorellavulgaris中加入250 mg/L壳聚糖后沉降率达到91.9%;Rahul等[35]在Botryococcussp.藻液中加入60 mg/L阳离子菊粉后沉降率为88.6%;Reyes等[36]向藻液中加入1 500 mg/L硫酸铁后,Scenedesmusspinosus的沉降率达到了61.6%。添加絮凝剂,微藻的沉降率有了很大的提升,但增加了絮凝的工艺步骤、微藻采收成本及水体二次污染。Salim等[37]发现具有自发絮凝的微藻Ettliatexensis在3 h内的自然沉降率可达到90%,但油脂含量仅有5.9%。实验发现,Heveochlorellasp. Yu在2 h内的自然沉降率为65.28%,随着沉降时间的延长可达到90%以上(数据未列)。虽然Heveochlorellasp.Yu的自发絮凝能力相比Ettliatexensis略逊一筹,但其却具有较高的油脂含量,能在降低采收成本的同时兼顾油脂积累,具有生物柴油原料的开发价值。
EPS与微藻的自发絮凝密切相关,微藻细胞可通过EPS连接聚集在一起形成细胞团块,加速细胞的絮凝沉降[13,37]。为了进一步了解不同类型的EPS在微藻自发絮凝中的作用,在本实验中依次去除各类型EPS,测定微藻细胞沉降率的变化,结果如图2所示。
由图2可见:去除S-EPS后,Heveochlorellasp.Yu的沉降率由65.28%下降为52.03%;进而去除LB-EPS后,沉降率下降为20.73%;最后去除TB-EPS后,沉降率下降为17.85%。S-EPS与微藻细胞结合较弱,往往溶于藻液中,因此对微藻细胞的黏附性影响不大。Pellicer-Nacher等[38]认为TB-EPS 较LB-EPS更具有黏连细胞的能力,有助于提高细胞絮凝能力。而本研究表明LB-EPS在微藻自发絮凝中起主要作用,可能是菌株差异所导致本研究中的LB-EPS具有特殊的多糖组分,尚需后续进一步的分析。

图2 去除不同EPS后Heveochlorella sp.Yu的沉降率
微藻细胞表面带有相同的电荷,会使细胞难以相互聚集,影响絮凝沉降。按1.2.1方法培养Heveochlorellasp.Yu 9 d,调节藻液pH后,测定藻液的Zeta电位和沉降率,结果如表3所示。

表3 pH对微藻Zeta电位和沉降率的影响
由表3可见,Heveochlorellasp.Yu自发絮凝时的Zeta电位为-10.00 mV,调节pH为3.42后,微藻细胞表面Zeta电位变为-5.00 mV,沉降率上升为72.89%,说明微藻细胞表面Zeta电位接近于零,有利于Heveochlorellasp.Yu的自发絮凝。
2.4 GABA含量
不同生物体GABA含量见表4。由表4可见:Heveochlorellasp. Yu的GABA含量为9.50 mg/g;Monoraphidiumsp. QLZ-3在自然培养情况下GABA含量可达到10.97 mg/g[38];发芽的蚕豆在缺氧-NaCl胁迫培养4 d后,GABA的含量为6.92 mg/g[39];Monoraphidiumsp. QLY-1在缺氮且添加茉莉酸和独角金内酯的条件下,GABA的含量为21.00 mg/g[40];Haematococcuspluvialis通过两阶段培养和盐胁迫的方法,达到38.57 mg/g的GABA含量[26]。GABA的含量差异较大,主要是由于物种和培养条件的不同所致。
3 结 论
将气生微藻Heveochlorellasp. Yu培养后油脂产率可达181.38 mg/(L·d),2 h自然沉降率为65.28%,且GABA含量为9.50 mg/g。Heveochlorellasp. Yu在具有较高油脂产率的同时又含有生物活性物质GABA,且具有自发絮凝能力,可大幅浓缩水体,为后续的采收减低负荷,具有为生物柴油生产提供油脂原料的开发潜力。

