臭氧处理对哈密瓜常温贮藏品质的影响
古丽丹·塔勒达吾,魏嘉怡,李 乾,刘彩红,王 静,冯作山
(新疆农业大学食品科学与药学学院,新疆果品采后科学与技术重点实验室,新疆 乌鲁木齐 830052)
哈密瓜属葫芦科甜瓜属[1],是典型的呼吸跃变型果实[2],因其口感爽脆、果肉甘甜、营养价值高等优点,深受广大人民喜爱[3],在新疆农业经济中占有重要的地位[4]。但因哈密瓜收获期正值高温季节,加之其含糖量高,水分多,在运销时极易受到致病菌的侵染,引起品质下降及腐烂[5],严重制约新疆哈密瓜产业的健康发展[6]。关于哈密瓜采后保鲜已有不少学者对此进行研究。李学文[7]发现使用1μ/L 1-MCP处理“早黄蜜”哈密瓜,可降低果实呼吸作用及腐烂率,延长保鲜期。陈俊嘉[8]研究表明:使用20 g/L壳聚糖涂膜处理“西州蜜17号”哈密瓜,可延缓果实可溶性固形物和VC含量的下降速度。50℃热处理“8501”哈密瓜可明显延迟果实呼吸高峰的出现[9]。0.5 g/L壳寡糖处理“西州蜜25号”哈密瓜可有效抑制果实硬度、抗坏血酸含量和可滴定酸含量的下降[10]。嘧菌酯处理“西州蜜25号”哈密瓜能有效抑制果实采后的腐烂[11]。葡萄专用袋套袋处理“雪里红”哈密瓜,能有效减少果实的表面病斑[12]。微波处理“金皇后”哈密瓜60 s可降低果实的呼吸速率和腐烂率等[13]。但是臭氧处理“西州蜜25”号哈密瓜的研究尚不多见。
臭氧(O3)是氧气(O2)的同素异形体[14],是一种具有特殊气味、不稳定的淡蓝色气体,具有很强的消毒、灭菌功能[15]。有研究表明:臭氧能够有效地抑制大肠杆菌、金黄色葡萄球菌等致病菌[16]。臭氧也是强氧化剂[17],能将乙烯氧化分解为CO2和H2O,减缓果蔬的新陈代谢,实现保鲜作用[15]。有研究表明:臭氧处理对柑橘[18]、鲜切西兰花[19]和巨峰葡萄[20]等果实表面的抑菌效果显著,可延缓黑宝石李[21]和库尔勒香梨[22]硬度的下降速率,有效抑制桑葚[23]和砀山酥梨[24]等果实的呼吸强度,保持柿子[25]和黄花梨[26]等果实的可滴定酸和VC,抑制菠菜[27]和红富士苹果[28]丙二醛(MDA)含量的上升,保持较高的过氧化物酶(POD)活性。截至目前,已有少量报道臭氧处理哈密瓜的研究。白友强[29]在低温(6~8℃)条件下采用浓度为4.28 mg/cm3臭氧、间隔时间24 h处理“西州蜜17号”哈密瓜40 min,可较好地保持甜瓜果实采后品质。王丽[30]采用100μL/L臭氧处理“河套密瓜”,并于5℃下贮藏,发现该处理使甜瓜的品质下降得到明显改善。但是对“西州蜜25号”哈密瓜采用10 mg/m3臭氧处理4 h,研究其常温贮藏效果尚未见相关报道。因此,本文以“西州蜜25号”哈密瓜为试材,采用10 mg/m3臭氧处理,并于常温下贮藏,分析其品质变化情况,以期为臭氧在哈密瓜贮藏保鲜中的应用提供理论参考依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
“西州蜜25号”哈密瓜,于2019年7月20日采收于新疆维吾尔自治区五家渠市商品瓜基地,挑选采摘质量为2.0 kg左右,可溶性固形物含量为10%~12%的哈密瓜。将采后果实单独套装发泡网,每4个装于1个标准纸箱,立即运送至新疆农业大学食品科学与药学学院冷库,在4℃下预冷12 h后进行臭氧处理。
草酸、酒石酸钾钠,天津市致远化学试剂有限公司;氯化钡,西陇科学股份有限公司;氢氧化钠、乙酸乙酯,国药集团化学试剂有限公司;酚酞、考马斯亮蓝G-250,天津市福晨化学试剂厂;乙醇,天津市鑫铂特化工有限公司;2,6-二氯靛酚,上海源叶生物科技有限公司;3,5-二硝基水杨酸,上海科丰实业有限公司;结晶酚,天津市风船化学试剂科技有限公司;亚硫酸钠,天津市盛淼精细化工有限公司;浓硫酸,成都市科隆化学品有限公司;蒽酮,上海展云化工有限公司。
1.1.2 仪器与设备
WZ-108 Brix手持式折光仪,上海亮研智能科技有限公司;LANCE电子天平,上海浦春计量仪有限公司;DZKW-S-4电热恒温水浴锅,北京市永光明医疗仪器有限公司;752 N紫外-可见分光光度计,上海光谱有限公司;GY-3硬度计,上海精密仪器仪表有限公司;HY-004S-4A臭氧发生器,广州佳环科技有限公司;DDS-307雷磁电导率仪,上海仪电科学仪器股份有限公司。
1.2 方法
1.2.1 处理方法
挑选出大小均一、无机械损伤、无病害、表面光泽的果实为试材。将挑选出的哈密瓜果实清洗干净后自然晾干,再将哈密瓜分批装于50 L具有上通气口的塑料桶中(塑料密封盖用塑料膜和多层胶带封口),开启臭氧发生器,用浓度为10 mg/m3的臭氧(臭氧浓度0 mg/m3为对照组)连续充气4 h,一次放入10个果实,对照组和处理组分别处理15次,每组分别为150个果实,每次处理间隔10 min。然后将2组果实放置于温度为(22±2)℃,相对湿度为45%的常温环境中。每3 d进行取样观察和相关指标测定,每次取样后不进行臭氧处理。从各组果实中分别随机取10个果实作为观察果,观察腐烂症状;测定相关指标时每次每组随机取3个瓜,每个瓜重复测定3次,共取样6次。
1.2.2 测定项目与方法
1.2.2.1 腐烂指数
参照陈存坤等[31]的方法进行测定。将哈密瓜按腐烂面积大小分为9级:0级为果实无病斑;1级为直径0.5 cm以下的分散零星小病斑在15个以上;2级:直径1.0 cm以下的小病斑在15个以上,或总斑面积小于3%;3级为最大病斑或病斑连成片直径1~3 cm之间不超过3个,或总病斑面积不超过5%;4级为最大病斑直径3 cm以上,全果病斑面积5%~10%;5级为全果10%~20%面积腐烂;6级为全果20%~40%面积腐烂;7级为40%~60%果面腐烂;8级为全果腐烂。腐烂指数计算公式:

1.2.2.2 呼吸强度
采用曹建康等[32]的静置法测定。用移液管吸取10.0 mL 0.4 mol/L NaOH至培养皿中,将培养皿放到呼吸室(玻璃干燥器)底部,放置隔板,将整个瓜称重后放入呼吸室,封盖,密闭30 min后取出培养皿,将碱液移入三角瓶中,加入5.0 mL饱和BaCl2溶液和2滴酚酞指示剂,并用0.1 mol/L草酸溶液滴定,同时进行空白滴定。呼吸强度计算公式如下:

式中:V1为空白滴定中草酸溶液用量,mL;V0为测定滴定中草酸溶液用量,mL;C为草酸溶液物质的量浓度,mol/L;m为果实质量,kg;t为测定时间,h。
1.2.2.3 硬度
参照曹建康等[32]的方法测定。将哈密瓜切开,使用硬度计分别在哈密瓜中部的2 cm处均匀取4个点测定果实硬度。硬度计算公式如下:
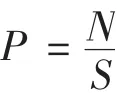
式中:P为果实硬度,kg/cm2;N为测力弹簧压在果实面上的力,kg;S为果实的受力面积,cm2。
1.2.2.4 抗坏血酸含量
采用2,6-二氯酚靛酚法[32]测定。分别在哈密瓜的前、中、后3个部位取10.0 g瓜肉组织,用10 mL 2%草酸冰浴条件下研磨,并定容至25 mL容量瓶中,静置10 min后,过滤收集滤液。用移液管吸取10.0 mL滤液置于100 mL三角瓶中,用标定过的2,6-二氯酚靛酚溶液滴定至出现微红色且15 s内不褪色,记录染料用量,试验重复3次,同时进行空白试验。
1.2.2.5 可溶性固形物含量
参照张慧杰等[33]的方法,使用手持式折光仪测定。分别在哈密瓜的前、中、后3个部位取瓜肉组织10.0 g,用打浆机打碎,再用纱布过滤后将样品液滴在折光仪的检测镜上,合上盖板,读数并记录下来,即为样品液的可溶性固形物含量,用质量分数(%)表示,试验重复3次。
1.2.2.6 可滴定酸含量
采用氢氧化钠溶液滴定法测定。根据NaOH滴定液消耗量计算果实中可滴定酸含量。可滴定酸含量计算公式如下:

式中:V为样品提取液总体积,mL;C为NaOH滴定液浓度,mol/L;V1为滴定滤液消耗NaOH溶液体积,mL;V0为滴定蒸馏水消耗的NaOH溶液体积,mL;D为折算系数,g/mmol;V2为滴定时所取滤液体积,mL;m为样品质量,g。
1.2.2.7 相对电导率
参照王静等[34]的方法测定。采用直径1.5 cm打孔器打取哈密瓜前、中、后3个部位的果肉,将其切成5 mm的薄片,每个部位各取4片,分别置于100 mL烧杯中,加入50 mL蒸馏水,浸泡1 h后换水继续浸泡,重复冲洗3次,保留最后1次冲洗的蒸馏水。采用电导率仪测定蒸煮前后的细胞膜透性,试验重复3次,结果以平均值表示,单位为%。
1.2.2.8 可溶性蛋白含量
采用考马斯亮蓝染色法[32]测定。分别取哈密瓜的果皮组织和果肉组织各取2.0 g,加入5.0 mL蒸馏水研磨成匀浆后,于4℃、12 000 r/min离心20 min,收集上清液;用移液管移取1.0 mL上清液,放置试管中加入5.0 mL考马斯亮蓝G-250溶液,充分混匀后放置2 min,使用紫外-可见分光光度计在595 nm波长处比色,试验重复3次。
1.2.2.9 可溶性糖含量
参照曹建康等[32]的苯酚-硫酸法测定。分别取哈密瓜的果肉组织和果皮组织各1.0 g,加入少量蒸馏水研磨成匀浆后转入刻度试管中,定容到10.0 mL;用塑料膜封口后于沸水中煮沸30 min,取出冷却后过滤至100 mL容量瓶中,再将残渣回收继续加蒸馏水煮沸,并过滤至100 mL容量瓶中,反复用蒸馏水漂洗过滤后并定容;吸取0.5 mL样品液于25 mL刻度试管中,加入1.5 mL蒸馏水后按顺序加入0.09 g/mL苯酚溶液、浓硫酸,显色并测定吸光度值,重复3次。可溶性糖含量计算公式如下:
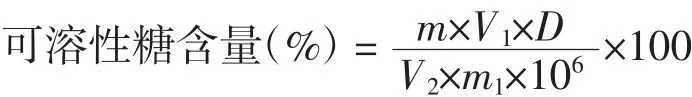
式中:m为从标准曲线查得的蔗糖质量,μg;V1为样品提取液总体积,mL;D为样品提取液稀释倍数;V2为测定时所需样品提取液体积,mL;m1为样品质量,g。
1.2.3 数据处理
采用WPS Office 2020软件进行数据统计,Origin 2019进行制图,并使用SPSS 17进行显著性分析。
2 结果与分析
2.1 臭氧处理对哈密瓜腐烂症状和腐烂指数的影响
如图1A所示,常温贮藏第9天,对照组果实腐烂症状明显,较臭氧处理组严重。对照组果实的表皮出现明显皱缩现象,并有病斑形成;而臭氧处理组的腐烂情况不明显,只有瓜皮表面发黄现象,与腐烂指数相吻合(图2)。贮藏至18 d时,对照组果实的皱缩和腐烂情况较严重,果实凹陷斑面积增大,贴地生长的一面尤其严重,臭氧处理组的果实表皮发软、发黄,皱缩较为明显,但腐烂情况较轻,几乎没有病斑的形成(图1B),腐烂指数变化也显著高于臭氧处理组(P<0.05)(图2)。由此可以看出,臭氧处理可以有效地抑制病原菌生长,延缓哈密瓜果实的腐烂。

图1 哈密瓜常温贮藏9 d(A)和18 d(B)的腐烂症状图Fig.1 Symptoms of decay of Hami melon during room storage for 9 days(A)and 18 days(B)
如图2所示,对照组果实从第6天开始出现腐烂,而臭氧处理组在第9天时出现腐烂,且随着贮藏时间的延长,两组果实的腐烂指数均逐渐上升,但臭氧处理组显著低于对照组(P<0.05),表明臭氧处理可显著降低果实的腐烂。

图2 臭氧处理对哈密瓜腐烂指数的影响Fig.2 Effect of O3 treatment on decay index of Hami melon
2.2 臭氧处理对哈密瓜呼吸强度的影响
果实组织代谢和衰老进程的快慢可以用呼吸强度来衡量,因此,呼吸强度是采后生理研究和贮藏实践中重要的生理指标之一[35]。如图3所示,随着贮藏时间的延长,呼吸强度呈现动态变化;对照组在贮藏第9天出现小高峰,达到4.48 mg/kg-1·h-1;贮藏9~15 d时,对照组与臭氧处理组间呼吸强度存在显著差异(P<0.05);贮藏末期(15~18 d),两组同时快速下降,但臭氧处理组的下降速率更快;贮藏结束时,臭氧处理组的呼吸强度较对照组低31.5%,对照组的呼吸强度极显著高于臭氧处理组(P<0.01),说明臭氧处理可降低哈密瓜果实的呼吸强度。
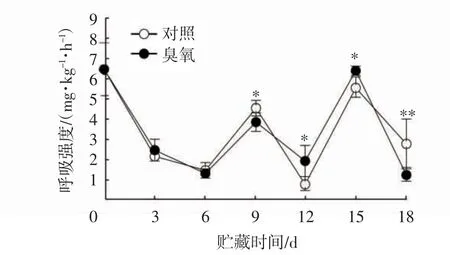
图3 臭氧处理对哈密瓜呼吸强度的影响Fig.3 Effect of O3 treatment on respiratory intensity of Hami melon
2.3 臭氧处理对哈密瓜硬度的影响
果实硬度是衡量哈密瓜果实贮藏品质的重要指标[36]。如图4所示,随着贮藏时间的延长,两组哈密瓜果实硬度在贮藏中期(6~9 d)、贮藏中后期(12~18 d)均呈快速下降的趋势。在贮藏初始,哈密瓜果实的硬度为5.82 kg/cm2;贮藏结束时,对照组和臭氧处理组果实的硬度分别为2.12 kg/cm2和2.83 kg/cm2,较贮藏初值分别下降了46.7%和39.9%,臭氧处理组的果实硬度极显著高于对照组(P<0.01),表明臭氧处理可以延缓哈密瓜果实硬度的下降。
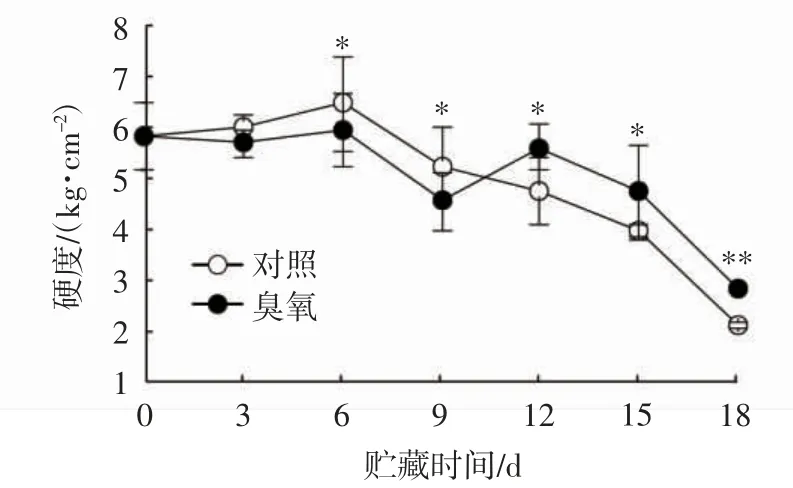
图4 臭氧处理对哈密瓜硬度的影响Fig.4 Effect of O3 treatment on hardness of Hami melon
2.4 臭氧处理对哈密瓜抗坏血酸含量的影响
如图5所示,在整个贮藏过程中,两组果实的抗坏血酸含量差别不大,除第6天、第9天和第15天的对照组高于臭氧处理组之外,其余时间点臭氧处理组均高于对照组,且贮藏中期(9~12 d)两组果实抗坏血酸含量存在显著差异(P<0.05);两组果实的抗坏血酸含量均呈急速下降趋势,以贮藏15~18 d表现更加突出,贮藏结束时,对照组和臭氧处理组哈密瓜的抗坏血酸含量分别较贮藏初值降低了77.8%和68.7%,对照组哈密瓜抗坏血酸含量显著低于臭氧处理组(P<0.05)。说明臭氧处理组对抑制哈密瓜果实抗坏血酸含量的下降作用在贮藏结束(18 d)表现更加显著。

图5 臭氧处理对哈密瓜抗坏血酸含量的影响Fig.5 Effect of O3 treatment on ascorbic acid content of Hami melon
2.5 臭氧处理对哈密瓜可溶性固形物含量的影响
可溶性固形物含量是衡量哈密瓜果实品质好坏及贮藏品质的重要指标之一[37]。如图6所示,贮藏0~6 d时,两组果实的可溶性固形物含量缓慢上升,贮藏第3天对照组极显著高于臭氧处理组(P<0.01)。贮藏9~15 d时,对照组低于臭氧处理组;贮藏第15天时,臭氧处理组可溶性固形物含量极显著高于对照组(P<0.01)。表明臭氧处理在贮藏中后期(9~15 d)能有效保持哈密瓜果实的可溶性固形物含量。

图6 臭氧处理对哈密瓜可溶性固形物含量的影响Fig.6 Effect of O3 treatment on soluble solids content of Hami melon
2.6 臭氧处理对哈密瓜可滴定酸含量的影响
如图7所示,随着贮藏时间的延长,两组哈密瓜的可滴定酸含量在贮藏0~3 d呈直线上升趋势,前中期(3~9 d)呈直线下降趋势,臭氧处理组高于对照组;在贮藏12 d时,对照组和臭氧处理组均出现高峰值,之后呈急剧下降趋势,且存在显著差异(P<0.05);贮藏12~15 d,对照组果实的可滴定酸含量高于臭氧处理组。贮藏第6天和第9天时,臭氧处理的哈密瓜可滴定酸含量均显著高于对照组(P<0.05)。表明臭氧处理在贮藏前期(0~9 d)能有效延缓哈密瓜果实可滴定酸含量的降低。
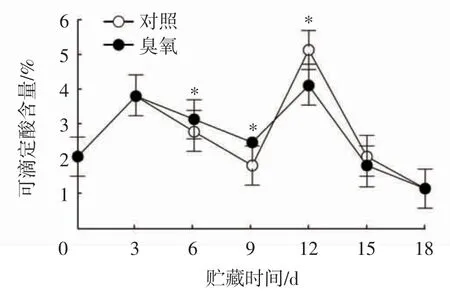
图7 臭氧处理对哈密瓜可滴定酸含量的影响Fig.7 Effect of O3 treatment on titratable acid content of Hami melon
2.7 臭氧处理对哈密瓜相对电导率的影响
如图8所示,贮藏前期(3~6 d)两组哈密瓜果实的相对电导率呈上升趋势,在贮藏中期(6~9 d)两组哈密瓜果实的相对电导率呈下降趋势,且存在显著差异(P<0.05),在0~9 d对照组果实的相对电导率高于臭氧处理组;在12~18 d臭氧处理组高于对照,在第9天时两组果实相对电导率均下降,且臭氧处理组果实的相对电导率显著低于对照组(P<0.05),表明臭氧处理在贮藏前期(0~9 d)可显著降低果实相对电导率上升,而后期使细胞膜结构的破坏加速。

图8 臭氧处理对哈密瓜相对电导率的影响Fig.8 Effect of O3 treatment on relative conductivity of Hami melon
2.8 臭氧处理对哈密瓜可溶性蛋白含量的影响
如图9所示,臭氧处理组和对照组哈密瓜可溶性蛋白含量均呈先下降后上升的趋势。贮藏第6天时,臭氧处理组与对照组的可溶性蛋白含量接近;贮藏中期(9~12 d)两组可溶性蛋白含量均小幅度下降,且存在显著差异(P<0.05);贮藏第9天时,臭氧处理组可溶性蛋白含量较对照组高17%,二者间呈显著差异(P<0.05)。表明臭氧处理在贮藏中期(6~12 d)可显著提高果实的可溶性蛋白含量。

图9 臭氧处理对哈密瓜可溶性蛋白含量的影响Fig.9 Effect of O3 treatment on soluble protein content of Hami melon
2.9 臭氧处理对哈密瓜可溶性糖含量的影响
如图10所示,在贮藏前中期(0~12 d),两组哈密瓜果实的可溶性糖含量呈缓慢上升的趋势,且在9~12 d臭氧处理组的可溶性糖含量显著高于对照组(P<0.05),表明臭氧处理发挥作用主要在贮藏的0~12 d。贮藏12~18 d,两组哈密瓜果实的可溶性糖含量呈下降趋势,且在15~18 d对照组高于臭氧处理组。表明臭氧处理在贮藏前中期(0~12 d)可延缓哈密瓜可溶性糖含量的下降。

图10 臭氧处理对哈密瓜可溶性糖含量的影响Fig.10 Effect of O3 treatment on soluble sugar content of Hami melon
3 讨论
腐烂是果蔬在贮藏过程中最直观的感官指标之一[38]。随着贮藏期的延长,两组哈密瓜果实的腐烂情况随之加重,贮藏结束时,对照组哈密瓜的腐烂指数显著高于臭氧处理组(P<0.05),表明臭氧处理可降低哈密瓜的腐烂指数,对抑制果实腐烂的发生具有一定作用,这与白友强[29]的研究结果不同,可能是因为贮藏后期果实硬度不断降低,果皮细胞间通透性增大,使病原菌更加容易地扩散到果肉组织中,致使腐烂加快。
呼吸强度是采后果蔬新陈代谢的重要指标,是预测果蔬寿命的依据之一[28]。本试验结果表明:常温贮藏9~15 d,两组哈密瓜果实的呼吸强度之间存在显著差异(P<0.05);贮藏结束时,臭氧处理组的呼吸强度较对照组低31.5%,二者间达极显著差异(P<0.01),表明臭氧处理能显著抑制哈密瓜呼吸作用。这与刘晋联等[39]和王丽[30]的研究结果相似,与白友强[29]的研究结果不同,是因为贮藏后期臭氧分解为氧气,使甜瓜环境氧分压增大,加之甜瓜自身生理代谢旺盛,产生大量的乙烯、乙醛等有害气体,从而加快了呼吸代谢。
果实硬度、可滴定酸、可溶性固形物等可以作为判定果实成熟的重要指标[25],其中抗坏血酸、可溶性固形物、可滴定酸是果蔬的重要营养成分指标,一般在保鲜过程中呈下降趋势[40]。本验结果表明:臭氧在不同贮藏阶段可有效延缓哈密瓜果实的硬度、可溶性固形物含量、抗坏血酸、可滴定酸等品质指标的下降。与张琦等[41]和周慧娟等[42]在树莓果实和宫川柑橘的结果相同,可溶性固形物含量的结果与王丽[30]的结果不同,这可能与哈密瓜品种不同以及臭氧浓度、贮藏温度不同有关。
果蔬中的可溶性糖主要是指可溶于水的葡萄糖和寡聚糖,与果蔬的成熟度、品质、贮藏性有着密切的关系,也是果蔬甜味物质的主要来源[32]。在贮藏0~12 d,臭氧处理组可溶性糖含量始终高于对照组,表明臭氧处理发挥作用主要在常温贮藏的0~12 d。该结论与徐维微[43]得出的4 mg/L臭氧处理能有效提高可溶性糖含量,保持果实营养成分的结果一致。
果实组织的相对电导率反映了组织细胞膜的完整性和衰老程度[44]。对照组果实的相对电导率在贮藏0~9 d高于臭氧处理组;贮藏第9天,臭氧处理组的相对电导率显著低于对照组(P<0.05),而后期臭氧处理加速破坏细胞膜结构。其中贮藏后期果蔬电导率上升的原因可能是由于臭氧能够迅速透过微生物的细胞壁和细胞膜,使细胞膜上的巯基等基团受到攻击,从而使细胞膜受到损伤,导致细胞膜的通透性增加,细胞内物质外泄[16]。可溶性蛋白是果实中重要的渗透调节物质和营养物质,用于保护果蔬细胞的生命物质及生物膜,起到保水作用[38]。结果表明,臭氧处理在贮藏中期(6~12 d)可显著提高果实的可溶性蛋白含量,与王秋芳等[20]得出的臭氧处理巨峰葡萄可抑制可溶性蛋白含量的降低,延缓葡萄在贮藏过程中的新陈代谢的结果一致。
4 结论
上述试验结果表明:臭氧处理可降低甜瓜果实腐烂指数,减轻腐烂症状,抑制果实呼吸强度上升,并延缓果实硬度和抗坏血酸含量的下降速度,较好地维持了果实可溶性固形物、可滴定酸、可溶性糖和可溶性蛋白含量,一定程度保持了果实的贮藏品质。

