加味芍甘附子汤调控PI3K/Akt信号通路减缓类风湿关节炎相关间质性肺病进展的研究
康天伦 席雅婧 钱唐亮 朱跃兰 侯秀娟
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的自身免性疫病,全球患病率为0.5~1%[1]。RA患者常容易伴发间质性肺病(interstitial lung disease,ILD),类风湿关节炎相关间质性肺病(rheumatoid arthritis associated with interstitial lung disease,RA-ILD)在RA患者中的发病率从10~50%不等[2-5],且以寻常型间质性肺病更为常见,严重影响RA患者的生命和生活质量。
研究表明,磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase,PI3K/Akt)信号通路参与到了RA病理过程,与关节滑膜增生、滑膜炎、骨破坏有一定相关性[6]。在肺纤维化的过程中,研究发现活化PI3K/Akt信号通路,可激活下游中结缔组织生长因子、血管内皮生长因子等细胞因子的表达参与肺纤维化,且可与核因子κB(nuclear factor kappa-B,NF-κB)等信号通路协同作用促进肺纤维化的形成[7]。前期研究表明加味芍甘附子汤治疗以寒证为主的RA患者,在改善临床症状等方面疗效较好[8],动物实验研究也表明加味芍甘附子汤可改善佐剂关节炎大鼠关节滑膜的破坏[9]。在此基础上,本研究拟观察加味芍甘附子汤对胶原诱导的佐剂关节炎大鼠肺组织的组织病理形态及PI3K、Akt、NF-κB等相关蛋白表达的影响,探讨加味芍甘附子汤治疗RA-ILD的作用机制,为今后RA-ILD的中医治疗提供更多依据。
1 材料与方法
1.1 实验动物
选用清洁级Wistar大鼠48只,雌性,体质量(110±10)g,鼠龄6~8周,动物许可证号:SCXK(京)2012-0001。于北京中医药大学清洁动物房适应性喂养1周后,按照随机数字表法分为空白组8只、造模组40只。
1.2 实验药物
加味芍甘附子汤药物组成:白芍15 g、生甘草10 g、制附片15 g、青风藤15 g、鸡血藤15 g。中药饮片购买于北京中医药大学东方医院中药房,并由制剂室代煎。给药剂量根据大鼠体表面积计算,将药物浓缩成小、中、大剂量,分别为0.443 g/mL、0.885 g/mL和1.770 g/mL。药液于4℃冰箱保存。
雷公藤多苷片,10 mg/片,生产批号:20200901,由湖南千金协力药业提供。用蒸馏水将其配制成浓度为0.625 mg/mL的药物混悬液。
1.3 主要试剂与仪器
牛Ⅱ型胶原(Chondrex公司,货号2002),不完全弗氏佐剂(Sigma公司,货号7002),苏木素-伊红(hematoxylin-eosin,HE)染液(武汉皮诺飞公司,货号PN0004),一抗(VEGF)(servicebio公司,货号GB11034),一抗(CD34)(Abcam公司,货号Ab81289),一抗(KI67)(arigo公司,货号ARG53222),荧光二抗(cy3标记HRP山羊抗兔)(Jackson公司,货号111-165-003)。
动物气候箱(重庆永生公司,货号SHH-500ZSD),病理切片机(上海徕卡公司,货号RM2016),组织摊片机(浙江科迪公司,货号KD-P),烤箱(上海慧泰公司,货号DHG-9140A),脱色摇床(北京六一公司,货号WD-9405A),组化笔(Gene tech公司,货号GT1001)。
1.4 造模、给药及取材
1.4.1 模型制备 根据徐淑云《药理学实验方法》的制备方法,以及课题组既往造模经验复制关节炎大鼠模型,将溶于乙酸的牛Ⅱ型胶原与等量不完全弗氏佐剂(IFA)混合,制备成浓度为2 mg/mL的混合物。将上述混合物置于15 mL离心管并垂直置于冰水中,离心管置于高速分散器下,以(1 000~3 000 r/min)搅拌2分钟,暂停30秒冷却,避免高速分散器转头搅拌过程中产热导致蛋白变性,并反复数次使蛋白充分乳化,最终形成滴入水中而不散的“油包水”状。随后在大鼠左足和尾根部分别多点皮内注射0.1 mL,同时按压注射部位使其充分吸收。7日后取0.1 mL于大鼠尾根部加强免疫一次。空白组仅在左足皮下注射0.1 mL的0.9%的生理盐水。在接受上述免疫的第一天开始,参考刘建勋主编《病证结合动物模型拟临床研究思路与方法》[10-11],应用动物气候箱制备寒证模型,条件设定为风速6 mL/s,温度6℃,相对湿度95%。连续给予28天风寒湿刺激,造模时间持续4周。
1.4.2 动物分组及干预 将造模组随机分为5组,每组8只,分别为模型组、中药大、中、小剂量组及雷公藤组。空白组与模型组蒸馏水灌胃,其余4组分别给予相对应的药物进行灌胃。按照成人每日服药量的6.25倍来计算大鼠每日灌胃用量,计算后得出大鼠用量为:中药大剂量组17.70 g/(kg·d),中药中剂量组8.85 g/(kg·d),中药小剂量组4.43 g/(kg·d),雷公藤组6.25 mg/(kg·d)。按每只大鼠100 g/mL的灌胃量进行灌胃。同时将每日的给药剂量分两次给药,两次之间间隔6小时以上,连续灌胃4周。
1.5 检测方法和指标
1.5.1 HE染色法观察大鼠肺组织病理变化 灌胃4周后,将大鼠处死,沿大鼠腹部正中线剪开,充分暴露胸腔,钝性分离出肺组织及支气管,冲洗、滤干后将肺组织浸泡在4%的多聚甲醛中固定,进行包埋、切片、脱蜡、染色、脱水、封片、显微镜观察肺组织形态结构变化。用Szapiel评分[12]标准进行肺泡炎评分。
1.5.2 免疫荧光法检测肺组织PI3K、Akt、NF-κB的变化 将固定好的石蜡标本切片脱蜡,依次将石蜡切片放入二甲苯Ⅰ/Ⅱ各15分钟;无水乙醇Ⅰ/Ⅱ各15分钟;85%和75%酒精各5分钟;最终蒸馏水冲洗。将切片置于pH为6.0缓冲液中,并置于微波炉内修复。修复过程防止缓冲液过度蒸发以至干片。切片自然冷却后置于pH为7.4的PBS中洗涤5分钟×3次。滴加适合浓度的一抗,并将切片平放于4℃湿盒内孵育过夜。将切片先置于pH为7.4的PBS中洗涤5分钟,共3次。甩干切片滴加荧光二抗,室温避光孵育1小时。同上述步骤PBS洗涤、甩干后滴加DAPI,室温避光孵育10分钟。PBS洗涤、甩干后用抗荧光淬灭封片剂封片。切片于尼康倒置荧光显微镜下观察并采集图像。
1.6 统计学方法

2 结果
2.1 加味芍甘附子汤对肺组织形态学的影响
HE染色结果显示,空白组大鼠肺组织结构及肺泡壁完整,未见明显炎性细胞浸润;模型组大鼠肺组织结构大面积破坏,肺泡结构塌陷,肺泡间隙充血水肿,肺泡壁增厚,出现大量纤维瘢痕;中药小剂量组肺泡炎仍然较为明显,肺泡结构紊乱,肺泡间隙仍较宽,较模型组有所改善;中药中、大剂量组及雷公藤组肺泡结构较为清晰,伴有轻微炎症反应及少量纤维增生,与模型组相比有较明显的改善。见图1。
肺泡炎评分结果显示,模型组与空白组比较炎症反应有明显差异(P<0.01);中药中、大剂量组与模型组相比,肺泡炎症和纤维化有显著下降,差异有统计学意义(P<0.01);雷公藤组与模型组相比也有明显差异(P<0.01)。见表1。

注:A 空白组;B 模型组;C 中药小剂量组;D 中药中剂量组;E 中药大剂量组;F 雷公藤组。

表1 各组关节炎大鼠肺泡炎程度评分比较分)
2.2 加味芍甘附子汤对肺组织中PI3K、Akt、NF-κB蛋白表达的影响
免疫荧光结果显示,模型组中PI3K、Akt、NF-κB(Cy3标记呈现红色荧光)的表达较空白组均明显增多,且各治疗组PI3K、Akt、NF-κB的表达与模型组相比均不同程度降低。见图2。
荧光光密度值对比显示,模型组吸光度值较空白组明显升高,差异具有统计学意义(P<0.05);各治疗组较模型组吸光度值均有降低,与模型组相比,PI3K、NF-κB在中药大剂量组与雷公藤组中降低更明显(P<0.05),与NF-κB在中药中剂量组中降低更明显(P<0.05)。见表2。
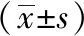
表2 各组关节炎大鼠肺组织PI3K、Akt、NF-κB平均荧光强度比较
3 讨论
研究表明,PI3K/Akt信号通路是由酶联受体介导的参与细胞增殖、迁移、存活和血管生成的经典信号通路[13],与免疫介导的疾病相关[14]。其中,Akt是PI3K的下游底物。活化的PI3K可以催化磷脂酰肌醇磷酸化产生第二信使,并在3-磷酸肌醇依赖性蛋白激酶(3-phosphoinositide-dependent protein kinase,PDK)1和PDK2的帮助下完全激活Akt。Akt完全解离到细胞质和细胞核中,从而磷酸化靶蛋白,如NF-κB,完成对细胞外和细胞外信号刺激的反应,从而调节基因转录和翻译、细胞增殖和凋亡等多种生物学效应和细胞活动[15]。在PI3K/Akt抑制剂渥曼青霉素和LY294002的作用下,RA患者外周血单核细胞产生的白介素-17被部分或完全阻断,可减缓RA滑膜炎症反应[16]。PI3K/Akt途径介导的Blimp1表达上调可以促进RA破骨细胞形成[17],充分说明PI3K/Akt信号通路在RA病理过程起到重要作用。PI3K/Akt信号通路在特发性肺纤维化中同样发挥着重要作用,抑制PI3K通路可阻断转化生长因子-β诱导的α-平滑肌肌动蛋白表达和胶原生成的增加减缓肺纤维化的产生[18]。NF-κB在PI3K/Akt信号通路的下游表达。NF-κB信号通路在RA中起重要作用[19],同时还可以促进成纤维细胞Ⅰ、Ⅲ型胶原的表达,介导肺泡炎和肺纤维化[20]。

注:A 空白组;B 模型组;C 中药小剂量组;D 中药中剂量组;E 中药大剂量组;F 雷公藤组。A1-F1 大鼠肺组织PI3K表达;A2-F2大鼠肺组织Akt表达;A3-F3大鼠肺组织NF-κB表达。
芍甘附子汤出自张仲景《伤寒论》,由芍药、甘草、附子三味药组成。白芍补肝阴,附子温肾阳,一阴一阳相调和,甘草则安中。附子、甘草辛甘化阳以益卫,芍药甘草酸甘益阴、养营补虚,三药相合共奏扶阳益阴之效。在芍甘附子汤基础上加上鸡血藤、青风藤构成加味芍甘附子汤,鸡血藤活血补血,青风藤祛风湿通经络,使其更贴合于临床RA以多关节疼痛为主要临床表现这一特点。临床研究表明,加味芍甘附子汤可缩短寒证RA患者晨僵时间,减少关节疼痛及肿胀个数,降低DAS28评分,改善患者生活质量[8]。动物实验表明加味芍甘附子汤能有效调控JAK/STAT信号转导通路STAT1 mRNA、SOCS1 mRNA、SOCS3 mRNA的表达,降低关节炎大鼠的炎症反应[9]。
本研究发现,模型组大鼠肺组织结构较空白组被大面积破坏,肺泡结构改变,肺泡间隙充血水肿,肺泡壁相对增厚,出现大量纤维瘢痕,说明使用关节炎模型作为观察RA相关间质性肺病的模型相对可靠,这与发表的相关实验结果相一致[21]。各治疗组肺组织形态学表现较模型组有不同程度的改善,表明加味芍甘附子汤对延缓关节炎大鼠肺损伤有一定作用。临床中RA-ILD在影像学上大致可分为普通间质性肺炎、非特异性间质性肺炎、机化性肺炎三种类型[22]。虽然RA-ILD在影像学上常见以纤维化为特征的普通间质性肺炎,仍有一大部分患者表现出非特异性间质性肺炎的特点,以炎症反应引起的双肺磨玻璃影为主[23]。炎症反应阶段是可以被干预从而延缓纤维化进展的。研究发现[24]非特异性间质性肺炎患者经糖皮质激素治疗后,45%患者完全恢复,42%患者改善或稳定。且非特异性间质性肺炎患者的5年生存期为76.2%,远远高于特发性肺纤维化(43.8%)[25]。本实验大鼠肺病理改变治疗组较模型组有一定改善,表明早期肺损伤有延缓其进展的治疗机会。免疫荧光结果显示PI3K、Akt、NF-κB在关节炎寒证大鼠肺组织中均有表达,与模型组相比各指标在治疗组均有降低,且PI3K、NF-κB在中药中、大剂量组与雷公藤组中降低更明显,差异有统计学意义。研究已证明PI3K/Akt信号通路在RA及特发性肺纤维化中的重要作用[26-27],本研究结果进一步丰富了PI3K/Akt信号通路在RA-ILD中的作用,将两种疾病相关联起到了“桥梁”的作用。
综上所述,加味芍甘附子汤通过调节PI3K/Akt信号通路进而干预其下游NF-κB信号通路抑制炎症反应,可能是减少肺泡炎及肺纤维化的重要机制。接下来的研究将进一步探究加味芍甘附子汤在治疗RA-ILD过程中发挥作用的主要成分,以及更进一步的分子机制,为临床中更精确有效的治疗RA-ILD提供依据。

