三沙湾养殖衍生有机物沉降对多毛类优势种营养生态特征的影响
张鹏展,付 婧,周 进
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院东海水产研究所,上海 200090)
三沙湾位于福建省东北部,是我国近海典型的养殖海湾。海湾内养殖活动包括鱼类网箱养殖、海藻吊绳养殖和鲍鱼筏式养殖等类型,大黄鱼(Pseudosciaenacrocea)网箱养殖规模较大。2020年三沙湾大黄鱼养殖产量达17.9万t,占全国大黄鱼养殖总产量70%以上[1-2]。网箱养殖属于投喂型生产方式,养殖过程中产生数量可观的网箱养殖衍生有机物(aquaculture-derived organic matter, AOM),AOM主要包括残饵和粪便[3]。氮、磷含量较高的AOM以溶解态和颗粒态两种形式释放到环境中。溶解态AOM在水动力作用下被稀释和扩散,颗粒态AOM沉降至沉积物中。沉积物中的AOM被底栖生物摄食,影响生态系统物质循环和能量流动[4]。
大型底栖动物是海洋生态系统中重要的生物类群,环节动物门多毛纲动物是海洋大型底栖动物中较为习见的门类[5]。多毛类动物摄食方式较为多样,包括植食性、滤食性、底泥食性、杂食性和肉食性多种类型。AOM沉降至沉积物环境后,可能被底泥食性和杂食性多毛类动物摄食,多毛类动物营养生态特征随之发生改变[6]。针对三沙湾内网箱养殖活动对大型底栖动物的影响已有部分研究[7-10]。已有研究多聚焦底栖动物群落结构,围绕区域内养殖活动对底栖动物营养生态特征的影响至今未见报道。
现阶段,碳、氮稳定同位素(δ13C和δ15N)示踪技术是研究海洋动物营养生态特征的主流方法[11]。选择贝类作为海洋食物链中的基准生物,利用δ15N可计算物种营养级,揭示种群在食物网中所处位置[12]。利用δ13C结合数学模型方法可计算物种的食源结构。近年来,配合δ13C使用的数学模型方法不断升级更新,按时间先后顺序包括简单线性混合模型[13]、多元线性混合模型(IsoSource[14])和贝叶斯混合模型(MixSIR[15]、SIAR[16]和SIMMR[17]等)等。贝叶斯混合模型SIMMR采用迭代计算原理,考虑多重食源信息,现已被广泛应用于大型底栖动物营养生态学研究[18-19]。
本研究以稳定同位素示踪结合数学模型方法研究三沙湾典型水动力条件下AOM沉降对区域底栖生物优势物种营养生态特征的影响,揭示网箱养殖活动的底栖生态环境效应,以期为环境友好型网箱养殖模式构建和三沙湾水产养殖可持续发展策略制定奠定理论基础。
1 材料和方法
1.1 采样站位的布设
选择三沙湾内3种典型水深条件养殖水域作为实验区域,3个实验区域水深分别为16.0 m、30.7 m和22.5 m(图1),在各实验区域主导流向上分别设置1个采样断面,各断面布设5个采样站位,各断面上采样站位分别距离实验网箱中心0 m、400 m、800 m、1 500 m和2 300 m。实验区域周围仅有少量海藻养殖,未受区域以外网箱养殖影响。

图1 三沙湾3种不同水动力特征采样断面示意图
1.2 实验区域养殖概况
实验区域1养殖网箱中心坐标为26°44′ N、119°46′ E,区域内共有普通养殖网箱(长×宽×高:3 m × 3 m × 4 m)100个;区域2养殖网箱中心坐标为26°40′ N、119°47′ E,区域内共有普通养殖网箱100个;区域3养殖网箱中心坐标为26°36′ N、119°51′ E,区域内共有普通养殖网箱120个。实验区域养殖年限均为3年以上,各区域大黄鱼年产量均超100 t。本研究采样时实验区域网箱内养殖个体为2020年或2021年春季苗,养殖个体体质量约为数十克至数百克不等。日常养殖中实验网箱投喂商业颗粒饵料或冰鲜饵料(小杂鱼研磨成的肉糜),投喂频率为每日一次。
1.3 样品的采集
大型底栖动物样品采集于2021年9月24—29日。利用箱式采集器(表面积0.04 m2)采集沉积物样品,沉积物样品使用孔径0.5 mm筛网冲洗样品。同步采集表层(0~1 cm)沉积物样品,带回实验室内在-20 ℃条件下冷冻保存。
研究区域内采集大型底栖动物潜在食源:残饵、粪便、海藻(海带Laminariajaponica和龙须菜Gracilarialemaneiformis)、颗粒有机物(particulate organic matter, POM)、浮游动物和底栖微藻。残饵样品取自各实验网箱。粪便样品采集采用挤压法,在各实验网箱区分别收集20尾以上个体大小不一的大黄鱼,挤压大黄鱼腹部收集粪便样品,样品使用Whatman GF/F玻璃纤维滤膜过滤,滤膜样品在60 ℃条件下烘干后用锡箔纸包裹干燥保存。海带和龙须菜样品在研究区域附近随机采集,实验室内-20 ℃条件下冷冻保存。POM样品采集时,在采样站位0.5 m水深处采集2 L海水,使用孔径125 μm网筛移除水体样品中的大型颗粒和杂质,样品使用500 ℃预烧后的Whatman GF/F玻璃纤维滤膜过滤,滤膜样品在60 ℃条件下烘干后用锡箔纸包裹干燥保存。采用浅水Ⅰ型浮游生物网(孔径0.505 mm)自水体底层至表层垂直拖网获取浮游动物样品,浮游动物样品置于蒸馏水中过夜以排清肠含物,样品使用Whatman GF/F玻璃纤维滤膜上过滤,滤膜样品在60 ℃条件下烘干后用锡箔纸包裹干燥保存。底栖微藻在潮下带含量较低,本研究底栖微藻样品采自实验区域邻近的潮间带,样品采集和保存方法参照已有同类研究[20]。底栖微藻样品仅采自实验区域1和3,区域2底栖微藻δ13C和δ15N取区域1和3的平均数值。
1.4 样品准备、前处理与分析
按照底栖物种的数量优势判定优势种[7],本研究认定实验区域大型底栖动物群落的优势物种为欧努菲虫(Onuphiseremita)、不倒翁虫(Sternaspisscutata)、角海蛹(Ophelinaacuminata)、索沙蚕属一种(Lumbrinerissp.)和丝异须虫(Heteromastusfiliformis),5个优势物种皆为环节动物门多毛纲动物,其中索沙蚕属一种本文均简称为索沙蚕。欧努菲虫在本研究的3个采样断面均有出现,不倒翁虫和角海蛹在采样断面1和2中出现,索沙蚕和丝异须虫仅出现于采样断面1。优势物种样品在60 ℃条件下烘干,样品采集和处理方法参照已有同类研究[8]。采集实验区域内具有数量优势的双壳类样品,样品处理方法同上述多毛类动物。样品烘干后研磨,研磨样品干燥保存待测。用于δ13C分析的样品使用1.2 mol·L-1的盐酸酸化处理,处理后样品使用Whatman径迹蚀刻过滤膜(0.2 μm)过滤,滤膜样品使用蒸馏水润洗3遍后在60 ℃条件下烘干。
测试沉积物粒径时,取适量冷冻样品,样品融化后放置于烧杯中用玻璃棒搅拌均匀,装瓶后在超声清洗机中分散5~10 min使其充分分散。沉积物粒径使用BT-9300S激光粒度分布仪测定。结果显示,研究区域沉积物中值粒径以<3.9 μm和3.9~62.5 μm为主,二者占比为95.2%~100%。根据福克-洛克三角分级和命名法,三沙湾采样区域底质类型为泥质砂,粉砂和泥的占比分别为77%和23%。样品研磨及酸化处理方法同底栖生物样品。
海带和龙须菜样品解冻后用蒸馏水清洗表面附着的杂质,清洗后的样品在60 ℃条件下烘干处理。残饵、粪便和海藻等食源样品研磨及酸化处理方法同底栖生物样品。
样品δ13C和δ15N利用深圳市华科精信检测科技有限公司的DELTA V Advantage 同位素比率质谱仪(isotope ratio mass spectrometer)进行测定。稳定同位素丰度按以下公式计算得出:
X(‰)=[(R样品/R标准)-1]× 103
式中,X为δ13C或δ15N,R样品为样品碳同位素比值(13C/12C)或氮同位素比值(15N/14N),R标准为国际标准物质PDB的碳同位素比值或标准大气氮同位素比值;δ13C分析精度为0.1‰,δ15N分析精度为0.2‰。
1.5 数据处理与分析
1.5.1 显著性检验
使用Lillie和Levene检验方法检验各组数据正态性和方差齐性。本研究中的多组数据不能同时符合正态性和方差齐性要求,因此数据空间差异(采样断面或站位之间)分析使用非参数检验方法。使用Wilcoxon秩和检验判断不倒翁虫、角海蛹和底栖微藻的δ13C和δ15N在两个采样断面之间是否存在显著差异。使用Kruskal-Wallis 检验判断不同食源之间、不同多毛类优势种之间,以及欧努菲虫、沉积物和POM的δ13C和δ15N在不同断面之间是否有显著差异。以上检验均使用R4.1.1软件完成。
1.5.2 优势种营养级的计算
动物组织δ15N富集程度较为稳定,据此计算动物物种的营养级(trophic level, TL)。营养级的计算采用如下公式:
TL优势种=λ+(δ15N优势种-δ15N基线生物)/TEF
式中,TL优势种为待确定物种的营养级;λ为基准生物的营养级,本研究中基准生物的选择参考已有同类研究,即认定双壳类为基准生物,营养级为2[19-20];δ15N优势种为待确定物种δ15N;δ15N基线生物为双壳类δ15N平均值;TEF(trophic enrichment factor)为营养富集因子,本研究沿用已有文献中的结论TEF=3.4‰[21]。
1.5.3 优势种食物贡献率的计算
采用基于贝叶斯统计原理的SIMMR模型计算底栖物种的食源结构[17]。本研究采集残饵、粪便、海带、龙须菜、POM、浮游动物和底栖微藻等底栖动物潜在食源样品,三沙湾内浮游动物和龙须菜δ13C和δ15N与底栖优势物种接近(图2),海带δ13C[(-14.61±2.01)‰]大于底栖优势物种,浮游动物、龙须菜和海带应非三沙湾内底栖优势物种食源。SIMMR模型计算时的潜在食源包括残饵、粪便、POM和底栖微藻。模型中营养判别因子Δδ15N设定为(3.4±0.1)‰,Δδ13C设定为(1.0±0.1)‰[20]。SIMMR模型计算使用R4.1.1软件的SIMMR程序包完成。
2 结果与分析
2.1 潜在食源碳、氮稳定同位素特征
残饵、粪便、底栖微藻和POM等底栖物种食源δ13C和δ15N变化较大,变化范围分别为-25.51‰~-12.71‰和3.30‰~12.91‰,不同食源之间δ13C和δ15N存在显著差异(Kruskal-Wallis检验,P<0.001)。海带δ13C最高(各研究区域平均值),POM δ13C最低。龙须菜、残饵和浮游动物δ15N较高,底栖微藻δ15N最低(图2)。
特定食源δ13C和δ15N在不同研究区域之间存在差异,沉积物δ13C和δ15N、颗粒有机物和底栖微藻δ15N在区域之间存在显著差异(Kruskal-Wallis检验,P<0.05)。
2.2 多毛类优势种稳定同位素特征
多毛类优势种δ13C和δ15N变化范围分别为-21.82‰~-16.87‰和7.05‰~12.98‰(表1,图2),不同优势物种δ15N之间存在显著差异(Kruskal-Wallis检验,P<0.001)。角海蛹δ13C最高(各研究区域平均值),索沙蚕和欧努菲虫δ15N最高,不倒翁虫δ13C和δ15N均为最低。欧努菲虫δ13C和δ15N在研究区域之间存在显著差异(Kruskal-Wallis检验,P<0.01)。

图2 三沙湾多毛类优势种及其潜在食源碳、氮稳定同位素特征
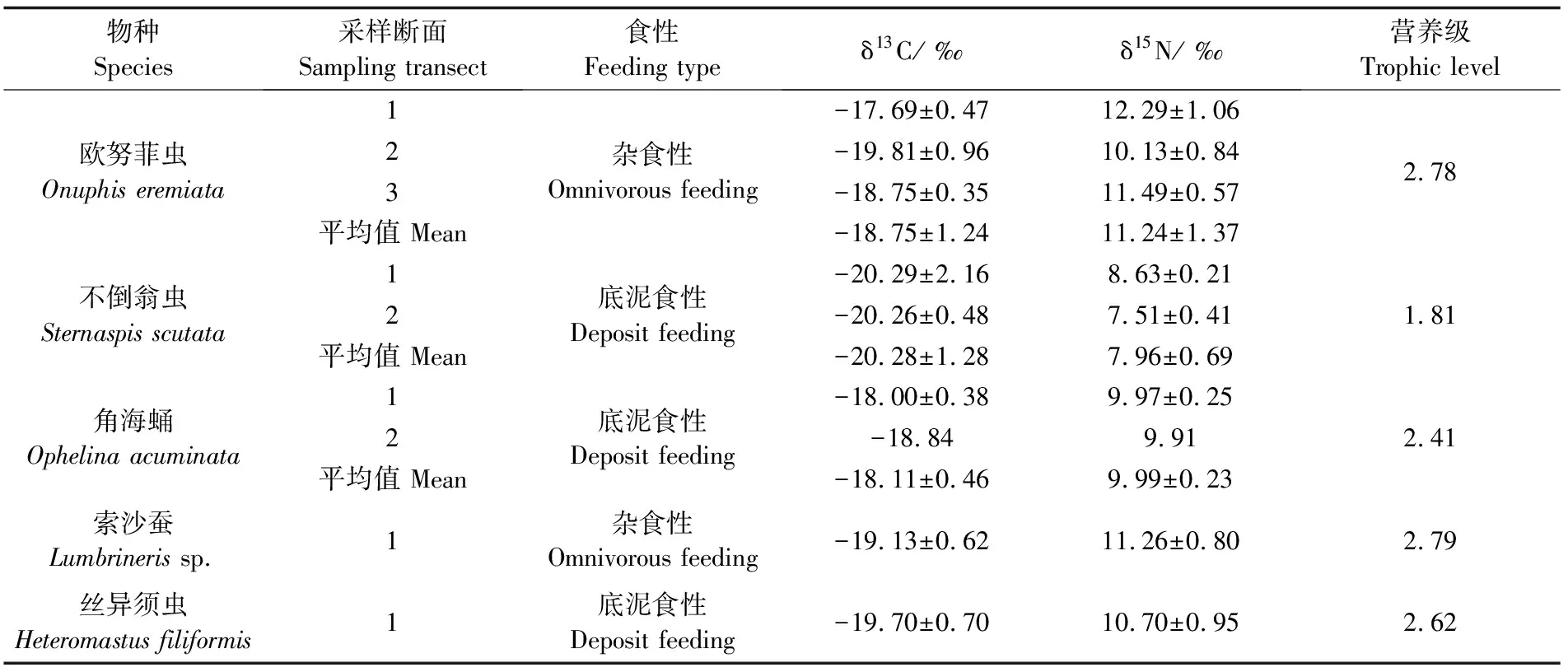
表1 三沙湾多毛类优势种δ13C和δ15N组成
2.3 多毛类优势种营养级
三沙湾双壳类样品δ13C平均值为(-19.14±0.15)‰,δ15N平均值为(8.59±1.07)‰。5种多毛类优势种营养级如表1所示。杂食性索沙蚕和欧努菲虫营养级最高,两种营养级分别为2.79和2.78;底泥食性丝异须虫和角海蛹次之,营养级分别为2.62和2.41;不倒翁虫营养级最低为1.81。
2.4 多毛类优势种食源贡献率
SIMMR模型计算结果显示,AOM对欧努菲虫、角海蛹、索沙蚕、丝异须虫和不倒翁虫的食物贡献率分别为(68.4±17.2)%、(61.7±22.0)%、(54.9±13.4)%、(36.4±8.3)%和(18.3±13.2)%(图3)。其中粪便在AOM中的比例大于残饵。底栖微藻是三沙湾底栖动物的重要食物来源,对以上5种底栖优势物种的食源贡献率分别为(22.5±15.6)%、(33.0±18.7)%、(30.7±15.0)%、(47.6±22.6)%和(76.6±14.1)%。POM对底栖优势物种的食源贡献率小于10%。

图3 潜在食源对多毛类优势种欧努菲虫(a)、角海蛹(b)和索沙蚕(c)的食物贡献率
3 讨论
3.1 三沙湾内多毛类优势种的营养级
海洋多毛类动物物种多样性较高,摄食类型多样,δ15N水平变化范围较大。三沙湾多毛类动物δ15N水平处于已有相关报道数据中的中等水平,与我国近岸海域内已有的报道结果大致相当,与国外报道结论存在一定差异。至今,我国渤海[22](小清河口及其邻近海域,平均值为11.17‰)、黄海[23](平均值为10.59‰)、东海[24](北部海域,平均值为10.88‰)海域多毛类动物δ15N水平已有报道,报道数据与三沙湾多毛类δ15N平均值较为接近[(10.54±1.48)‰]。国外针对多毛类动物δ15N水平报道数据变化较大,如地中海西北部海域 Gulf of Lions多毛类δ15N平均值仅为7.16‰[25],日本Ariake海湾沿岸潮间带区域多毛类δ15N平均值可达13.57‰[26]。
本研究结果显示,三沙湾内数量优势多毛类动物营养级变化范围为1.8~2.8,显示多毛类动物在三沙湾海洋生态系统中属于较低层级的异养生物。在海洋生态系统中,双壳类生物滤食水体中的颗粒有机物通常被作为计算消费者营养级的基准生物,营养级被认定为2.0[19-20]。腹足类和甲壳类海洋生物营养级通常高于双壳类生物,鱼类在食物网中营养级相对较高(通常大于3.0)[19-20]。三沙湾内数量优势多毛类动物营养级与双壳类生物大致相当,此营养特征与多毛类动物摄食习性相关。丝异须虫、角海蛹和不倒翁虫为底泥食性,摄取利用沉积物中的有机颗粒物,欧努菲虫和索沙蚕为杂食性,兼食沉积物中的有机颗粒物[27]。三沙湾内优势多毛类动物在生态系统中属于较低层级,应是高营养层级动物的潜在食源。
3.2 三沙湾多毛类优势种的食源结构
在三沙湾内,AOM(包括残饵和粪便)、海带、龙须菜、颗粒有机物、浮游动物和底栖微藻为大型底栖动物潜在食源。三沙湾内底栖动物潜在食源δ13C、δ15N水平与已有研究大致相当。温带区域咸淡水交汇水域颗粒有机物的δ13C通常介于海洋和陆源物质之间,变化范围为-26‰~-20‰,三沙湾内颗粒有机物δ13C平均值为-24.04‰。底栖微藻δ13C变化范围可达-24‰~-14‰[28],三沙湾内δ13C平均值为-22.63‰。三沙湾海带高δ13C特征与东海其他区域基本一致[29]。
不同潜在食源之间δ13C和δ15N有显著差异,说明同位素图能够有效刻画底栖物种和潜在食源之间的关系。使用经典分馏系数(平均δ15和δ13C分别为3.4‰和1.0‰[21])方法可以定性判断底栖物种食源。三沙湾内浮游动物和龙须菜的δ13C和δ15N水平与底栖优势物种接近(相差<1‰),海带和底栖优势物种δ13C差值(4‰以上)远大于δ13C分馏系数(1‰),浮游动物、龙须菜和海带应不是三沙湾内底栖优势物种食源。δ13C结合模型方法计算结果显示,AOM对欧努菲虫、角海蛹、索沙蚕、丝异须虫和不倒翁虫的食物贡献率维持在较高比例,分别为68.4%、61.7%、54.9%、36.4%和18.3%。底栖微藻也是三沙湾内多毛类动物的重要食源,对以上5种多毛类的食物贡献率分别为22.5%、33.0%、30.7%、47.6%和76.6%。
①数据来源于本实验室未发表数据。
3.3 网箱养殖对多毛类优势种营养特征的影响
三沙湾内数量优势多毛类动物的营养级分布格局体现了区域内养殖活动的影响作用。在未受扰动的自然水域内,底泥食性多毛类动物利用沉积物中植物性食源,杂食性多毛类动物兼食植物和动物性食源,经典营养级理论认为杂食者营养级较高,底泥食者营养级较低[25-26, 30]。三沙湾内多毛类动物营养级总体上遵从此分布格局,然而部分不同食性多毛类营养级之间差异较小。例如,杂食性索沙蚕和欧努菲虫营养级分别为2.79和2.78,底泥食性丝异须虫和角海蛹营养级分别为2.62和2.41。此现象应与AOM作为不同摄食类型多毛类物种的共同食物有关,较为均质性的食源降低了不同食性多毛类营养级之间的差异性。
三沙湾内AOM对多毛类优势种食源的较高贡献率体现了海湾的养殖水域属性。自然水域内,底栖微藻对底栖动物食源通常具有较高贡献,如KANAYA等[31]指出,在日本河口底栖硅藻对两种多毛类的食物贡献率分别为50%和32%;JI等[20]研究了海州湾底栖微藻、POM和陆源有机物对中国明对虾(Penaeuschinensis)食物的贡献,结果表明底栖微藻在中国明对虾的食物来源中占据绝对优势,食物贡献率可达90%。而在养殖水域,底栖物种更偏好摄食AOM,此结论也被多篇文献证实,如ROUSSEL等[32]指出,在法国典型鲑鱼养殖区无脊椎动物对AOM的摄食比例可达72%~88%;GAO等[33]指出,在香港西部滘西湾复合鱼类养殖区AOM对贻贝(Pernaviriolis)食物占比甚至可达95%。
养殖水域内AOM沉降对多毛类优势种营养生态特征的影响较为复杂。相同食性的不同物种对于AOM沉降的响应存在差异,如本研究中同为杂食性的欧努菲虫和索沙蚕对AOM的偏好程度不同,欧努菲虫高于索沙蚕。欧努菲虫隶属于欧努菲虫科,索沙蚕隶属于索沙蚕科,个体摄食器官不同可能影响两类群对AOM的摄食和利用效率,欧努菲虫个体较大,上下颚强壮,咽部肌肉发达,具有较高的摄食灵活性[27, 34-35]。本研究涉及的3种底泥食性多毛类营养级存在差异,例如不倒翁虫营养级为1.8,低于丝异须虫和角海蛹。底泥食性多毛类动物的摄食方式较为被动,选择性不强,同区域内底泥食性多毛类动物营养级存异说明底栖生物对AOM的同化效率具有种间差异性。日本沿岸的研究结果表明,网箱养殖区杂食性多毛类营养级较高,底泥食性多毛类营养级相对较低[6]。北大西洋沿岸水域研究指出,与未摄食AOM的多毛类相比,摄食AOM的同种多毛类营养级呈现下降趋势[36]。三沙湾与国外类似研究结论的差异性应与AOM同化效率的种间差异性相关。欧努菲虫δ13C和δ15N水平在不同水深采样区域之间呈现显著差异,表明底栖物种营养级除受形态学特征、摄食习性和食源结构影响外,不同水动力条件(水深差异、海流流速差异等)也会影响多毛类营养级结构。
3.4 基于底栖物种营养生态特征的养殖环境效应分析
基于大型底栖动物角度阐释水产养殖活动影响已有较多研究案例。已有研究多利用底栖生物群落结构(物种组成、丰度、生物量、多样性等)、群落结构参数和环境因子的关系(相关性分析、聚类分析、相似性分析、NMDS分析等)等方法揭示养殖的底栖生态环境效应[37-39]。大型底栖动物群落结构变化机制较为复杂,养殖活动并不一定导致群落结构变化,群落结构变化为养殖活动和其他外源影响共同作用的结果。在三沙湾内,已有研究表明大型底栖动物群落结构参数并不能很好地反映网箱养殖的环境影响,三沙湾网箱养殖活动并未改变区域大型底栖动物群落结构[7-10]。AOM沉降是水产养殖活动环境效应的“源”,沉降的AOM是底栖动物潜在的食源,基于营养生态学角度研究水产养殖活动的环境效应应为比较奏效的技术方法[6, 33, 36]。
高强度网箱养殖引发AOM在养殖水域沉积物中累积[3]。根据本课题组研究数据,三沙湾网箱养殖区及其邻近水域沉积物碳源中AOM比例约为20%①。本文研究结果表明,三沙湾网箱养殖产生的AOM已是区域底栖物种的重要食源,养殖活动产生了较为明显的生态环境效应。AOM沉降对大型底栖动物营养生态特征的影响机制较为复杂,生物个体生物学特征和生态学习性以及区域自然地理条件共同制约物种营养生态过程。
致谢:感谢实验网箱区养殖户对养殖相关信息的提供和样品采集的帮助。感谢上海海洋大学硕士研究生姚楠和陈朗对本研究样品采集、底栖动物粗分和前处理的帮助。

