内质网应激与PI3K/Akt和ERK1/2通路在大鼠宫腔粘连治疗中的作用
夏维婷 徐欣欣 周志阳 郑如如 林 凤 边晓丽
宫腔粘连(intrauterine adhesion, IUA)是指由于感染或者损伤等因素引起的子宫内膜的基底层破坏,继而导致宫腔内形成粘连或者纤维瘢痕。大量研究证明,雌激素可以在哺乳动物的月经期后促进子宫内膜和新生毛细血管的再生[1]。临床上雌激素治疗通常作为宫腔镜下子宫内膜粘连分离术后的重要辅助治疗手段,可以促进受损子宫内膜的再生,防止宫腔粘连的复发[2]。磷脂酰肌醇-3激酶/蛋白激酶(phosphatidylinositol-3 kinase/Akt, PI3K/Akt)和ERK1/2信号通路是由雌二醇(estradiol, E2)激活的两个主要的下游信号通路。研究结果证实,这两个信号通路与细胞的存活、迁移、分化、凋亡存在密切联系。内质网是细胞内合成蛋白质并进行折叠的场所,许多事件如细胞暴露于氧自由基,内质网中储存的钙离子耗竭,都可能导致蛋白质错误折叠,触发内质网应激(endoplasmic reticulum stress,ERS)[3,4]。近年来研究发现,内质网应激诱导的细胞凋亡在许多疾病发生、发展过程中起重要作用[5]。本研究通过动物实验证实17β-雌二醇对宫腔粘连大鼠子宫内膜的修复作用,并进一步研究PI3K/Akt和ERK1/2信号通路及内质网应激相关蛋白GRP78和CHOP的表达变化,从而探讨它们在宫腔粘连治疗中的可能作用。
材料与方法
1.实验动物:SPF级SD雌鼠18只(上海斯莱克实验动物有限责任公司),体质量为230~250g,动物饲养于温州医科大学动物实验中心,实验动物使用许可证号: SYXK(浙)2015-0009。相关饲养条件:4只SD大鼠同笼饲养,SPF级屏障12h光照/12h黑暗周期变化,室温保持在22±2℃,湿度维持在35%~60%,保证大鼠能够自由进食及饮水。
2.药品和试剂:(1)主要试剂:4%多聚甲醛购自重庆市北碚化学试剂厂,苏木精-伊红染色试剂盒购自北京中杉金桥生物技术有限公司,Masson染色试剂盒购自北京中杉金桥生物技术有限公司,CD31、GRP78、CHOP、Akt1、p-Akt、ERK、p-ERK多克隆抗体购自英国Abcam公司。(2)17β-雌二醇油溶液的配置:17β-雌二醇购自美国Alfa Aesa公司,使用定量的无水乙醇将17β-雌二醇充分溶解后,加入无菌花生油配制成10μg/100μg的17β-雌二醇油溶液备用。
3.实验仪器:自动酶标分析仪购自美国Bio-Rad公司,多功能显微镜购自日本Olympus公司,电泳设备购自美国Bio-Rad公司,电动玻璃匀浆机购自宁波新芝生物科技股份有限公司,病理组织包埋机购自常州中威电子仪器有限公司,BP211D型电子天平购自德国Sartorius公司。
4.IUA动物模型构建及分组:大鼠适应性饲养1周后随机分为对照组、模型组及治疗组,每组各6只。通过机械损伤法构建大鼠宫腔粘连模型,具体方法如下:每日早上8:00时对大鼠行阴道涂片观察,处于动情间期的雌鼠用于宫腔粘连模型的构建[6,7]。腹腔注射戊巴比妥钠进行麻醉后,大鼠仰卧位固定,腹部剃毛备皮,用碘伏消毒皮肤,在腹部正中线做长约2cm的切口。逐层切开皮肤和肌肉,暴露腹腔,在大鼠膀胱后方寻找子宫。暴露子宫后,在Y形子宫分叉处上方做一0.5cm的切口,利用刮勺刮除子宫内膜至宫腔表面有粗糙感,造成子宫内膜损伤。然后缝合子宫切口,并用无菌纱布仔细止血后,缝合肌层与皮肤。术后给予肌内注射抗生素预防感染。模型组仅建立机械性损伤模型,对照组不做任何干预,治疗组造模后当天开始每日皮下注射浓度为10μg/100μg的17β-雌二醇油溶液100μg,连续7天。
5.组织病理学检测:固定好的子宫组织进行脱水,石蜡包埋,制备成5μm切片,分别进行HE染色观察子宫内膜形态、Masson染色观察子宫内膜的纤维化程度、CD31免疫组化染色观察子宫内膜新生血管的生成情况。
6.Western blot法检测子宫内GRP78、CHOP、Akt、p-Akt、ERK、p-ERK蛋白:提取组织,采用BCA法进行定量,SDS-PAGE电泳,移膜、封闭后,加入目标一抗稀释液4℃孵育过夜,TBST洗膜3次,加入相应的二抗稀释液室温孵育2h,滴加ECL发光、显影,采集条带吸光度值及面积用于统计分析。以GAPDH条带作为内参照,计算蛋白表达的相对水平。
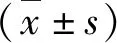
结 果
1.大鼠子宫大体及病理形态学变化:对照组大鼠子宫表面呈淡粉色,有良好伸展性;模型组大鼠弹性减退,变细、僵直、甚至发生积液。治疗组较模型组子宫粗细均匀,弹性尚可,形态近似对照组(图1)。HE染色结果显示,在模型组,子宫内膜表面仅覆盖一层低柱状上皮,腺体数量显著下降,甚至只观察到个别腺体分布在子宫的黏膜下层和基底层。与模型组比较,给予17β-雌二醇干预后,大鼠子宫内膜的腺体数量有所增加(P<0.01)。Masson染色后可见模型组大鼠的子宫内膜纤维化面积较对照组显著增加(P<0.01),而给予17β-雌二醇治疗后,子宫内膜纤维化面积的比例降低(P<0.01,图2)。
图1 各组大鼠子宫大体形态A.对照组;B.模型组;C.治疗组
2.各组大鼠子宫内膜CD31表达情况:与对照组比较,CD31的表达水平在模型组显著下降(P<0.01)。IUA大鼠给予17β-雌二醇治疗后,CD31的表达水平在受损的子宫内膜部位有所上调(P<0.05,图2)。

图2 各组大鼠子宫HE、Masson染色及CD31的表达A~F.各组大鼠子宫内膜HE染色(A~C.×40;D~F.×200);G~I.各组大鼠子宫内膜Masson染色(×400);J~L:各组大鼠子宫内膜CD31免疫组化染色(×400);M.各组大鼠子宫内膜腺体数量的统计图;N.各组大鼠子宫内膜纤维化面积比的统计图;O.各组大鼠子宫内膜CD31表达情况的统计图。*P<0.05,**P<0.01
3.各组大鼠子宫组织中内质网应激相关凋亡蛋白(GRP78、CHOP)及PI3K/Akt和ERK1/2通道相关蛋白的表达情况:与对照组比较,模型组大鼠子宫组织中内质网应激相关凋亡蛋白(GRP78和CHOP)表达显著升高(P<0.01),而17β-雌二醇治疗后其表达有所降低(P<0.05)。在模型组中,子宫内膜组织磷酸化的Akt和ERK表达水平较对照组显著下降(P<0.01),而给予17β-雌二醇治疗后,p-Akt和p-ERK的下降情况有所逆转(P<0.05,图3)。
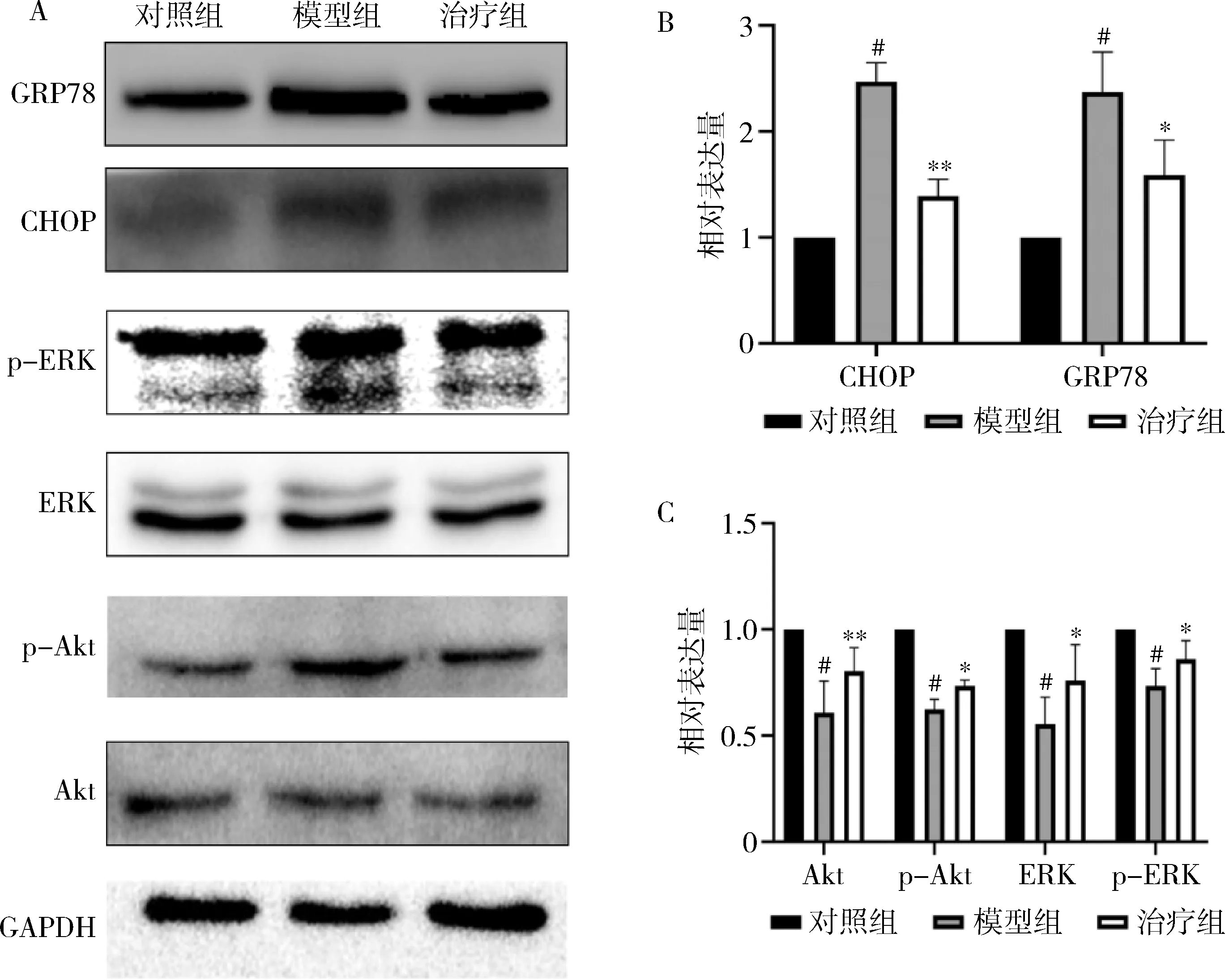
图3 各组大鼠子宫组织中蛋白的表达A.各组大鼠子宫蛋白表达情况;B.各组大鼠子宫GRP78和CHOP蛋白相对表达量的统计分析图;C.各组大鼠Akt、p-Akt、ERK、p-ERK蛋白相对表达量的统计分析图。与对照组比较,#P<0.01;与模型组比较,*P<0.05,**P<0.01
讨 论
研究表明,使用生理剂量的雌激素治疗宫腔粘连有利于子宫内膜的损伤修复[8,9]。Jolinda等[10]研究认为,无论患者IUA程度如何,雌激素都是有效的,建议复发性IUA患者常规使用雌激素作为围术期的辅助治疗。本研究中HE及Masson染色结果显示,治疗组与模型组比较,子宫内膜腺体数量明显增加,而子宫内膜纤维化面积明显减少。CD31免疫组化结果显示治疗组的微血管数量明显增加,表明17β-雌二醇对子宫内膜损伤有着明显的改善作用。
近年来,越来越多的研究表明,内质网应激诱导细胞凋亡与疾病的发生、发展密切相关。研究证实,大鼠脊髓损伤后,内质网应激诱导的细胞凋亡相关蛋白,包括GRP78和CHOP都明显增加[11]。一项关于动脉粥样硬化的研究也表明,冠状动脉内皮细胞的功能障碍和损伤与内质网应激相关[12]。也有研究表明,内质网应激与肝脏纤维化呈明显的相关性[13,14]。然而,内质网应激在IUA的发生、发展中的作用目前还较少被深入研究。本研究发现,内质网应激诱导的细胞凋亡参与了IUA的发生,相关凋亡蛋白的水平在模型组大鼠中显著增加。而给予17β-雌二醇治疗可以抑制相关细胞凋亡蛋白的表达,减少损伤引起的内质网应激,促进子宫内膜再生。
PI3K/Akt和ERK1/2通路作为E2激活的主要下游信号通路,在许多细胞的生理过程中发挥重要作用,如细胞增殖和迁移以及组织的纤维化[15~17]。其中,PI3K/Akt信号通路在促进细胞增殖、抑制细胞凋亡中发挥重要作用[18]。PI3K可使其下游靶蛋白Akt发生磷酸化,进而使糖原合成酶激酶-3β磷酸化而失活,因而丧失诱导细胞凋亡的作用;同时p-Akt还可以抑制促凋亡蛋白的合成,从而发挥抑制细胞凋亡的作用[1,19]。研究表明,低剂量E2可以激活大鼠海马的PI3K/Akt和ERK1/2通路,使磷酸化的Akt和ERK的表达显著升高,从而促进神经元细胞的存活[20]。本研究中IUA大鼠子宫组织中p-Akt和p-ERK较对照组均显著下降,而下降的p-Akt和p-ERK在给予17β-雌二醇治疗后表达有所上升,提示在IUA中PI3K/Akt和ERK信号通路被抑制,而E2可以激活大鼠子宫内膜的PI3K/Akt和ERK通路。
综上所述,本研究通过建立SD大鼠机械损伤宫腔粘连模型,验证了17β-雌二醇能促进子宫内膜的结构修复,从而起到治疗作用。本研究证明了内质网应激和PI3K/Akt、ERK1/2通路与子宫内膜损伤修复均呈显著的相关性,但二者之间的关系尚不明确,其具体的作用机制仍有待于进一步研究。
——疾病防治的新靶标

