流式细胞术外周血白细胞分类方法的建立和性能评价
宋 颖, 韩姣姣, 赵 强, 徐 翀
(上海市临床检验中心临床血液体液学研究室,上海 200126)
外周血白细胞分类计数对感染和血液系统疾病的诊断和治疗有重要意义。随着临床实验室自动化程度的不断提高,全自动五分类血液分析仪已成为主流仪器。在快速获得白细胞分类结果的同时,仪器分类结果的可靠性验证、分类结果室内质控失控后的处理、室间质评超出范围后的原因分析等问题也日益显现。
目前,各品牌血液分析仪配套校准品中均未包含白细胞分类计数参数,白细胞分类结果的可靠性一般是根据WS/T 246—2005《白细胞分类计数参考方法》[1]的要求进行评估,导致不同品牌,甚至同品牌不同型号的全自动血液分析仪白细胞分类结果可比性较差。现有的白细胞分类计数参考方法基于操作人员显微镜下观察染色血涂片的结果,具有很强的主观性,存在操作人员技术水平差异较大、观察区内细胞分布不均匀、观察细胞数量有限、精密度差等诸多问题。流式细胞分析可大大提高分析细胞的数量,单克隆抗体的特异性结合也能提高对细胞的识别能力,建立基于流式细胞术原理的白细胞分类方法有重要的实际意义。本研究参照国际血液学标准化委员会(the International Council for Standardization in Haematology,ICSH)相关指南的建议[2],采用流式细胞术进行外周血白细胞分类计数,并与全自动血液分析仪和显微镜镜检分类结果进行比较,以期建立一种可有效补充原有手工分类计数法的流式细胞术白细胞分类方法,进一步提高临床血常规检测中白细胞分类的准确性。
1 材料和方法
1.1 样本来源
选取2021年8月—2022年3月上海市临床检验中心健康体检者50名,其中男23名、女27名,年龄24~58岁。排除有肿瘤、感染、自身免疫、心脑血管疾病等病史者。纳入标准:血常规和肝功能、肾功能、血脂、血糖等常规生化项目检测结果均在参考区间内。
1.2 仪器和试剂
日本Sysmex公司XN-20A1全自动血液分析仪及配套试剂、SP1000全自动推片染色仪。日本Olympus公司BX51光学显微镜。美国Cytek公司NL-CLC全光谱流式细胞仪;美国BD公司荧光标记单克隆抗体[3](CD16-Pacific Blue,克隆号为3G8;CD45-V500,克隆号为HI30;CD7-PE,克隆号为M-T701;CD123-PerCP-Cy5.5,克隆号为7G3;CD14-PECy7,克隆号为M5E2;CD3-APC,克隆号为HIT3a;CD19-APC,克隆号为HIB19;CD11b-APC-Cy7,克隆号为ICRF44);美国赛默飞世尔公司SYTO 16 绿色荧光核酸染色剂(货号S7578)。样本检测当日确保仪器室内质控在控。
1.3 方法
采集每位研究对象晨起空腹外周血2 mL,乙二胺四乙酸二钾抗凝,3份分装,分别采用3种方法检测:(1)显微镜镜检(手工法),将样本颠倒混匀后,用全自动推片染色仪制备成血涂片,并行瑞氏染色,由2位具备读片能力的技师按照白细胞分类参考方法[1]分别进行200个白细胞分类镜检(合计400个白细胞),并记录结果。(2)全自动血液分析仪检测(仪器法),采用全自动血液分析仪进行全血细胞计数和白细胞分类[中性粒细胞(neutrophil,NEUT)、淋巴细胞(lymphocyte,LYMPH)、单核细胞(monocyte,MONO)、嗜酸性粒细胞(eosinophil,EOS)、嗜碱性粒细胞(basophil,BASO)]计数。(3)全光谱流式细胞仪检测(流式法),在绝对值计数管中分别加入样本和单克隆抗体CD16-Pacific Blue、CD45-V500、CD7-PE、CD123-PerCPCy5.5、CD14-PE-Cy7、CD3-APC、CD19-APC、CD11b-APC-Cy7、SYTO 16进行单克隆荧光染色,采用全光谱流式细胞仪进行检测。
1.4 统计学方法
采用Medcalc软件(version 20)进行数据分析。以手工法为参考方法,评价流式法和仪器法白细胞分类结果的准确性。采用Passing&Bablok回归分析对3种方法白细胞分类结果进行两两比较,以回归方程(Y=a+bX)和概率值(P)表示。回归方程通过概率值(P)、95%可信区间、斜率(b)和截距(a)、数据分布趋势4个方面进行分析。概率值(P)≥0.05表示回归线性模型与数据的匹配程度具有相关性,斜率b越接近1,截距a越接近0,表示2种方法白细胞分类结果相关性越好。
2 结果
2.1 流式法和仪器法白细胞分类结果准确性
以手工法为参考方法,流式法中性粒细胞百分比(neutrophil percentage,NEUT%)、淋巴细胞百分比(lymphocyte percentage,LYMPH%)、单核细胞百分比(monocyte percentage,MO%)、嗜酸性粒细胞百分比(eosinophil percentage,EO%)、嗜碱性粒细胞百分比(basophil percentage,BASO%)项目分别有49、50、50、50、48例在95%可信区间内。仪器法NEUT%、LYMPH%、MO%、BASO%、EOS%分别有49、49、48、48、40例在95%可信区间内。按照99%的可信区间标准,流式法和仪器法所有白细胞分类比对结果均在参考区间内。
2.2 按流式法逻辑门判断的白细胞分类结果
本研究流式法所采用的抗体组合类型为单克隆抗体,包括CD16-Pacific Blue、CD45-V500、SYTO16、CD7-PE、CD123-PerCP-Cy5.5、CD14-PE-Cy7、CD3+CD19-APC、CD11b-APC-Cy7。ICSH指南[2]未列出逻辑门,本研究采用的设门逻辑见图1,流式法不同分类白细胞与相应抗体的反应性见表1。
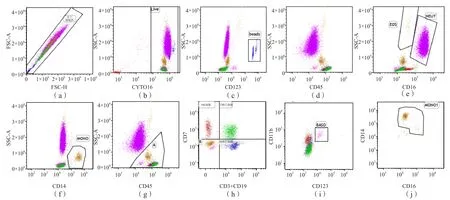
图1 流式法白细胞分类的逻辑门设置
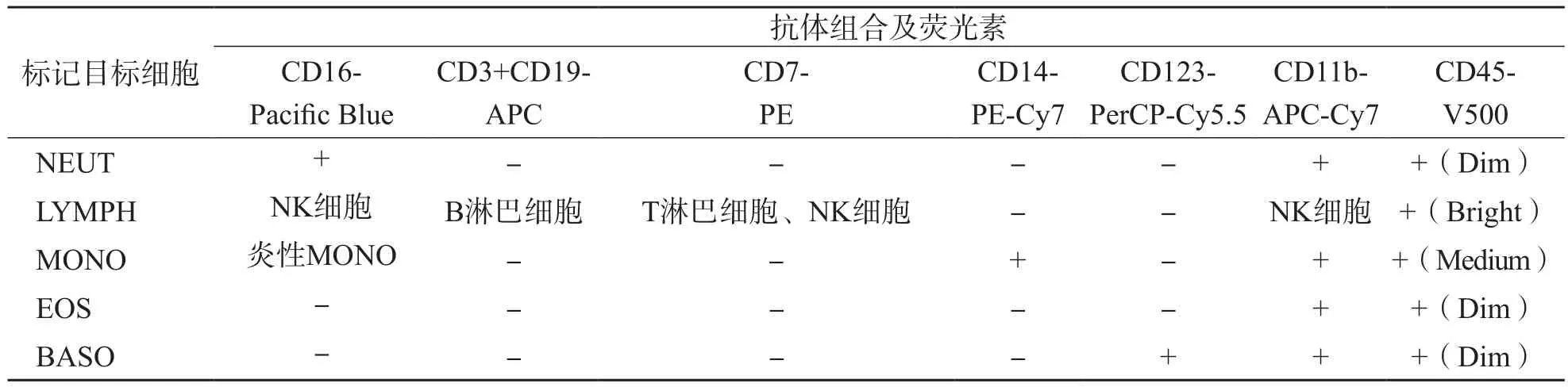
表1 不同分类白细胞对相应抗体(组合)的反应性
2.3 手工法、流式法、仪器法回归分析结果
手工法与仪器法、手工法与流式法、仪器法与流式法NEUT%的回归方程分别为Y=-1.13+0.99X(P=0.68)、Y=-0.96+0.98X(P=0.89)、Y=-1.53+1.01X(P=0.89),LYMPH%的回归方程分别为Y=1.79+0.94X(P=0.89)、Y=2.64+0.94X(P=0.26)、Y=0.90+0.98X(P=0.89),MO%的回归方程分别为Y=2.69+0.76X(P=0.42)、Y=2.74+0.68X(P=0.68)、Y=-0.11+0.97X(P=0.44),EO%的回归方程分别为Y=0.25+0.93X(P=0.89)、Y=0.29+0.86X(P=0.44)、Y=0.01+1.00X(P=0.38),BASO%的回归方程分别为Y=0.26+0.12X(P=0.44)、Y=0.30+0.50X(P=0.30)、Y=-0.23+2.33X(P=0.89)。NEUT%项目和LYMPH%项目的所有数据点均在95%可信区间范围内,MO%项目和EO%项目有个别数据点落在95%可信区间外。仪器法与流式法的BASO%项目有个别数据点落在95%可信区间外。见图2。

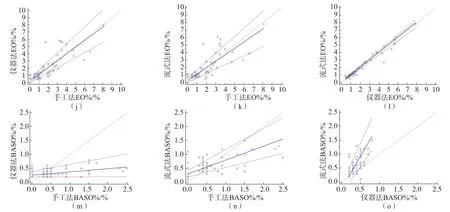
图2 NEUT%、LYMPH%、MO%、EO%、BASO%项目手工法、流式法、仪器法两两回归分析结果
从回归方程的斜率和截距可见,按方法学进行比对,表现较佳的是仪器法与流式法的相关性。按项目进行比对,表现较佳的是NEUT%和LYMPH%;仪器法与流式法EO%的回归方程表现最佳;BASO%项目3种方法两两比较的回归方程表现欠佳。
从回归方程的数据分布趋势可见,MO%项目流式法与仪器法在细胞数量较低时的结果均高于手工法。MO%项目仪器法与流式法有很好的相关性。BASO%项目手工法与流式法、手工法与仪器法的数据离散程度较大,集中趋势不明显。BASO%项目流式法与仪器法数据分布呈比例,流式法的检测结果约为仪器法的2倍。
3 讨论
目前,临床血常规检测中白细胞分类结果的参考方法仍然为手工法,此方法建立已有近20年的时间。由于手工分类的局限性,基于泊松分布的可信区间的比对已不适用于现有血液分析仪对分类结果的需求。由于血液分析仪的校准项目中不包含白细胞分类,实验室在校准白细胞分类过程中常会遇到各种困难:(1)按手工分类参考方法的允许范围判断血液分析仪分类结果符合要求,且血细胞分类室内质控结果在控,无法解释室间质评血液分析仪白细胞分类结果超出允许范围;(2)仪器工程师调整白细胞分类灵敏度系数没有依据,无法验证可靠性;(3)实验室内的多台血液分析仪分类结果可比性差,无法确定靶机;(4)血液分析仪提示异常细胞无法进行验证,即血涂片中未发现异常细胞。
为了解决这些问题,近十年来,国内外多名专家[3-11]分别发表了基于不同配色方案的流式细胞仪白细胞分类计数法。随着流式细胞仪硬件和技术的不断进步,荧光检测通道数量大大增加,且荧光素种类也更加丰富,不断推动单管多色检测的发展。ICSH指南[2]指出,要建立新的流式细胞术白细胞分类计数参考方法至少需要8色荧光或更多色抗体组合,才能从技术上满足要求。
纵观近十年的外周血白细胞分类流式法的进展,主要聚焦在6个方面:(1)采用的流式细胞仪机型更新换代;(2)采用的荧光素由5色(FITC、PE、ECD、Cy5、Cy7)增加到10色(Pacific Blue、FITC、PE、PE-Texas Red、PCX、PE-Cy7、Alexa 594、APC、A700、APCCy7);(3)采用的抗体数量由6种(CD45、CD36、CD2、CRTH2、CD19、CD16)增加到29种(CD45、κ、λ、CD19、CD34、CD20、CD10、CD5、CD2、CD7、CD8、CD3、CD4、HLA-DR、CD15、CD33、CD117、CD13、CD38、CD71、CD64、CD14、CD16、CD123、CD36、DAPI、cκ、cλ、CD56);(4)样本处理方式由多管溶血后洗涤法转变为单管溶血免洗法;(5)计数更加精确,由细胞相对百分比计数转变为绝对值计数(绝对值计数管的使用)。
考虑到流式细胞仪的检测能力和单克隆抗体荧光通道使用的数量,ICSH在2014年的指南[2]中列出了8色的配色方案(CD16-Pacific Blue、CD45 Krome Orange、SYTO16、CD7-PE、CD123-PerCP-Cy5.5、CD14-PE-Cy7、CD3+CD19-APC、CD11b-APC-A750),但至今未见最终报告发表。本研究建立了基于此配色方案的实际应用方法,并进行初步验证。从细胞分布看,各群细胞集中趋势明显,且均能被很好地区分;采用CD45/SSC、CD3、CD19和CD7的抗体组合识别NK细胞、T淋巴细胞和B淋巴细胞,采用双抗体结合的方式(CD16+和CD45+定义NEUT,CD123+和CD11b+定义BASO)识别部分LYMPH,提高了细胞识别的可靠性。
本研究还分析了不同方法白细胞分类计数结果,发现按照原有的手工法分类标准,流式法与血液分析仪法均符合要求,但无法满足血液分析仪分类灵敏度调整的需求。原因可能为:(1)手工法的细胞分类数量远远少于其他2种方法,对于特征细胞群的检出率低,如手工分类400个白细胞,BASO的检出率仍可能为0;(2)手工分类依靠检测人员主观识别,对于识别者技术要求高,某些形态变异的细胞不能被有效识别;(3)质控品说明书所示部分细胞来源为动物替代细胞,通过细胞大小的空间布局来确认仪器分类性能的稳定性,而无法确认其准确性。仪器法和流式法的基础均是流式细胞分析,仅是细胞鉴别的荧光素不同,血液分析仪采用荧光染液,流式细胞仪采用荧光素标记的单克隆抗体;单克隆抗体具有很强特异性,通过多标记结合,能够实现目的细胞群的精确识别,特别是对于外周血细胞中所占比例不高的细胞群体的识别(如BASO)优于传统手工法。从本研究汇总数据的回归方程看,3种方法NEUT、LYMPH分类结果具有可比性,仪器法与流式法的相关性优于另外2种组合。对于EOS的分类,仪器法与流式法结果高度一致。对于MONO的分类,流式法和仪器法在低值区域的识别率高于手工法。对于BASO的分类,流式法具有最佳的识别能力,可能与单克隆抗体的特异性识别有关。
本研究进行了单管8色流式法计数的探索,目的是提高外周血白细胞分类的准确性和精确性,为全自动血液分析仪白细胞分类提供技术保障。通过流式法对白细胞分类结果进行赋值,从而部分替代形态学方法验证血液分析仪分类结果的可靠性。此种方法在比例较低的细胞群体的验证方面具有较好的性能表现,如MONO、BASO可以通过流式特异性抗体结合的方法验证血液分析仪分类的可靠性。研究流式细胞术白细胞分类法的最主要目的不是将其作为临床实验室的常规方法,而是帮助全血细胞分类计数仪的生产企业借助此参考方法在仪器研发、校准品和质控品的定值方面有所突破[2],从仪器生产的源头有效提高各仪器检测结果的一致性。作为质量监管部门,可以通过流式细胞术这一新的白细胞分类计数方法对新鲜全血进行赋值,评估并监控临床实验室相关项目检测结果的一致性。同时也可以在正确度验证活动中对表现不佳的仪器进行技术改良或革新。
综上所述,本研究建立的8色流式细胞术白细胞分类方法可同时适用于上游的生产厂家和下游的终端用户(临床实验室),对快速、有效地提高白细胞分类计数结果的一致性具有重要意义。当然,如果临床实验室能够投入人力、物力和技术建立这一流式细胞术白细胞分类方法,不仅可以日常监控全自动血液分析仪的工作性能,对血液胞分析仪报警样本进行准确复核,还能及时对特征细胞群体作出初步确认。

