高浓度胆红素对流式细胞术外周血淋巴细胞亚群检测的干扰和消除方法
薛 燕, 许 俐, 党利亨, 王 朝, 崔亚琼, 王 萍, 王 宁, 张新杰, 刘 洋
[1.天津市儿童医院(天津大学儿童医院) 天津市儿科研究所 天津市儿童出生缺陷防治重点实验室,天津 300134;2.天津市儿童医院(天津大学儿童医院)新生儿内科,天津 300134]
目前,流式细胞术( flow cytometry,FCM)已在检验医学领域被广泛应用,其检测结果受样本采集、抗体选择、红细胞裂解方法等多种因素的影响[1-2]。在实际工作中,我们发现部分高浓度胆红素样本存在异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的CD3+细胞群与CD3-细胞群荧光表达分界不清,进而影响设门的情况,直接影响了FCM检测结果的准确性。国内外已有较多关于胆红素对具体检测项目的干扰机制及其纠正方法的研究[3-4],但目前尚无胆红素对FCM检测的干扰的报道,且试剂说明书中亦无相关信息。为了验证高浓度胆红素是否会对采用FCM检测外周血淋巴细胞亚群产生干扰,本研究拟采用配对差异实验评估高浓度胆红素对FCM外周血淋巴细胞亚群检测结果的影响。
1 材料和方法
1.1 研究对象
选取2020年10月—2021年10月于天津市儿童医院住院,血清总胆红素(total bilirubin,TB)>200 μmol/L,且进行淋巴细胞亚群检测的患儿51例,依据直接胆红素(direct bilirubin,DBil)或间接胆红素(indirect bilirubin,IBil)水平分为高DBil组(DBil>171 μmol/L 6例,其中男2例、女4例,年龄5个月~14岁,包括自身免疫性肝炎2例、急性肝功能衰竭2例、肝豆状核变性1例、自身免疫性溶血性贫血 1例)和高IBil组[IBil>171 μmol/L,45例,其中男25例、女20例,年龄1~41 d,包括新生儿高胆红素血症28例、新生儿溶血症(ABO血型不合)7例、新生儿败血症10例]。另选取健康体检儿童6名作为对照组,其中男3名、女3名,年龄1~11岁,采集其血液样本(无黄疸)作为对照样本。
1.2 方法
1.2.1 淋巴细胞亚群检测 采用 FACSCantoⅡ流式细胞仪(美国BD公司)及配套六色淋巴细胞亚群检测试剂盒(货号662967)检测外周血T细胞亚群(CD3+、CD3+CD4+、CD3+CD8+)百分比、B细胞(CD3-CD19+)百分比、自然杀伤(natural killer,NK)细胞(CD3-CD16+/CD56+)百分比。首次检测采用染色-裂解的免洗方法,具体操作步骤:在流式管中依次加入20 μL抗体、50 μL乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝全血样本,震荡混匀后在室温下避光反应15 min,然后加入450 μL FASC溶血素(美国BD公司)裂解红细胞,震荡混匀后在室温下避光孵育15 min,上机检测。
1.2.2 TB和DBil检测 采用cobas c701全自动生化分析仪(瑞士罗氏公司)或cobas c501全自动生化分析仪(瑞士罗氏公司)及配套试剂(重氮法)检测血清TB和DBil水平。计算IBil(IBil=TB-DBil)。TB、DBil和IBil的参考区间分别为0~26、0.0~8.0、3.4~10.3 μmol/L。
1.2.3 干扰试验 采用配对差异实验分析胆红素对FCM淋巴细胞亚群检测的干扰。将高DBil组样本离心后制备成高DBil血浆,浓度分别为198.1、222.0、229.0、350.4、483.4、1 086.5 μmol/L,分别取50 μL加入随机配对的对照样本中,作为干扰样本。2种样本均按染色-裂解的免洗方法处理,并采用FCM检测。
1.2.4 高浓度胆红素干扰消除方法 (1)洗涤-染色-裂解法:将高DBil组样本进行洗涤-染色-裂解处理,吸取200 μL EDTA抗凝全血加入流式管中,加入2 mL磷酸盐缓冲液(phosphate-buffered saline,PBS)震荡混匀,350×g离心5 min,轻轻吸取2 mL上清,弃去。将剩余样本染色、裂解,并采用FCM检测。(2)染色-裂解-洗涤法:将干扰样本进行染色-裂解-洗涤处理,在经染色-裂解免洗方法处理的干扰样本中加入2 mL PBS,震荡混匀,350×g离心5 min,轻轻吸取2 mL上清,弃去。剩余样本采用FCM检测。
1.2.5 干扰剂量评估 取4份无黄疸EDTA抗凝全血样本,每份样本按50 μL/管分装,分别加入6个流式管中。取干扰检查A试剂盒(日本Sysmex公司,批号ER8001)中的DBil干粉,加2 mL蒸馏水,溶解成3 236 μmol/L的高浓度原液,随后用PBS稀释成6个浓度梯度。分别吸取10 μL梯度溶液加入含50 μL全血样本的流式管中,将每份样本配制成6个DBil浓度梯度(0、100、150、200、250、500 μmol/L),覆盖低、中、高浓度范围。将所有样本进行染色、裂解处理,采用FCM检测。
1.3 统计学方法
采用SPSS 26.0软件进行统计分析。呈正态分布的计量资料以±s表示,2个组之间比较采用配对t检验。采用Pearson相关分析评估干扰样本与对照样本淋巴细胞亚群检测结果的相关性。呈非正态分布的计量资料以中位数(M)[四分位数(P25~P75)]表示。以P<0.05为差异有统计学意义。
2 结果
2.1 高DBil组和高IBil组胆红素检测结果
高DBil组TB为330(241.4~741.6)μmol/L,DBil为289.7(216.0~634.2)μmol/L。高IBil组TB为227.4(211.1~263.6)μmol/L,DBil为14.0(11.2~21.4)μmol/L。
2.2 高DBil组和高IBil组淋巴细胞亚群检测结果
高IBil组基于六色荧光表达的淋巴细胞亚群设门策略不受影响,见图1。高DBil组均出现FITC标记的CD3-与CD3+细胞群荧光表达分界不清,见图2。

图1 高IBil组淋巴细胞亚群分析散点图

图2 高DBil组经染色-裂解法处理后FITC标记的CD3-与CD3+细胞群荧光表达情况
2.3 干扰试验结果
对照样本FITC标记的CD3-与CD3+细胞群荧光表达分界清晰。采用染色-裂解法处理干扰样本后,出现FITC标记的CD3-与CD3+细胞群荧光表达分界不清。见图3。

图3 对照样本和经染色-裂解法处理后的干扰样本FITC标记的CD3-与CD3+细胞群荧光表达情况
2.4 DBil干扰剂量
随着DBil水平的升高,FITC标记的CD3-与 CD3+细胞群逐渐靠近。当DBil≤150 μmol/L时,干扰较小,对FCM设门基本无影响;当DBil≥200 μmol/L时,干扰较大,FITC标记的CD3-与CD3+细胞群出现部分重叠,影响FCM设门。见图4。
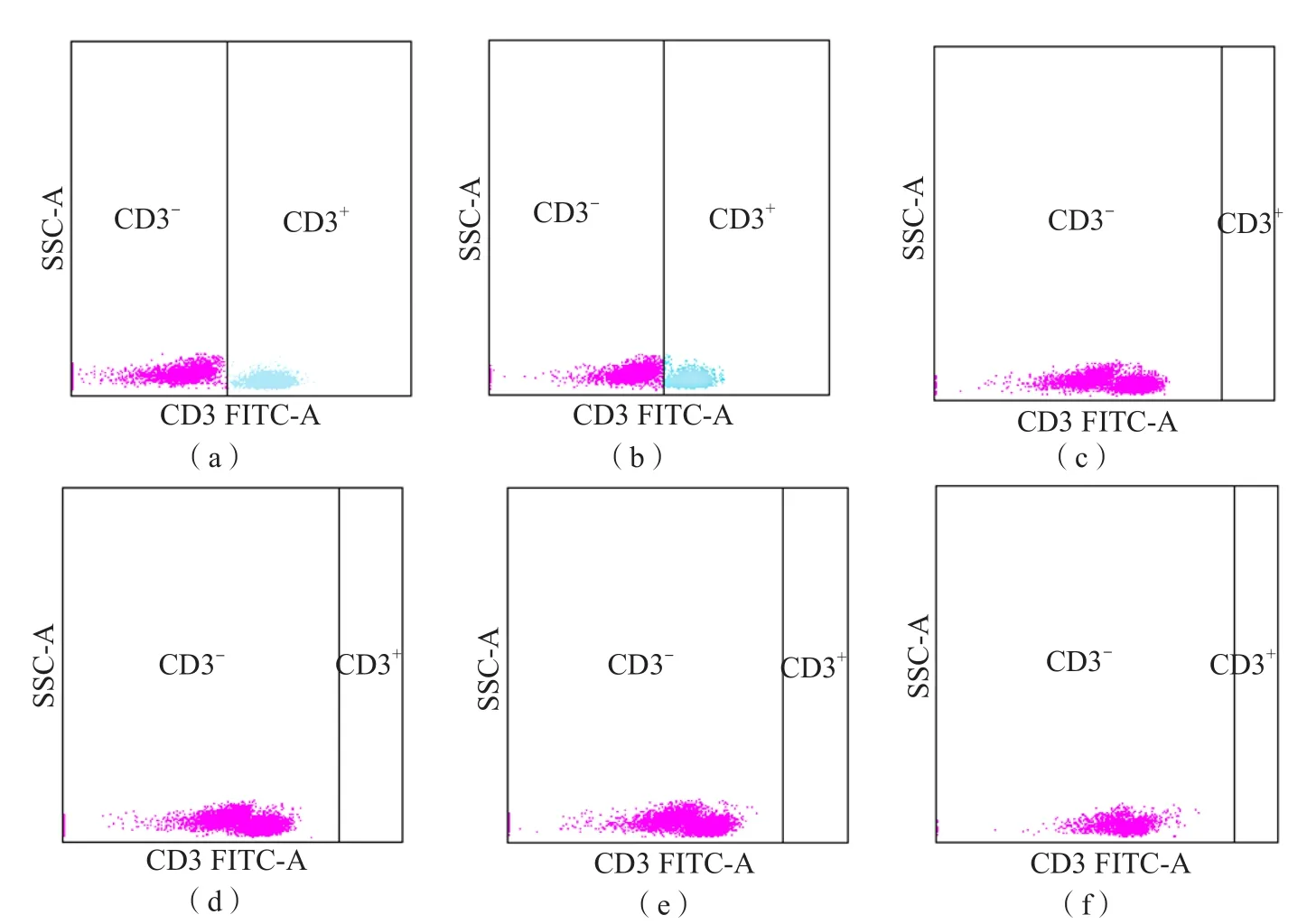
图4 不同浓度DBil样本经染色-裂解处理后,FITC标记的CD3-与CD3+细胞群荧光表达情况
2.5 干扰消除方法
高DBil组样本经洗涤-染色-裂解法处理和干扰样本经染色-裂解-洗涤法处理后,采用FCM检测,结果显示,FITC标记的CD3-与CD3+细胞群的荧光表达分界清晰。见图5、图6。

图5 高DBil组样本经洗涤-染色-裂解法处理后,FITC标记的CD3-与 CD3+细胞群荧光表达情况

图6 干扰样本经染色-裂解-洗涤法处理后,FITC标记的CD3-与 CD3+细胞群荧光表达情况
干扰样本经染色-裂解-洗涤法处理后的淋巴细胞亚群检测结果与对照样本经染色-裂解方法处理后的淋巴细胞亚群检测结果比较,差异均无统计学意义(P>0.05)。见表1。

表1 干扰样本经染色-裂解-洗涤方法处理与对照样本经染色-裂解方法处理的淋巴细胞亚群百分比比较
2.6 对照样本与干扰样本经处理后淋巴细胞亚群检测结果的相关性
Pearson相关分析结果显示,干扰样本经染色-裂解-洗涤法处理后的CD3+、CD3+CD8+、CD3+CD4+、CD3-CD16+/56+、CD3-CD19+细胞百分比和CD4/CD8比值与对照样本均呈显著正相关(r值分别为0.977、0.994、0.950、0.941、0.996、0.965,P<0.05)。
3 讨论
为了验证胆红素成分是否能干扰FITC标记的CD3抗原的荧光表达,本研究设立了高DBil组和高IBil组。同时,结合工作中遇到的存在这种问题的样本,本研究将样本入选标准定为血清TB>200 μmol/L。
田禾等[5]发现,高浓度胆红素对FITC荧光信号的检测有一定的干扰,且胆红素浓度越高,干扰越大,但具体干扰机制尚不明确。胆红素是人体血清中重要的内源性荧光物质之一,在一定波长光的激发下,呈现荧光发射光谱,其发射光主峰在520 nm处[6-7]。标记CD3抗原的FITC的最大激发波长为494 nm,发射光主峰在520 nm处。由于胆红素和FITC的发射光谱非常接近,因此会发生荧光信号叠加,这可能是高浓度胆红素会对FITC标记的CD3抗原的荧光表达产生干扰的原因。
本研究结果显示,与高IBil组相比,高DBil组更易出现CD3-与CD3+细胞群分界不清。配对差异实验结果显示,将高浓度DBil血浆加入非黄疸样本会导致FITC标记的CD3-与CD3+细胞群荧光表达分界不清,表明荧光信号受到了干扰。IBil与DBil对FITC荧光信号表现出不同的影响,可能与二者在人体内的存在形式不同有关。IBil是红细胞被破坏后形成的胆红素,在外周循环中以与白蛋白结合的形式存在,不溶于水,每个白蛋白可以结合2个IBil分子。史晓敏等[8]的研究结果显示,当IBil水平很高时,会导致白蛋白之间发生交联,形成一些比较微小的颗粒物质。这种微小的颗粒可能在FCM淋巴细胞亚群检测的设门策略的第1步,即以SSC/CD45设门分析定位淋巴细胞时已经被判断为非淋巴细胞的颗粒,不纳入后续设门,因此对FITC荧光信号无影响。DBil是经过肝脏加工后的胆红素,其实质为胆红素分子与1个或2个葡萄糖醛酸分子单独酯化形成的结构,易溶于血浆和样本处理所用的裂解液,因此可能对FITC荧光信号的干扰较大。
本研究结果显示,DBil对采用FCM检测淋巴细胞亚群的干扰程度会随浓度的升高而增大,当血中DBil≤150 μmol/L时,干扰较小,对设门基本无影响,不会影响FCM检测;当血中DBil≥200 μmol/L时,干扰较大,FITC标记的CD3-与CD3+细胞群出现部分重叠,影响设门。如不采取有效措施解决此问题,将影响FCM检测结果的准确性。
本研究结果还显示,采用洗涤-染色-裂解和染色-裂解-洗涤2种方法均能有效消除DBil对FITC荧光信号的干扰。从操作步骤上来说,洗涤-染色-裂解方法是在发现干扰后重新处理样本,而染色-裂解-洗涤方法是将采用免洗方法处理的样本仅通过洗涤这1个步骤即可再次上机检测。后者更节约时间,且经染色-裂解-洗涤方法处理的干扰样本淋巴细胞亚群的检测结果与对照样本比较,差异无统计学意义(P>0.05),二者淋巴细胞亚群检测结果的相关性良好(r值均>0.94,P<0.05)。
目前,淋巴细胞亚群绝对计数在临床上已广泛开展。然而,高DBil样本经过洗涤后,无法通过单平台直接得出各淋巴细胞亚群准确的绝对计数。本研究结果显示,此类样本洗涤后各淋巴细胞亚群的百分比与未干扰样本比较,差异均无统计学意义(P>0.05)。因此,可以根据洗涤前总淋巴细胞绝对计数和洗涤后重新检测得到的各淋巴细胞亚群的百分比,通过计算获得各淋巴细胞亚群的绝对计数。若流式细胞仪专用软件检测结果中不包括总淋巴细胞绝对计数,也可以通过公式:洗涤前总淋巴细胞绝对计数=(洗涤前淋巴细胞群区域的事件数/洗涤前绝对计数微球区域的事件数)×[每次测定的微球数量/总体积(50 μL)]计算得出,式中每次测定的微球数量可在绝对计数管包装标签上找到,试剂批次不同该值可能会不同。
综上所述,高浓度DBil会干扰FITC的荧光信号,导致采用FCM检测FITC标记的CD3-与CD3+细胞群荧光表达分界不清。采用染色-裂解-洗涤方法处理,可最大程度地消除这种干扰,保证FCM检测结果的准确性。

