腹腔镜Miles术盆底腹膜关闭与否近期疗效对比研究
张 强,于 杰,臧金林
(青岛市市立医院普通外二科,山东 青岛,266011)
近年随着腔镜水平的提高,直肠癌术中对于关闭盆底腹膜仍存在争议,使其成为目前的研究热点[1-2]。本文将近5年青岛市立医院普外二科开展的腹腔镜下关闭盆底腹膜的腹腔镜Miles术的围术期情况汇报如下。
1 资料与方法
1.1 临床资料 回顾分析2017年1月至2022年3月青岛市市立医院普通外科收治的160例低位直肠癌患者的临床资料,本文已通过青岛市立医院伦理委员会批准。纳入标准:35~75周岁,BMI<30 kg/m2,肿瘤下缘距肛缘≤5 cm,术前病理证实为直肠癌;术前未接受新辅助放化疗;术前影像学资料证实无远处脏器转移;患者签署知情同意书。排除标准:合并其他恶性肿瘤;消化道穿孔、肠梗阻等需急诊手术;已发生远处转移。研究对象根据术式分为观察组(n=82,行关闭盆底腹膜的腹腔镜Miles术)与对照组(n=78,行不关闭盆底腹膜的腹腔镜Miles术)。
1.2 手术方法 采用常规五孔法操作,脐上1 cm处穿刺10 mm Trocar作为观察孔,右侧髂前上棘内侧3 cm处穿刺12 mm Trocar作为主操作孔,右侧锁骨中线平脐穿刺5 mm Trocar,左锁骨中线平脐与左侧反麦氏点各穿刺5 mm Trocar。气腹压力维持在15 mmHg。探查腹腔脏器,超声刀切开乙状结肠与直肠的右侧腹膜,沿Toldt筋膜解剖。向上解剖分离肠系膜下血管,清扫周围淋巴组织,并于根部离断肠系膜下动静脉后切开乙状结肠与直肠的外侧腹膜,上至降结肠,下至盆底。沿直肠后间隙向下分离,注意保护腹下神经,解剖直肠直至盆底。距肿瘤上缘10 cm处切断乙状结肠,会阴处荷包缝合肛门,距肛门边缘3 cm处切开皮肤,切除肛管及坐骨肛管间隙组织、肛提肌及直肠。近端结肠常规行腹膜外乙状结肠造口,造口可容两指。缝合会阴部切口,重建气腹,CO2气腹压力调至8 mmHg,倒刺线连续缝合关闭盆底腹膜,缝线长度约30 cm,针距约1.5 cm,两侧距0.5 cm,由膀胱直肠陷窝或子宫直肠陷窝开始连续缝合盆底腹膜。见图1、图2。对照组不关闭盆底腹膜,余步骤同观察组。

图1 连续缝合 图2 关闭盆底腹膜
1.3 观察指标 比较两组手术时间、出血量等术中指标,术后首次排气时间、住院总时间、并发症发生率(切口感染、肠梗阻、内疝)等围术期指标,以判定关闭盆底腹膜的围术期疗效。

2 结 果
2.1 临床资料 两组患者性别、BMI、年龄等基本资料差异无统计学意义(P<0.05)。见表1。

表1 两组患者临床资料的比较
2.2 手术结果 观察组与对照组手术时间、手术出血量差异无统计学意义(P>0.05);观察组术后首次排气时间、住院总时间、肠梗阻发生率、内疝发生率均低于对照组(P<0.05)。见表2。肠梗阻发生于术后3~5 d,患者出现进行性加重的腹胀,恶心呕吐,伴有排气排便的停止,紧急行全腹部CT检查,可见肠管扩张,以小肠为主,盆腔积液。观察组患者均经胃肠减压、禁饮食、补液、抗炎、营养支持治疗等,症状较前好转,保守治疗1周后症状缓解,恢复排气排便,复查CT,恢复良好,顺利出院;对照组患者出现肠梗阻症状,其中1例经保守治疗症状无缓解,进行性加重,遂急症行剖腹探查术,探查见腹腔内大量肠管扩张,以结肠扩张为主,分解粘连,肠管减压,肠管血运无异常,留置腹腔引流,仔细关腹;8例患者经保守治疗,症状好转;患者均顺利出院。对照组中6例患者因未关闭盆底腹膜发生内疝,2例进行性腹疼加重,无排气排便,炎症反应指标高,CT检查可见肠管成团,肠系膜血管呈“漩涡征”,考虑腹内疝,紧急手术治疗,及时解除肠管卡压,恢复肠管血运,未造成严重后果,术后患者恢复良好,按时出院;余4例经过对症保守处理,症状缓解,顺利出院。
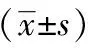
表2 两组患者手术效果及近期临床疗效的比较
3 讨 论
随着腔镜技术的迅猛发展,腹腔镜下经腹会阴联合直肠癌根治术(Miles术)是距肛缘5 cm内的低位直肠癌患者的首选术式,视野清晰、创伤小、安全性高、康复快[3],使其在临床得到广泛开展[4]。由于腔镜手术对术者技术要求较高,镜下连续缝合相对困难,使得手术时间延长,加之认识不足,大部分医院腔镜手术中不进行盆底腹膜重建,由此引发较多争议[5-6]。支持关闭的原因包括:(1)盆腔呈漏斗形态,手术切除了大量盆底组织,创面较大,术后渗液较多,如果引流不畅容易形成脓肿,关闭盆底腹膜减少了此创面。其次,术后盆腔无直肠及直肠系膜的填充,缺损巨大,不重建盆底腹膜,患者站立位时小肠受重力影响坠入盆腔,大大增加了内疝及肠梗阻的发生率[7]。部分进展期直肠癌患者术后需接受放疗,术中若未能重建盆底腹膜,坠入盆底的小肠容易诱发放射性肠炎[8]。(2)Miles术后会阴部切口感染及切口裂开常见,术中不重建盆底腹膜,术后失去腹膜屏障,会阴部炎症可逆行感染,波及盆腔,甚至直接感染盆腹腔内脏器,诱发重症腹腔感染[9]。尽管重建盆底腹膜具有上述优势,但实际操作中存在以下相对禁忌:(1)BMI≥30 kg/m2的患者,术中需过多解剖直肠系膜,造成直肠两侧盆底腹膜缺损较大,难以直接缝合;(2)缝合困难或张力过大,禁强行重建盆底腹膜;(3)接受新辅助治疗的患者,盆底腹膜纤维化,其弹性差、张力较大,直接缝合容易导致盆底腹膜撕裂。反对关闭盆底腹膜的原因包括:(1)为关闭盆底腹膜,需减少腹膜张力、尽可能多地保留肠周后腹膜组织,这违背了全直肠系膜切除术的理念,增加了肿瘤残留的风险[10]。(2)重建盆底腹膜受术者影响较大。缝合技术欠佳,针距较大,容易造成盆底裂孔疝[11]。其次,由于术者操作不熟练,重建盆底腹膜容易损伤周围重要脏器及组织,进一步延长手术时间,增加创伤。(3)关闭的盆底腹膜影响创面渗液引流,容易造成包裹性积液,从而导致腹腔或盆腔感染[12-13]。
随着腔镜技术的开展,术者腔镜技术日益熟练,加之当下热门的膜解剖理念,腔镜下缝合关闭盆底腹膜并不困难。术者熟练的腹腔镜操作,准确的进出针方向及位置调整,可快速且准确地完成腔镜下组织的缝合,对解剖层次的熟知,解剖结构准确定位,可避免额外术中损伤、延长手术时间。观察组手术时间并未过分延长,且两组术中出血量差异亦无统计学意义,究其原因,术中术者解剖层次清晰,缝合过程尽量避开血管区,减少了出血;使用倒刺线连续缝合关闭盆底腹膜,倒刺线上被覆众多倒钩,严密缝合的同时起到拉紧组织的作用,组织不易松动滑脱,降低了二次出血的风险。缝合过程中注意保护双侧输尿管,避免其损伤,降低了并发症的发生率。缝合结束后无需额外打结固定,只需Hem-o-lok夹闭线尾固定,降低了手术难度,节约了手术时间。
腹膜作为人体的天然保护层,关闭盆底腹膜,不仅是恢复腹膜的完整,也是恢复其正常的防御、吸收、分泌等功能,关闭盆底腹膜作为开腹直肠癌手术的常规步骤[14],充分说明了关闭盆底腹膜的必要性及重要性,本文资料也充分印证了此观点。本研究中观察组并发症发生率低于对照组(P<0.05),尤其关闭盆底腹膜可有效预防肠梗阻及内疝的发生。观察组中2例发生肠梗阻,对照组9例发生肠梗阻。重建盆底腹膜,可减少因切除直肠带来的盆腔缺损。盆腔肠管活动范围缩小,肠管所受重力影响轻,可有效减轻患者站立位的不适与坠胀。肠管在有效空间内规律蠕动,降低了肠粘连的发生。再者,倒刺线连续缝合的盆底腹膜表面光滑,腹膜完整性尽早得以恢复,分泌少量液体,降低摩擦力,减少肠管粘连,肠道功能早期得到恢复,减少了肠梗阻的发生。术者对膜解剖结构的进一步熟知,不仅可最大程度地根治肿瘤,同时合理留下可缝合的腹膜,尽量降低关闭盆底腹膜的张力。严密缝合盆底腹膜,针距以1 cm最为适宜,避免针距过大,肠管由间距间钻入,导致内疝。针距过小容易导致张力过大,撕裂腹膜。结合本文,直肠癌Miles术后行盆底腹膜关闭符合解剖及生理需求,且并未额外延长手术时间、增加手术创伤,术后患者康复快,可较早恢复胃肠道功能,术后排气时间早,早期便可经口进食,住院总时间缩短,符合目前快速康复外科理念。本研究发现,会阴切口愈合情况与是否关闭盆底腹膜无关。研究显示,影响会阴切口Ⅰ期愈合的主要因素为全身营养状况、术前接受新辅助治疗、合并糖尿病、肥胖等综合因素[2,15]。因此,腔镜术前严格把握手术指征,术者不断提升手术技术,关闭盆底腹膜可使患者受益良多。
综上,关闭盆底腹膜的腹腔镜Miles术,患者术后康复快、并发症少,值得临床推广。

