侧柏茎段培养快速繁殖技术研究和黄帝手植柏克隆
章 亮,谢祥琛,王奕然,李周岐
(西北农林科技大学 林学院,陕西 杨陵 712100)
黄帝手植柏为生长在陕西省延安市黄陵县黄帝陵轩辕庙的一株侧柏(Platycladusorientalis)[1],相传由人文初祖黄帝轩辕亲手所植,距今已有5 000 a历史,是我国侧柏中年龄最大、最为珍贵的一株,是大自然留给我们的珍贵的植物资源。同时黄帝手植柏见证了中华民族5 000 a来的兴衰,具有特殊的历史和文化意义,是我国宝贵的历史文化遗产[2],目前已被列为陕西省特级古树名木[3]。通过黄帝手植柏能了解该区域几千年来的自然变迁[4],有极高的科研价值。近年来,黄帝手植柏由于年龄以及自然、人为等因素的影响,长势逐渐衰弱[5],树干内部也出现腐蚀空洞现象[6],因此,对黄帝手植柏进行克隆保存工作已迫在眉睫。
组织培养技术是植物克隆的重要手段,但植物组织培养过程中存在无性系变异的问题[7],不同的增殖途径,子代变异率不同。为了尽可能降低组培过程中的变异率,腋芽增殖途径成为黄帝手植柏组织培养的首选方法[8]。
目前,齐力旺等[9]、赵育新[10]和徐龙光[11]分别对侧柏、侧柏古树、黄帝手植柏进行了组织培养方面的研究,成功建立了侧柏和侧柏古树的离体培养技术,对黄帝手植柏的组织培养则成功诱导了不定芽,但未能生根[11]。侧柏本身属于难生根植物,而黄帝手植柏5 000 a的年龄使得生根更是难上加难,同时作为受保护的古树名木,材料采摘有限。因此,本研究先以3个不同年龄的侧柏茎段为外植体,通过腋芽增殖途径,研究侧柏茎段培养快繁技术,分析年龄对侧柏茎段培养的影响。在此基础上,筛选适宜的培养基进行黄帝手植柏茎段培养快速繁殖,优化培养技术,初步建立黄帝手植柏茎段培养快繁体系,为以后进行黄帝手植柏克隆奠定技术基础。
1 材料与方法
1.1 试验材料
试验材料分别为陕西省咸阳市杨凌区西北农林科技大学(108.06°E,34.25°N)南校区50 a左右(本研究中统一称为50 a)的侧柏以及陕西省延安市黄陵县黄帝陵(109°16′E,35°35′N)中800、3 000 a左右(本研究中统一称为800、3 000 a)的侧柏和黄帝手植柏。选取生长健壮、枝茎饱满、无病虫害的1年生枝条顶部嫩梢作为外植体,除黄帝手植柏外,其他3个年龄段的侧柏各选3~5株采样母树进行采集。其中50 a侧柏于2018年3月采集,800、3 000 a侧柏于同年6月采集,黄帝手植柏于次年3月采集。
1.2 培养条件
培养温度25±2 ℃,光照时间16 h·d-1,光照强度2 000 lx。培养基均加入30 g·L-1蔗糖和7 g·L-1琼脂,pH均为5.8~6.2。
1.3 研究方法
1.3.1 侧柏茎段培养快繁
1.3.1.1 外植体消毒 将侧柏1年生枝条的顶部嫩梢剪成2~3 cm带有顶芽和5~8个侧枝的茎段,使用洗洁精溶液浸泡30 min,然后在自来水下冲洗4 h;将冲洗好的茎段在超净工作台上,先用75%酒精浸泡30 s,无菌水冲洗3次,再用0.1%升汞分别处理4、6、8、10、12、14 min,用无菌水冲洗3次后使用无菌滤纸吸掉外植体表面水分,切除外植体底部伤口与升汞接触部分,接种至1/2 MS培养基上。每个处理均接种30~40瓶,每瓶接种1个外植体。30 d后统计污染率和存活率。
污染率=污染数/接种数×100%
(1)
死亡率=死亡数/接种数×100%
(2)
存活率=100%-死亡率-污染率
(3)
1.3.1.2 启动培养 选择外植体消毒试验中效果最好的消毒方法处理外植体后,将其接种至启动培养基上。
启动培养基处理为:1)1/2MS;2)MS;3)MS+0.1 mg·L-1NAA+0.1 mg·L-16-BA;4)MS+0.2 mg·L-1NAA+0.1 mg·L-16-BA;5)MS+0.1 mg·L-1NAA+0.3 mg·L-16-BA。
50、800、3 000 a侧柏均使用1)~5)作为启动培养基。每个处理均接种30~40瓶,每瓶接种1个外植体。30 d后统计启动率和外植体生长状况。
启动率=恢复生长外植体个数/无菌外植体个数×100%
(4)
1.3.1.3 增殖培养 分别以不同基本培养基(MS、DKW、WPM)、不同的激素配比(筛选出最佳基本培养基后加入不同浓度激素,分别为NAA:0.01、0.1、0.2,6-BA:0.1、0.3、0.5)、不同浓度的大量元素(1/4MS、1/2MS、3/4MS、MS)设置增殖培养基处理,将经过启动培养恢复生长并且生长良好的50 a侧柏无菌苗接种至增殖培养基上进行增殖培养。每个处理均接种10瓶,每瓶接种1株无菌苗,进行3次重复。30 d后统计增殖系数和无菌外植体生长状况。
以相同方法(仅将激素配比试验中的NAA梯度调整为0.1、0.2、0.3,6-BA调整为0.1、0.2、0.3,其余试验全部不变)进行800、3 000 a侧柏增殖培养试验。
增殖系数=分割前接种个数/分割后植株个数
(5)
1.3.1.4 生根培养 分别以不同基本培养基(MS、DKW、B5、White)、不同的激素配比(筛选出最佳基本培养基加入不同浓度激素,分别为IBA:0.1、0.2、0.3;6-BA:0.1、0.2、0.3)、不同浓度的大量元素(1/4MS、1/2MS、3/4MS、MS)设置生根培养基处理,选择高3 cm、生长健壮的侧柏无菌苗进行生根培养,将其接种至生根培养基上,连续培养60 d。每个处理均接种9瓶,每瓶接种1株无菌苗,进行3次重复,60 d后统计生根率及根系生长状况。
生根率=生根株数/接种数×100%
(6)
1.3.1.5 炼苗移栽 当根生长至2 cm时,进行炼苗移栽验试验。在人工气候箱中闭瓶强光炼苗7 d后,逐渐打开瓶盖,然后移栽至腐殖土∶蛭石∶珍珠岩=2∶1∶1的基质中,日常浇水管理,30 d后记录成活率。
1.3.2 黄帝手植柏克隆 在1.3.1的基础上,分析年龄对侧柏茎段培养各阶段的影响,选择可能适宜黄帝手植柏茎段培养的培养基,以相同方法进行茎段培养快速繁殖,确定黄帝手植柏升汞最佳消毒时间和各阶段最适培养基。
1.4 数据分析
采用SPSS 22.0对数据进行方差分析和Duncan多重比较(对百分数据先经平方根反正弦转换)。
2 结果与分析
2.1 不同消毒方法的消毒效果
在试验范围内(表1),消毒时间对污染率的影响在不同年龄间表现较为一致,污染率均随消毒时间延长而降低。采样母树年龄为50 a时,可以近似认为侧柏死亡率不受消毒时间影响,存活率随污染率降低而提升。而采样母树年龄为800、3 000 a时,较长的消毒时间会使侧柏出现死亡现象,导致存活率略有下降。因此,黄帝手植柏消毒时间不宜太长,选择6、8、10 min进行黄帝手植柏消毒试验。
由表1可见,黄帝手植柏茎段的污染率和存活率随消毒时间的总体变化趋势与普通侧柏茎段消毒试验结果一致,可以直接根据存活率进行选择,黄帝手植柏外植体升汞消毒8 min时存活率最高,为72.98%。
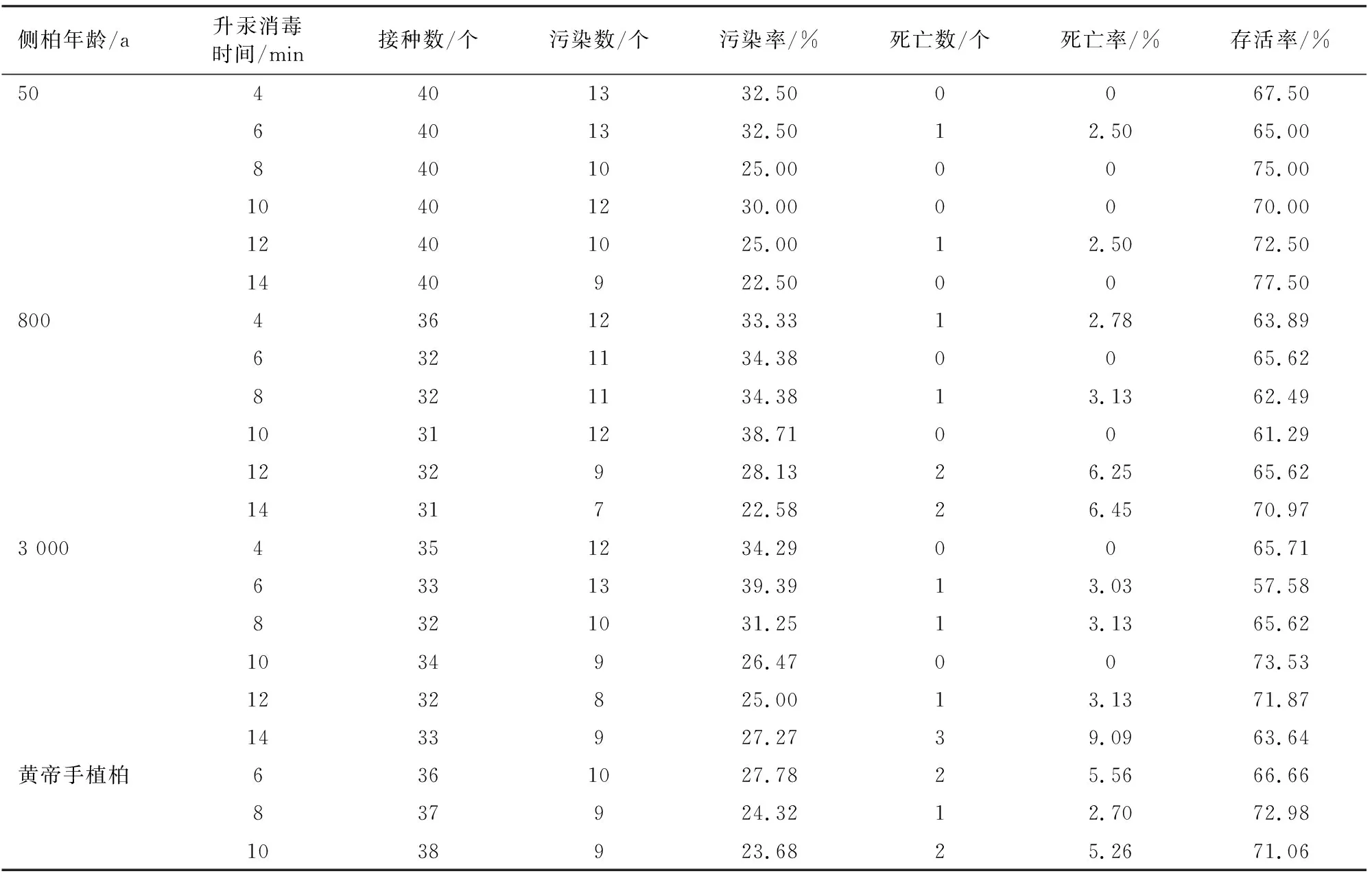
表1 不同消毒时间的消毒效果Table 1 Disinfection effect of different disinfection time
2.2 不同培养基对侧柏茎段启动培养的影响
将侧柏茎段接种到启动培养基上培养14 d,其顶芽和各个侧枝出现嫩绿新梢(图1a),表明顶芽开始萌发,侧柏茎段恢复生长,一段时间后,侧芽开始萌发(图1b)。通过3个年龄段侧柏的启动培养试验(表2),发现3个年龄段的侧柏在不同培养基上均能恢复生长,且启动率均大于90%,说明侧柏在组培过程中极易启动。
黄帝手植柏启动试验结果与普通侧柏的试验结果相同(表2),黄帝手植柏茎段在不同培养基上均能启动,且启动率均大于90%,结合黄帝手植柏生长状况,可以选择MS+0.1 mg·L-1NAA+0.1 mg·L-16-BA作为黄帝手植柏适宜启动培养基。
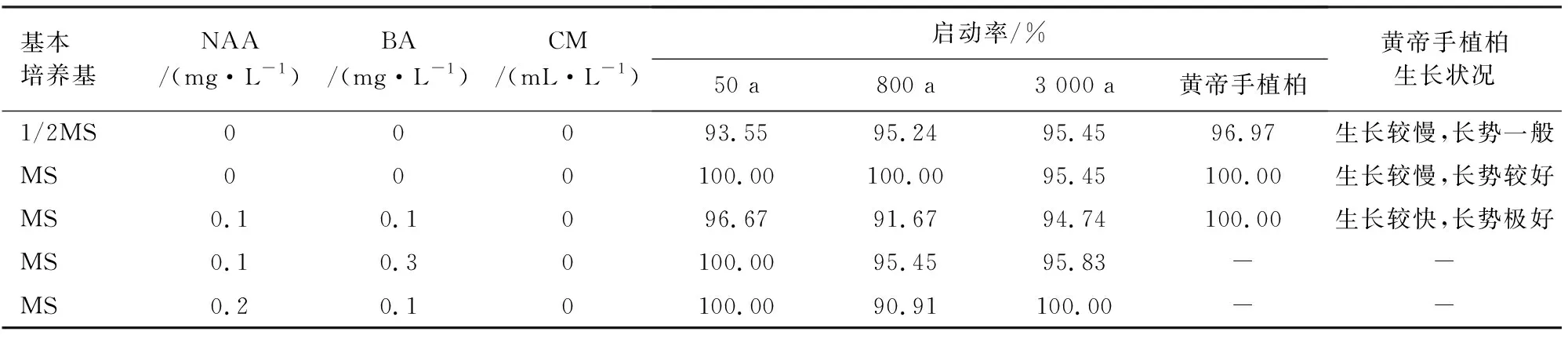
表2 不同培养基对启动培养的影响Table 2 Effect of different media on starting culture
2.3 不同培养基对侧柏茎段增殖培养的影响
通过腋芽增殖途径进行侧柏增殖培养(图1c),将恢复生长后生长良好的茎段转入增殖培养基,培养一段时间后,茎段上部枝条生长明显,下部枝条生长较慢(图1d)。由表3可知,3个年龄段的侧柏增殖培养中,最佳基本培养基均为MS基本培养基,且在一定浓度范围内,6-BA和NAA均能促进侧柏生长,提高增殖系数。但6-BA浓度过高会诱导许多不定芽产生(图1e),导致子代变异率升高,因此在增殖培养中6-BA浓度不宜太高。同时,3个年龄段的侧柏在增殖培养过程中,对激素浓度的要求不完全相同,更高的激素浓度能进一步促进50 a侧柏生长,50 a侧柏最佳增殖培养基为MS+0.2 mg·L-1NAA+0.3 mg·L-16-BA。800 a和3 000 a侧柏则更适宜在中等水平的激素浓度下进行增殖培养,最佳增殖培养基分别为MS+0.1 mg·L-1NAA+0.3 mg·L-16-BA和3/4MS+0.1 mg·L-1NAA+0.3 mg·L-16-BA。
选择增殖系数在3个年龄段中均比较高,尤其在古树增殖培养中效果较好的5种培养基进行黄帝手植柏增殖培养(表3)。结果表明,黄帝手植柏茎段培养增殖系数较低,均小于3。其中A5和A7培养基上增殖效果较好,培养基为A7时增殖系数最高,为2.52,因此黄帝手植柏的适宜增殖培养基为MS+0.1 mg·L-1NAA+0.2 mg·L-16-BA。

表3 不同培养基对增殖培养的影响Table 3 Effect of different medium on proliferation culture
2.4 不同培养基对侧柏茎段生根培养的影响
在侧柏茎段生根培养30 d后,逐渐出现生根现象。绝大多数茎段生根都是先在茎段底部形成一小块愈伤组织,再由愈伤组织分化出不定根(图1f)。仅有极少数茎段可以不经过愈伤组织阶段,直接由茎段底部生根(图1g)。侧柏生根较为困难(表4),其中50 a侧柏虽然在大多数培养基中均能生根,但生根率普遍较低,仅B3和B7培养基的生根率较高,且只有极少数茎段可以直接分化出根,50 a侧柏生根培养最佳培养基为MS+0.2 mg·L-1IBA+0.1 mg·L-16-BA+0.1 mg·L-1NAA,生根率为38.46%;800 a和3 000 a侧柏仅在少数培养基上可以生根,且生根率都极低,几乎所有的根都是由愈伤组织分化而来。两者最佳生根培养基均为MS+0.1 mg·L-1IBA+0.1 mg·L-16-BA+0.1 mg·L-1NAA,生根率分别为23.08%和11.53%。

表4 不同培养基对50、800、3 000 a侧柏生根培养的影响Table 4 Effect of different media on rooting culture for the 50-,800-,and 3 000-year-old P.orientalis trees
以800、3 000 a侧柏生根培养结果为依据,选择B1、B3、B5、B7、B10作为黄帝手植柏生根培养基进行生根培养,结果表明(表5):筛选出的5种生根培养基中,有3种可以使黄帝手植柏生根。3种培养基激素配比均为0.1 mg·L-1IBA+0.1 mg·L-16-BA+0.1 mg·L-1NAA,区别在于基本培养基,按生根率由高到低排列为:MS、DKW、1/2MS,其中基本培养基为MS时生根率最高,为10%,显著高于其余2种基本培养基。因此可以选择MS+0.1 mg·L-1IBA+0.1 mg·L-16-BA+0.1 mg·L-1NAA作为黄帝手植柏适宜生根培养基。
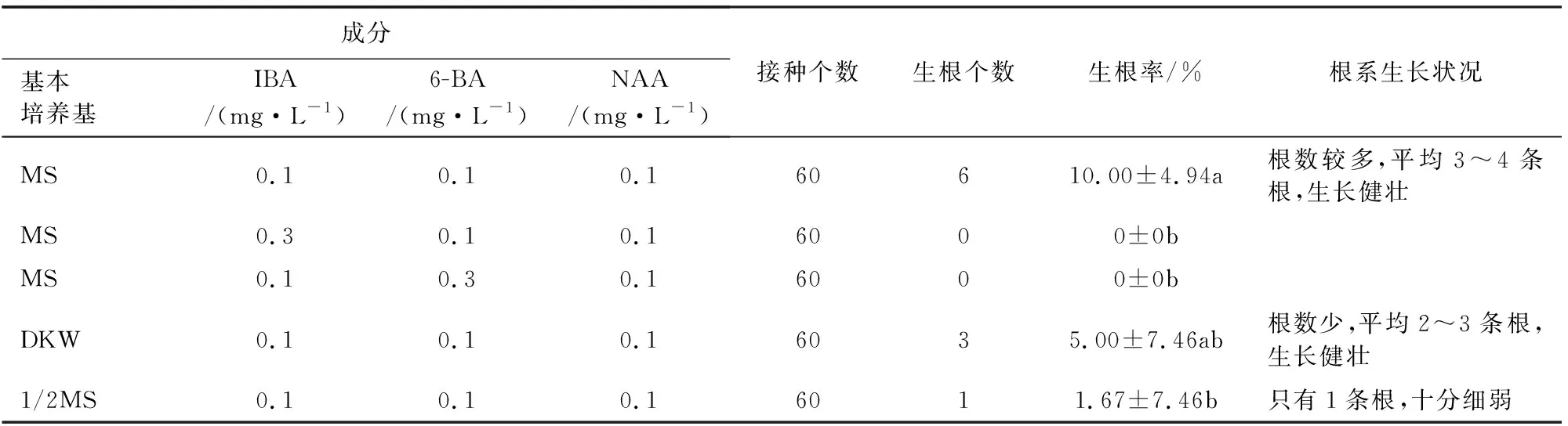
表5 不同培养基对黄帝手植柏生根培养的影响Table 5 Effect of different medium on rooting culture for the P.orientalis tree planted by Huangdi
2.5 炼苗移栽
炼苗移栽30 d后,50 a侧柏生长健壮(图1h),成活率为50%。800、3 000 a侧柏和黄帝手植柏均未能成活。
3 结论与讨论
本研究在外植体消毒试验中发现升汞消毒时间对侧柏茎段消毒效果的影响并不显著,这一结果与其他植物组织培养,如杨志坚等[12]在金边龙舌兰组培和宾宇波等[13]在百花山葡萄组培的结果不一致。植物组织培养中,消毒效果会受到消毒剂组合、消毒时长、外植体类型、采摘时间等因素的影响[14-16]。结合侧柏的生物学性状,原因可能是侧柏叶片为鳞状,包被在枝上,消毒剂难以深入叶片与枝条的缝隙中,茎段表面与升汞接触不充分,影响了消毒效果。同时侧柏茎段表面有一层油状分泌物,难以完全去除,也会影响消毒效果。
启动培养试验发现,侧柏极易启动,各处理启动率均大于90%。不过启动培养一段时间后,培养基会出现褐化现象,但褐化较轻,对茎段启动生长影响也较小,同时大多数茎段在14 d左右便可恢复生长,因此可以在启动后不久便进行继代增殖培养,继代后褐化现象基本消失。许多研究均采用了缩短继代周期的方法来减轻褐化,如朱立新等[17]在紫叶稠李组织培养研究中、饶宝蓉[18]在杉木苗组培研究中均采用这种方式成功降低了褐化的影响。
茎段增殖培养发现,各年龄、各处理的茎段增殖系数普遍较低,增殖系数均小于3,这与侧柏自身特性以及增殖途径有关,侧柏本身就具有生长缓慢的特点,而且年龄也对生长有一定影响,导致组培过程中茎段生长极为缓慢。本研究为了降低组培中存在的无性系变异,采用腋芽增殖途径进行茎段增殖,腋芽增殖的增殖系数要比不定芽增殖低上许多[19],这也会导致增殖系数不高。本研究发现黄帝手植柏最佳增殖基本培养基为MS,这与徐龙光等[20]的结果有所区别,可能是因为增殖途径不同。此外,组培过程中进行无菌苗分割时,如果分割出无菌苗过小会导致其容易死亡,因此为了提高分割后茎段成活率,尽量使切割后的无菌苗高度大于2 cm并且具有一定数量侧枝,这也会在一定程度上影响增殖系数。
生根困难是柏科植物组织培养中存在的技术难点[21-22],黄帝手植柏5 000 a的树龄更是导致生根难上加难。本研究中,50 a侧柏大多数都是先由茎段基部脱分化形成愈伤组织,然后由愈伤组织再分化出根,少量茎段可以直接分化出根。侧柏古树由于长势衰弱,分化能力下降,基本都是愈伤生根。愈伤组织生出的根系远差于茎段直接分化出的根系,因为根与茎之间没有直接连通,需要愈伤组织再分化形成输导组织,如果没有输导组织,根系吸收的营养不能传输给地上部分,移栽后植株就会死亡。同时,愈伤组织远比其他组织疏松,导致炼苗移栽过程根系极易脱落。因此,800、3 000 a侧柏和黄帝手植柏培养出的根虽然都生长较为健壮,但移栽后植株依然难以成活。
本研究通过分析3个年龄段的侧柏茎段培养结果,成功筛选出了黄帝手植柏各阶段适宜培养基,初步建立了黄帝手植柏茎段培养繁殖体系。但在生根培养中依然存在问题,黄帝手植柏生根是由愈伤组织分化出根系,生根率低且根系质量也较差,导致炼苗移栽难以成活,需进一步研究。

