丛枝菌根真菌对宁夏枸杞生长和氮代谢的影响
赵 飞,唐 明,张好强
(西北农林科技大学 林学院,陕西 杨陵 712100)
我国耕地土壤矿质元素含量偏低,其中以N素缺乏最为突出。自20世纪70年代以来,我国农田氮肥施用量不断增加,而利用率仅30%。氮肥过量施用在抑制植物生长的同时会导致土壤氮素流失并造成水资源富营养化及环境的破坏[1-2]。因此,探究提高植物氮素利用效率,对促进植物生长和改善生态环境具有重要作用。
丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)能与大多数植物形成共生结构,提高植物氮吸收能力[3],改善植物氮营养[4],但其作用机制尚处于研究阶段。H.Bückingetal[5]研究发现,AMF的根外菌丝能将NO3-还原形成NH4+并提供给宿主植物。Z.C.Jiangetal[6]研究发现,AMF能够通过提高谷氨酰胺合成酶(GS)活性增强植株的氮同化能力。
宁夏枸杞(Lyciumbarbarum)为茄科枸杞属植物,能够与多种AMF形成共生[7]。H.Q.Zhangetal[8]研究发现,AMF通过调节2个K离子通道蛋白基因(LbKT1和LbSKOR)的表达促进宁夏枸杞对土壤中K+的吸收及转运。韦素贞等[9]和W.T.Huetal[10]研究发现,AMF通过促进光合作用及提高抗氧化酶活性调控宁夏枸杞应对干旱胁迫。H.G.Liuetal[11]研究发现,AMF通过调节吲哚-3-乙酸(IAA)和叶片脱落酸(ABA)的含量以提高叶片水势,从而提高宁夏枸杞的耐盐能力。然而,AMF对宁夏枸杞氮代谢的影响尚不清楚。本研究采用盆栽法,探究不同氮处理下AMF对宁夏枸杞生长、光合作用及氮代谢的影响,旨在为揭示AMF调控植物生长提供科学依据。
1 材料与方法
1.1 试验材料
丛枝菌根真菌采用根内根孢囊霉(RhizophagusirregularisBGC BJ09),利用车前(Plantagoasiatica)作为宿主扩繁后,将植物根系和培养基质阴干磨碎后混合作为供试菌剂(20个·g-1孢子菌剂)。宁夏枸杞种子(宁杞一号)表面消毒后育苗,选取长势一致的幼苗作为供试植株。沙子洗净后烘干,过1 mm筛后与蛭石1∶1混合,高压蒸汽灭菌后作为供试基质。花盆(直径×高=8 cm×9 cm)经5%次氯酸钠浸泡消毒后使用。
1.2 试验设计
采用双因素:其一为AMF处理,分为接种(arbuscular mycorrhiza,AM)和不接种(non-mycorrhiza,NM),其二为NH4NO3处理,共3个水平,N0(0 mmol·L-1)、N1(1 mmol·L-1)、N2(15 mmol·L-1),共计6个处理,每个处理5个重复,每个重复2盆,每盆3株宁夏枸杞幼苗。
1.3 试验方法
1.3.1 植株接种培养 每个花盆装入350 g灭菌基质,基质中心填入50 g菌剂,对照组为400 g灭菌基质。每周浇灌50 mL的Hoagland营养液,30 d后停止浇灌营养液,并进行氮处理,N0、N1、N2处理分别浇灌0、1、15 mmol NH4NO3溶液(研究发现NH4NO3浓度大于等于15 mmol NH4NO3时植物生长受到限制,且生理指标不再显著变化[12-14]),每3 d浇灌1次,每盆50 mL,处理45 d。N1和N2累积施氮量分别为每50 cm2施0.018 g和0.27 g。(宁杞一号的最适氮肥用量为431~510 kg·hm-2,含氮量46%[15],即施氮量每50 cm20.10~0.12 g)。植株育苗、接种和生长均在温室中进行,温室培养环境为:温度25 ℃,相对湿度40%,光照16 h·d-1,光照强度2 000 lx。处理结束分为根、茎、叶3部分收样。
1.3.2 生物量测定 将植株挖出,剪下地上部分,洗净根系后吸干水分,分根、茎、叶三部分收样。称量时茎和叶合为地上部分进行鲜质量测定,于烘箱中70 ℃烘干至恒重后研磨成粉末。
1.3.3 菌根侵染率测定 采用台盼蓝染色法对样品根系进行染色,十字交叉法[16]测定AMF侵染率(包含丛枝、泡囊、孢子和菌丝侵染率)。
1.3.4 光合速率和叶绿素含量测定 收样前使用便携式光合仪(Li-6400,li-Cor,美国)测定叶片光合速率。用95%乙醇通过叶片冷冻后50 ℃快速浸提法[17]测定叶绿素含量。
1.3.5 氮含量测定 采用H2SO4-H2O2消解法[18]结合凯氏定氮仪测定样品全N含量,紫外分光光度法测定NO3-和NH4+含量[19]。
1.3.6 氮同化酶活性测定 采用离体法[20]测定叶片和根系硝酸还原酶(NR)活性,分光光度计法[21]测定叶片和根系谷氨酰胺合成酶(GS)活性。
1.3.7 数据处理及分析 采用SPSS 26进行数据统计分析,Duncan's法进行多重性检验。采用OriginPro9.1绘图。
2 结果与分析
2.1 施氮对AMF侵染率的影响
AMF侵染仅出现在接种处理的植株根系。N0、N1和N2处理下总侵染率分别为29.32%、43.93%和62.81%(表1)。施氮显著提高泡囊侵染率、孢子侵染率和总侵染率,且三者均随施氮量的增加而增加。孢子侵染率变化最显著,N2处理相比不施氮处理增加了217.08%。不同氮处理之间,丛枝侵染率和菌丝侵染率无显著变化。
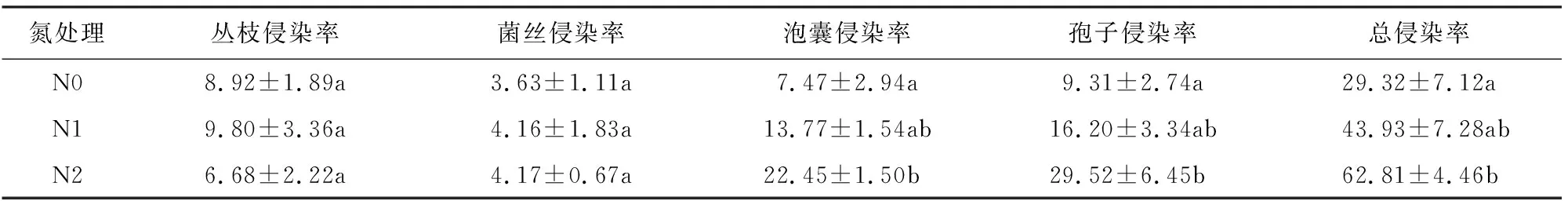
表1 施N对宁夏枸杞AMF侵染率的影响Table 1 Effect of nitrogen on AMF colonization rate of L.barbarum %
2.2 施氮和接种AMF对宁夏枸杞生长的影响
接种植株在N1和N2浓度氮处理下,地上、地下部分鲜质量及总鲜质量均显著高于不施氮植株(图1),其中N1处理下地上、地下部分鲜质量及总鲜质量分别增加32.1%、59.6%和41.51%,N2处理下地上、地下部分鲜质量及总鲜质量分别增加92.8%、34.3%和72.2%。
接种AMF显著促进植株生长尤其是根系生长。不同氮处理下接种植株地上部分鲜质量、根系鲜质量和总鲜质量均显著高于不接种植株,其中N0处理下,接种植株相较不接种植株分别增加了44.3%、170.4%和72.4%,N1处理下,三者分别增加了37.1%、137.8%和64.4%,N2处理下,三者分别增加了345.0%、206.3%和296.7%。
2.3 施氮和接种AMF对宁夏枸杞光合的影响
接种AMF显著提高宁夏枸杞叶片净光合速率和蒸腾速率。且净光合速率随施氮量升高而增加(表2)。接种植株净光合速率在N0、N1和N2处理下分别比不接种植株提高了266.5%、50.3%和491.1%,接种植株蒸腾速率在N1和N2处理下分别比不接种植株提高了47.1%和108.3%。施氮提高接种植株叶绿素b含量。AMF显著提高了叶绿素b和总叶绿素含量,其中叶绿素b含量在N0、N1和N2处理下分别提高19.0%、41.7%和62.9%,总叶绿素含量在N0和N2处理下分别提高25.4%和20.4%,叶绿素a含量仅N0处理下提高28%。
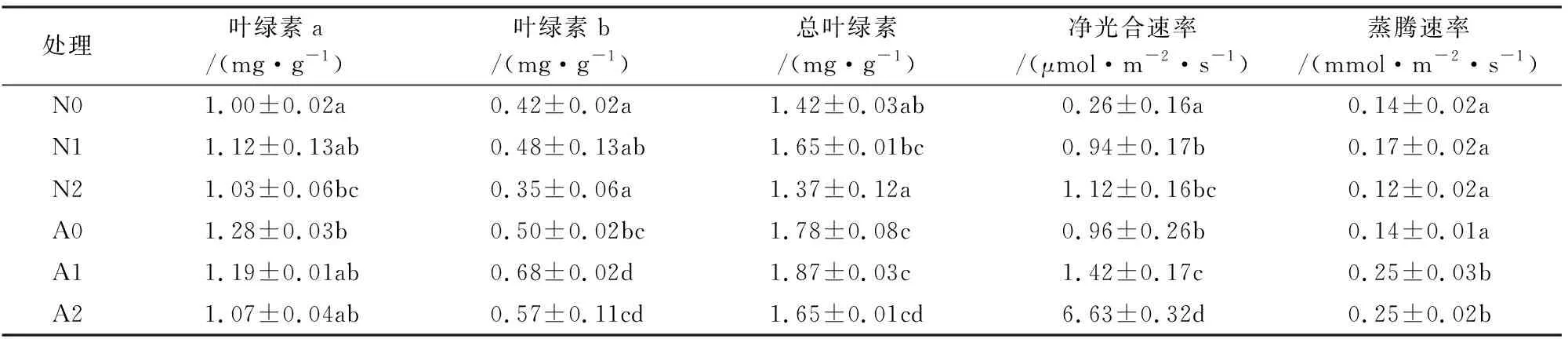
表2 不同氮处理下AMF对宁夏枸杞光合速率、蒸腾速率和叶绿素含量的影响Table 2 Effects of AMF on photosynthetic rate,transpiration rate and chlorophyll content of L.barbarum under different nitrogen treatments
2.4 施氮和接种AMF对宁夏枸杞氮含量的影响
施氮和接种AMF均显著提高叶片和根系全N含量(表3)。接种植株叶片全氮含量在N0、N1和N2处理下分别比不接种植株提高221.2%、61.6%和49.3%,根系全氮含量在N0和N2处理下分别比不接种植株提高129.8%和33.6%。
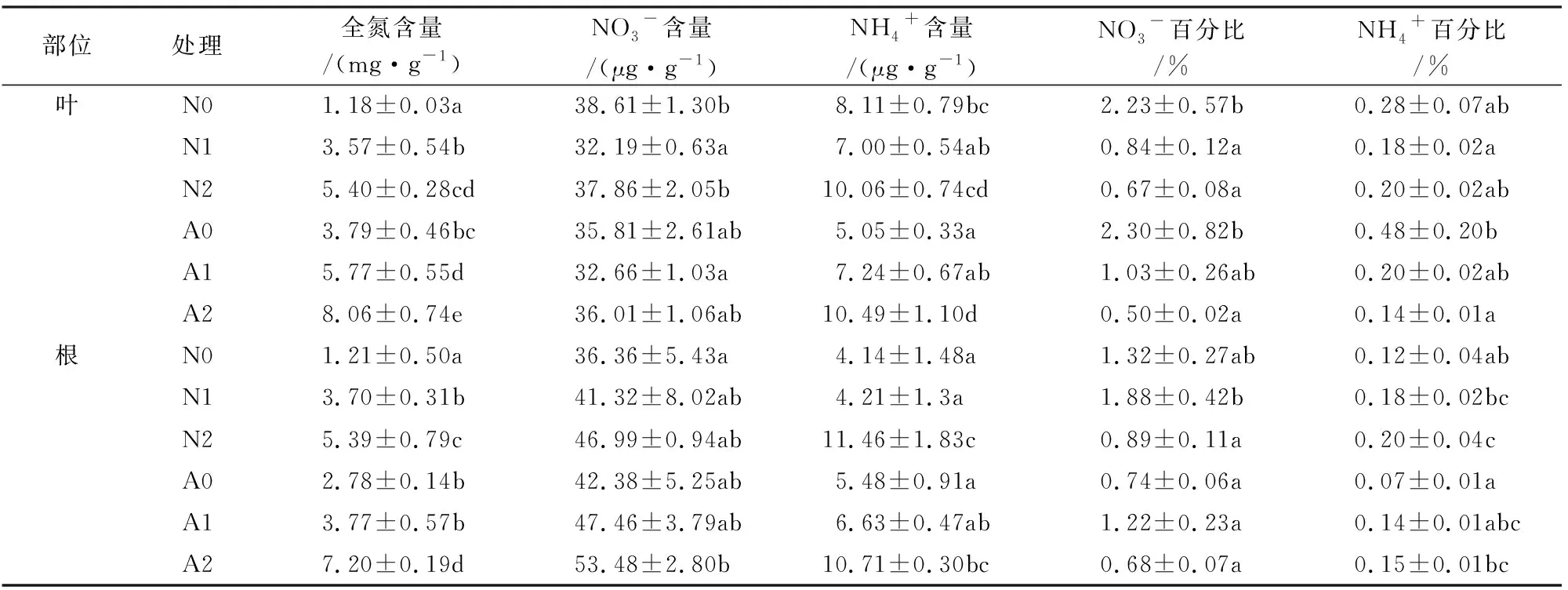
表3 不同氮处理下AMF对宁夏枸杞氮含量的影响Table 3 Effects of AMF on the nitrogen content of L.barbarum under different nitrogen treatments
施氮对宁夏枸杞NH4+和NO3-含量及其占全氮含量百分比均有显著影响。N2处理下不接种植株根系NH4+含量相比N0处理提高176.8%,根系NH4+百分比提高66.7%,叶片NO3-百分比降低68.2%;接种植株叶片和根系NH4+含量相比N0处理分别提高107.7%和95.4%,根系NH4+百分比提高114.3%,叶片NH4+百分比和NO3-百分比分别降低70.8%和66.7%;接种AMF对宁夏枸杞NO3-含量无显著影响。但N0处理下接种植株的叶片NH4+含量比不接种植株降低37.7%,N1处理下根系NO3-百分比比不接种植株降低45.2%。
2.5 施氮和接种AMF对宁夏枸杞氮同化酶活性的影响
施氮显著提高宁夏枸杞植株根系NR活性、叶片NR活性和GS活性(图2),其中根系NR和叶片GS活性均随施氮量增加而上升。N1处理下不接种植株叶片NR、根系NR和叶片GS活性相比N0处理分别提高35.5%、23.1%和62.5%;接种植株三者分别提高21.3%、15.0%和33.3%;N2处理下不接种植株根系NR和叶片GS活性相比N0处理分别提高38.1%和87.5%,接种植株二者分别提高48.6%和44.4%。
AMF显著提高宁夏枸杞植株根系NR及叶片GS活性。接种植株根系NR活性在N0和N2处理下比不接种植株分别提高15.8%和24.5%,叶片GS活性在N0、N1和N2处理下比不接种植株分别提高68.8%、38.5%和30.0%,接种植株N2处理下根系GS活性比不接种植株降低40.6%。
3 结论与讨论
AMF在促进宿主植物根系发育增强对氮素吸收的同时,通过根外菌丝吸收氮素并转运给宿主植物[22]。因此在土壤氮素充足时,接种AMF能够提高植物氮含量,保证叶片氮需求,并促进光合作用[23]。本研究表明,施氮能够提高AMF对宁夏枸杞的侵染率,且随施氮量增加而升高。虽有研究发现氮处理抑制AMF侵染[24],但本研究使用的氮处理浓度尚未达到抑制AMF生长的浓度。AMF能够提高植物光合速率并促进植物生长。刘爱荣等[25]发现接种Glomusmossea-2能够提高黄瓜叶片光合能力和生物量。袁丽环等[26]发现接种G.mosseae和Acaulosporadelicata能够提高翅果油树幼苗叶绿素含量和光利用率。Y.Bietal[27]研究发现接种Funneliformismosseae能够显著提高西伯利亚杏的生物量,净光合速率和蒸腾速率。本研究发现接种R.irregularis能够显著提高宁夏枸杞蒸腾速率、叶绿素含量、光合速率及全N含量,促进其地上和地下部分生物量的积累,与前人研究结果一致。但也有研究表明,接种R.irregularis对红地球葡萄的根系生物量和光合速率[28]、加拿大一枝黄花生物量[29]以及正常供水下刺槐光合速率[30]的影响均不显著。这可能是因为同一菌种对不同植物的促生效果不同。
多项研究发现,AMF能够缓解土壤氮素损失。T.R.Cavagnaroetal[31]研究发现,AMF能够通过拦截土壤氮素等营养防止因降雨造成的土壤养分缺失。AMF自身也能够通过根外菌丝吸收土壤中各种形态的氮素[32],并促进植物无机氮同化为不易流失的有机形式,减少氮流失[33]。本研究中,3种氮处理下接种AMF能够显著提高宁夏枸杞全氮含量,这与L.C.Jach-smithetal[34]的研究结果一致,表明N缺乏时植物更依赖AMF转运氮素,而N充足时则更倾向于根系直接吸收。陈丹明等[35]研究发现AMF能够提高牡丹叶片NR活性。Y.Khanetal[36]研究也发现AMF能够提高羊草多种氮同化酶活性,说明接种AMF有利于植物氮同化过程。本研究中接种AMF降低了宁夏枸杞植株NH4+含量,提高了植株根系NR活性及叶片GS活性,表明接种AMF能够缓解NH4+的毒害作用,且在氮同化尤其是叶片NH4+的同化方面具有促进作用。综上所述,接种AMF能够促进宁夏枸杞的生长和氮利用效率。应用AMF在促进作物生长和缓解因氮流失造成的环境污染方面都有一定意义,这对于应对目前由于氮肥使用过量引发的氮素过饱和及土地营养不均衡问题提供了解决思路。

