瓦布贝母组织培养及生物碱的测定
滕俞希, 王晶金, 陈逸菲, 彭 婕, 范维强, 唐 琳
(1.四川大学生命科学学院生物资源与生态环境教育部重点实验室, 成都 610065;2.阿坝藏族羌族自治州食品药品检验所, 阿坝 624000)
1 引 言
药材川贝母是百合科多种植物包括川贝母(Fritillariacirrhosa)、暗紫贝母(Fritillariaunibracteata)和其变种瓦布贝母(FritillariaunibracteataHsiao et K. C. Hsia var.wabuensis)等的干燥鳞茎[1].川贝母的活性成分主要有西贝母碱、贝母辛等多种甾体生物碱,具有清热润肺、化痰止咳、散结消痛的功效[2].由于川贝母生长周期长,种子休眠期长,自然萌发率低,长期被滥采滥挖等原因,川贝母资源严重匮乏.
为了解决川贝母的市场供应需求,现已进行川贝母、暗紫贝母和瓦布贝母的人工栽培和研究,经过长期的研究发现,瓦布贝母是最适合人工种植的种类,且瓦布贝母的总生物碱含量普遍高于其它基源的川贝母[3].然而,瓦布贝母的最佳采挖期为3~5年[4],栽培周期较长,人工栽培的瓦布贝母还易受到季节与地域的限制,不能在全国范围内广泛推广,因此,人工栽培不能完全有效地解决川贝母的供应难题.
组织培养技术不受季节等条件的限制,可实现短时期内迅速扩大植物的数量,获得较高的经济效益.近年来,随着组织培养技术的发展,组培药用植物的使用价值也在不断提升.Su等[5]将组培得到的瓜蒌生根苗,移至田间种植,短时间内能够收获成熟块根.研究表明,利用水仙组培技术体外合成加兰他敏(Galanthamine)被认为是可替代生产的一种方法[6]. Bhattacharyya等[7]在探究药用兰科植物繁殖的模式组织培养途径中,发现再生植株的次级代谢产物,如酚、生物碱、类黄酮等都有较高的活性水平.Zhao等[8]研究发现体外培养是批量生产用于制药业的川贝母类固醇生物碱的一种有效策略.目前,以瓦布贝母为材料进行组织培养的研究还未见报导.本研究利用组织培养体系生产再生鳞茎,提取并研究其活性成分,为川贝母药用价值研发提供资料.
2 材料与方法
2.1 材 料
瓦布贝母由四川新荷花川贝母生态药材有限公司提供,由四川大学生命科学学院唐琳教授鉴定.
2.2 方 法
2.2.1 植物材料预处理 选取瓦布贝母鲜鳞茎(3年生,直径约1.5 cm),切除根系,用自来水冲洗、去除泥污.再将鳞片剥开,用刷子轻轻刷洗,洗净泥污.去掉最外面一层腐烂、褐化的鳞片.放入洗衣粉溶液中浸泡 10~15 min,最后自来水下冲洗2 h.
2.2.2 外植体灭菌方法 取预处理后的瓦布贝母鲜鳞茎,分别选择两种消毒方式进行灭菌:
(A) 75%酒精约10 s,无菌水冲洗3次,0.1%升汞15 min,无菌水冲洗,无菌水浸泡10 min后冲洗3次,灭菌滤纸吸干.
(B) 75%乙醇浸泡约10 s ,无菌水冲洗2~3次,再用10%次氯酸钠浸泡20 min,无菌水冲洗,无菌水浸泡 10 min 后冲洗3次,灭菌滤纸吸干.
将两种方法灭菌后的鳞茎切成约0.5 cm的小块,无菌接种于MS[9]培养基中.将上述材料放4 ℃冰箱2 d,再转移至组培室培养,控制温度在22~24 ℃,光照培养,记录30 d内外植体污染率,比较得出鳞茎外植体最佳灭菌方式,A处理每次接种外植体约29块,B处理每次接种外植体约6块,实验重复3次.
污染率=(被污染的外植体数/接种的总外植
体数)×100%
2.2.3 植物激素对鳞茎外植体启动率及生长情况的影响 以MS为基本培养基,30 g/L蔗糖,8 g/L琼脂,0.1 g/L活性炭,添加不同种类和浓度的激素,pH为5.8,共配制10种培养基(见表2).配制完成后,置于高压蒸汽灭菌锅121 ℃灭菌20 min,冷却待用.将已经灭菌处理的鳞茎外植体接种至培养基进行启动诱导,每种培养基接种约25块,放置组培室培养,控制温度在22~24 ℃,每日光照16 h,光照强度2500~3500 lx.在40 d后观察瓦布贝母鳞茎外植体启动率和生长状况.实验重复3次.
2.2.4 瓦布贝母总生物碱的测定 参照药典[1],测定各样品(生长期为4个月的再生鳞茎和3年生瓦布贝母鳞茎)总生物碱含量,每组混合3个样品.本品按干燥品计算,总生物碱以西贝母碱计,不得少于0.050%.测得数据采用SPSS软件进行方差分析,按照单因素ANOVA检验判断显著性差异,显著水平0.05.
3 结果与分析
3.1 植体灭菌方法
组培30 d后,鳞茎外植体的污染状况见表1,结果显示采用B(75%酒精约10 s+10% NaClO 20 min)消毒方式处理后,污染率较高,而选择A(75%酒精约10 s+0.1%升汞15 min)消毒方式处理后,污染率低,处理效果较好.
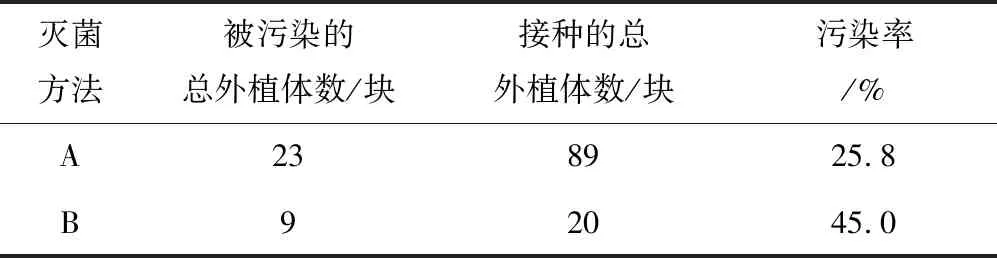
表1 两种灭菌方法处理外植体30 d污染率Tab.1 Pollution rate of explants treated by two sterilization methods for 30 d
3.2 植物激素对鳞茎外植体启动率及生长状况的影响
不同培养基条件下鳞茎外植体40 d后启动率和生长状况见表2.从表2中发现,2,4-D和NAA配合使用虽然可以诱导鳞茎外植体启动,但是在此培养基条件下鳞茎外植体的生长状态不佳,存活数量较少.NAA与6-BA配合使用有助于诱导鳞茎外植体启动或分化,但是较高浓度的NAA会抑制鳞茎外植体的生长.培养基中NAA和6-BA浓度分别控制在0.5~2 mg/L,瓦布贝母鳞茎外植体后续生长状况良好,有芽、小鳞茎和少量愈伤组织形成(见图1).

表2 不同激素对外植体启动率和生长状况的影响Tab.2 Effects of different hormones on initiation rate and growth of explants

图1 瓦布贝母外植体生长情况注:(a)~(h)分别为2号~9号培养基植物生长情况Fig.1 Growth of Fritillaria unibracteata Hsiao et K. C. Hsia var. wabuensis explantsNote:(a)~(h) are the growth of plants in medium 2~9 respectively
3.3 瓦布贝母总生物碱的测定
实验发现(见图2),不同培养条件下即随着激素浓度的改变,瓦布贝母再生鳞茎的总生物碱含量存在显著性差异,说明激素能够影响瓦布贝母鳞茎生物碱的积累.再生鳞茎中除5号和6号培养基中再生鳞茎的总生物碱含量测定值较低外,其余培养基的再生鳞茎总生物碱含量均高于2015年版中国药典的规定要求.

图2 不同培养条件瓦布贝母总生物碱含量比较(n=3)a~h表示组间有显著性差异(P<0.05)注:虚线表示药典规定“总生物碱含量不少于0.050%”Fig.2 Comparison of total alkaloid content of Fritillaria unibracteata Hsiao et K. C. Hsia var. wabuensis in different culture conditions(n=3)a~h indicates there have significant difference (P<0.05) between the groupsNote: Fictitious line indicates that pharmacopoeia stipulates “total alkaloid content is not less than 0.050%”
4 讨 论
4.1 瓦布贝母的组织培养
瓦布贝母是名贵川产道地药材川贝母的基源种[3].瓦布贝母成功引种栽培,较为有效地缓解了川贝母资源难题,然而栽培瓦布贝母的栽培时间太长[10],栽培品的产量、质量与无机盐[11]等外源环境条件也有关.因此,栽培瓦布贝母不能完全有效地解决市场矛盾.本研究希望构建有效的瓦布贝母组织培养体系,以满足生产要求.初步研究结果显示,外源激素种类、浓度和不同激素组配比能够影响外植体的生长状况,与先前研究结果一致[12],但具体激素培养方案有一定差异. 川贝母组织培养过程中易发生褐变现象,本实验采取低温预处理外植体和在培养基中添加活性炭的方法[13]来缓解此现象.后期除优化激素种类和浓度的最佳配比外,还将研究其它因素如光照、温度以及外源化合物等对组织培养物生长的影响,实现对培养条件的优化[14].
4.2 瓦布贝母再生鳞茎生物碱含量测定
生物碱是瓦布贝母重要的活性成分.本试验显示,6种组培方案的瓦布贝母总生物碱含量达到药典规定要求,说明再生鳞茎具有药用潜力.而5号和6号培养基再生鳞茎总生物碱含量较少,可能与外源激素有关,金青等[15]研究发现外源激素通过改变内源激素水平直接或间接调控生物碱积累.此外,光照[6]和外源化合物[16]等均能影响生物碱的积累,还有研究显示非生物胁迫有利于植物次生代谢物的产生[17],因此在组培过程中,可以添加多种外源因素,提高有效成分的体外产量.目前,有关瓦布贝母生物碱合成的相关酶和基因的研究资料较少,后续可开展功能基因的研究以探究调控过程.
栽培瓦布贝母鳞茎中含有多种生物碱成分[18].但相比栽培鳞茎,组培鳞茎的生物碱成分是否发生变化,还需要进一步验证.同时,如果组培鳞茎中确有增加或减少的生物碱成分,那么药物活性是否会被影响,也有待研究.后期将继续完善实验体系,为组培瓦布贝母市场化提供可能性.

