超声波辅助大孔树脂提取浅色葵花籽蛋白工艺的研究
秦那日苏,李泓颉,李雪馨,聂记记,包小兰
(内蒙古农业大学食品科学与工程学院,呼和浩特 010018)
葵花籽是我国重要的油料作物之一,目前主要用于提取油脂,提取油脂后的副产品即为葵花籽饼(粕)。葵花籽饼富含蛋白质,其蛋白质质量分数为29%~43%[1]。葵花籽蛋白的氨基酸组成较为均衡,抗营养成分和有毒物质也较少[2,3],是优质植物蛋白。由于葵花籽饼中所含的多酚类物质(主要为绿原酸)在蛋白质提取过程中在碱性条件下容易氧化,发生褐变,导致提取的蛋白质呈现深绿色或深灰色[4],其颜色难以被大众所接受。此外,天然葵花籽饼蛋白的功能特性也相对较差,这也导致其在食品加工领域中受到了很大的限制。因此,从葵花籽饼中去除多酚提取浅色葵花籽蛋白的同时改善其功能特性,是目前急需解决的问题。
大孔吸附树脂是一种有机高聚物吸附剂,具有吸附速度快、树脂再生简便和纯化能力高效等优点[5]。有研究曾报道,在弱酸性条件下,采用AB-8型大孔树脂吸附处理可以吸附脱除多酚从而提取出浅色的葵花籽蛋白,其L*值和色泽均显著改善[6]。但是,大孔树脂吸附处理对葵花籽蛋白功能特性的改善效果不明显。因此,需要通过改性的手段来改善蛋白的功能性质。本实验室在前期研究工作中发现限制性酶解结合大孔树脂处理会显著改善葵花籽蛋白的色泽和功能特性[7],但酶解改性往往会破坏蛋白质的结构和完整性。而超声改性具有易控制、安全性好、营养价值损害小等优点,且不会破坏蛋白的初级结构[8],很大程度上可以保持蛋白的完整性。因此,在前期研究工作的基础和思路上,以低温脱脂葵花籽饼为原料,研究了超声波辅助大孔树脂处理对葵花籽蛋白色泽和功能特性的影响。以期为葵花籽饼蛋白的脱色和改性方面提供参考。
1 材料与方法
1.1 材料与试剂
低温脱脂葵花籽饼,大孔吸附树脂,所用的试剂均为分析纯。
1.2 仪器与设备
CR-10型色度计,UV-2300紫外可见分光光度计,FDU-2200型冷冻干燥机,超声波细胞破碎仪。
1.3 方法
1.3.1 葵花籽饼蛋白的制备
将低温脱脂葵花籽饼磨碎成粉用60 mm筛子过筛,根据秦那日苏等[6]的碱溶酸沉法制备葵花籽饼蛋白。将获得的葵花籽蛋白储存在4 ℃冰箱。葵花籽蛋白粗蛋白质量分数(N×6.25)为85.62%,采用凯氏定氮法测定。
1.3.2 大孔树脂吸附处理的葵花籽蛋白的制备
根据秦那日苏等[6]的方法制备大孔树脂吸附处理的低多酚浅色的葵花籽饼蛋白。将获得的蛋白储存在4 ℃冰箱,蛋白质量分数为91.77%。
1.3.3 超声波辅助大孔树脂吸附处理的葵花籽蛋白的制备
称取50 g脱脂葵花籽粉,按设定料液比例加入1.3 mol/L的氯化钠溶液混合均匀后在25 ℃恒温水浴锅中搅拌1 h,用0.1 mol/L NaOH调节溶液pH至6.0,然后在恒温水浴锅中搅拌1 h,4 000 r/min离心15 min收集上清液,调节溶液pH至7.0,按设定的超声功率下超声,用不同类型大孔树脂进行吸附(10%大孔树脂,120 min)收集上清液,调节pH至等电点3.8,用30 mL蒸馏水将沉淀水洗3次,4 000 r/min离心15 min收集沉淀,用少量蒸馏水将沉淀溶解,调节pH至7.0,冷冻干燥保存备用,其蛋白质量分数为94.59%。
1.3.4 单因素实验设计
以L*值作为指标,分别考察对料液比(1∶5、1∶10、1∶15、1∶20、1∶25 g/mL)、超声功率(100、150、200、250、300 W)、超声时间(10、15、20、25、30 min)和树脂添加量(6%、8%、10%、12%、14%)4个因素对葵花籽蛋白L*值的影响。
1.3.5 正交实验设计
在单因素实验结果的基础上,采用正交软件设计实验条件,以L*值作为指标,料液比(A)、超声功率(B)、超声时间(C)、树脂添加量(D) 为自变量,设计四因素三水平的正交实验。
1.3.6 色度
使用 CR-10 色度计在 CIE-L*值颜色系统中测量葵花籽蛋白蛋白的色度,取3次测量的平均值,色度值包括L*、a*、b*值,L*的值表示亮度,L*值越高表明颜色越白,a*值与b*值表示色度,a*值为正时表示红色,b*值为正时表示黄色。
1.3.7 蛋白质得率
蛋白质得率=上清液中蛋白质质量×100%/脱脂葵花籽饼质量
1.3.8 溶解度
根据Bera等[9]的方法测定并稍作修改,配制50 mL 1 g/100 mL的蛋白溶液,在25 ℃下搅拌1 h,然后用0.1 mol/L HCl或NaOH调pH至7.0,再搅拌30 min后,4 000 r/min离心15 min,取上清液进使用凯式定氮仪进行蛋白含量的测定。通过式(1)计算溶解度。

(1)
1.3.9 乳化性(EAI)及乳化稳定性(ESI)
根据Yust等[10]的方法来测定并稍作修改,用蒸馏水配制质量浓度为1%的蛋白样品溶液,将15 mL蛋白质溶液与5 mL葵花籽油搅拌混合,在12 000 r/min的条件下均质2 min。分别在0 min和静置10 min时从容器底部取50 μL乳浊液,与5 mL(0.1%)的SDS溶液混合均匀,用紫外分光光度计在波长500 nm处0 min(A0)和10 min(A10)时测定吸光度值。按公式计算乳化性和乳化稳定性。
(2)
(3)
式中:DF为样品稀释倍数,100;C为蛋白质质量/g/mL;Φ为光程,设定为0.01;θ为乳状液的油体积分数,0.25。
1.3.10 起泡性(FC)及泡沫稳定性(FS)
根据Motoi等[11]的方法测定并稍作修改,用蒸馏水配制质量浓度为1%的蛋白质样品溶液。取50 mL样品溶液置于高速均质机内,以 12 000 r/min的转速搅打2 min。然后快速转移到100 mL 的量筒中。分别在0 min 和30 min 时记录起泡体积V0及V30。按公式计算起泡性和泡沫稳定性。
(4)
(5)
1.3.11 持水性
根据Wani等[12]的方法并稍作修改。称0.5g蛋白样品记录为m0,将样品称入离心管中,记录质量为m1,加入蒸馏水,然后漩涡混合5 min,直到样品被水饱和,室温静置30 min,4 500 r/min离心15 min后,将上清液的水去掉,称离心管质量记为m2。
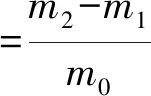
(6)
1.4 统计分析
实验均重复3次,数据采用SPSS统计软件进行数据分析,用 Origin 2017作图。
2 结果与分析
2.1 大孔树脂的筛选
由表1可知,与未处理的葵花籽蛋白相比,经不同类型的大孔树脂吸附处理后其L*值显著提高,色泽也明显改善。其中通过AB-8型大孔树脂吸附处理的脱色效果最好,其L*值达到最大值,为72.2。与单一的大孔树脂吸附处理的葵花籽蛋白相比,超声波辅助大孔树脂吸附处理的葵花籽蛋白的脱色效果更佳,其色度改善更加明显。其中超声波辅助AB-8型大孔树脂吸附处理的脱色效果最好,其L*值达到最大值为80.5,因此,选择超声波辅助AB-8型大孔树脂吸附处理进行单因素实验。
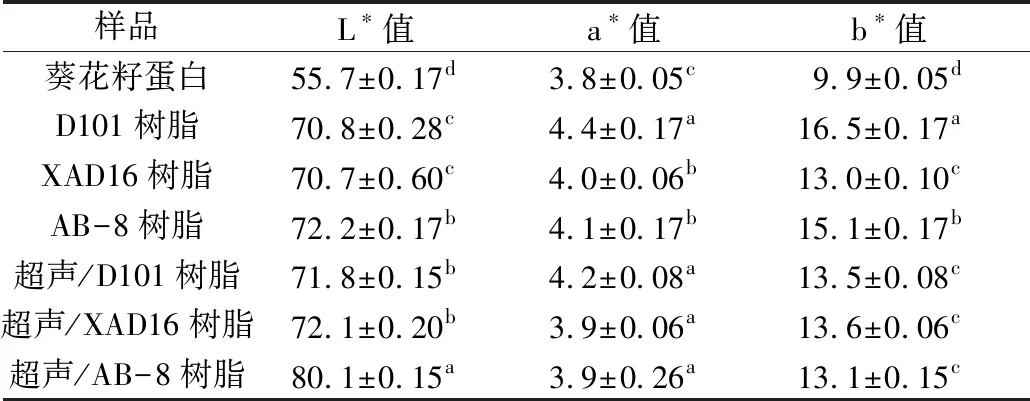
表1 不同类型大孔树脂吸附处理对葵花籽蛋白L*值的影响
2.2 单因素条件对葵花籽蛋白L*值的影响
2.2.1 料液比对葵花籽蛋白L*值的影响
由图1可知,随着料液比的增加,葵花籽蛋白的L*值逐渐提高。在料液比为1∶15 g/mL时,葵花籽蛋白的L*值达到最大值为80.53,但是随着料液比的进一步增加,葵花籽蛋白的L*值呈现先显著下降后平衡趋势。从L*值和成本角度考虑,正交实验分析时选择料液比为1∶10、1∶15、1∶20 g/mL。
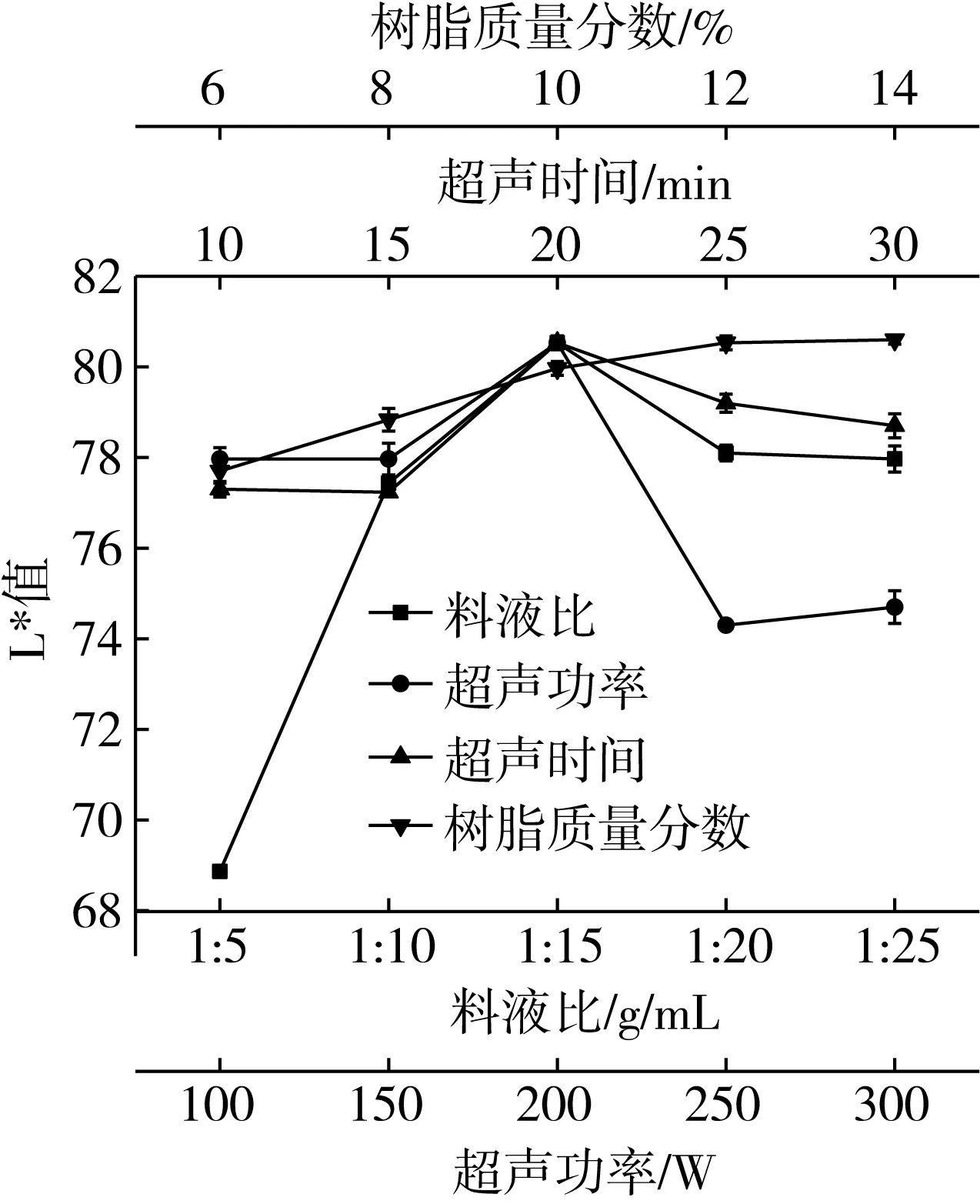
图1 不同处理对葵花籽蛋白L*值的影响
2.2.2 超声功率对葵花籽蛋白L*值的影响
由图1可知,随着超声功率的增加,葵花籽蛋白的L*值呈先平缓后显著上升的趋势。在超声功率为200 W时,葵花籽蛋白的L*值达到最大值,但是随着超声功率的进一步增加,葵花籽蛋白的L*值呈现先显著下降后平缓上升趋势。在超声功率为250 W时葵花籽蛋白L*值达到最低为74.3。因此,正交实验分析时选择超声功率为100、150、200 W。
2.2.3 超声时间对葵花籽蛋白L*值的影响
由图1可知,随着超声时间的增加,葵花籽蛋白的L*值呈现先平缓后显著上升的趋势的趋势,在超声时间为20 min时葵花籽蛋白的L*值达到最高,但随着超声时间的继续增加,葵花籽蛋白的L*值呈显著下降趋势。因此,正交实验分析时选择超声时间为20、25、30 min。
2.2.4 树脂添加量对葵花籽蛋白L*值的影响
由图1可知,随着树脂添加量的增加,葵花籽蛋白的L*值呈先增加后平衡趋势,在树脂添加量为12%时葵花籽蛋白的L*值达到最高,随着树脂添加量的继续增加,葵花籽蛋白的L*值未有显著变化,达到了平衡趋势,因此,正交实验分析时选择树脂添加量为10%、12%、14%。
2.3 正交实验结果分析
在单因素实验结果的基础上,以料液比(A)、超声功率(B)、超声时间(C)和树脂添加量(D) 为自变量,以L*值为指标,设计四因素三水平的正交实验。正交实验因素水平见表2,正交实验结果见表3。

表2 正交实验因素水平表
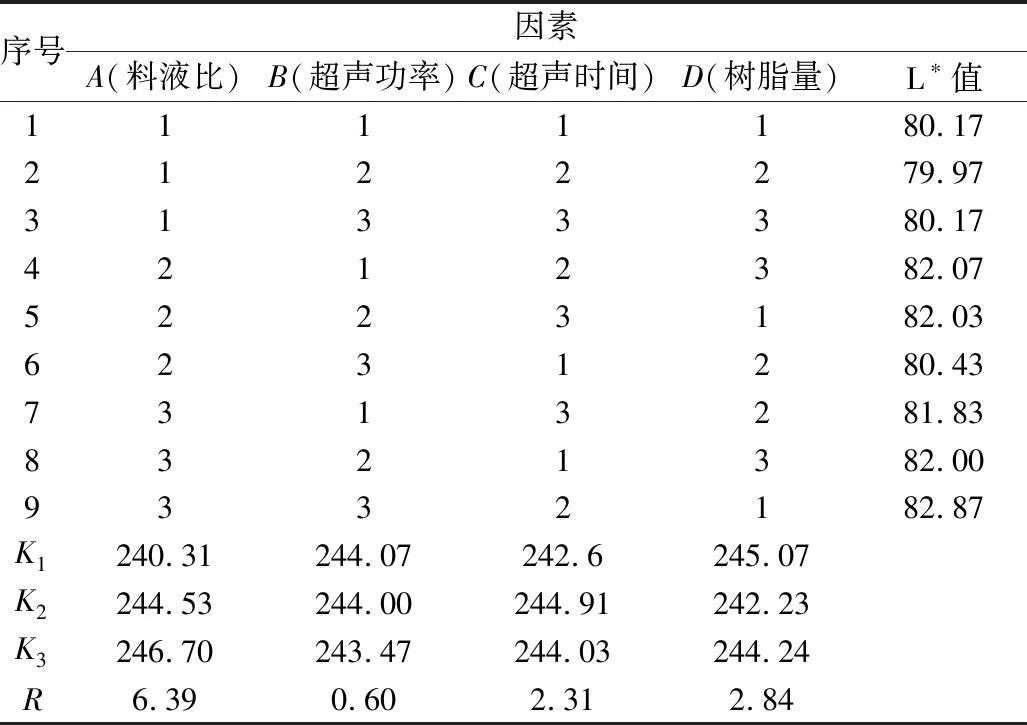
表3 正交实验方案设计及结果分析表
从表3中比较极差R值大小可知,影响葵花籽蛋白脱色效果的各因素主次顺序分别为A(料液比)>D(树脂添加量)>C(超声时间)>B(超声功率)。通过正交实验得到最佳脱色工艺条件为:料液比1∶20 g/mL、超声功率200 W、超声时间25 min、和树脂添加量10 %,在此条件下葵花籽蛋白的L*值为82.87、a*值为4.23、b*值为13.23。最优水平组合为A3B1C2D1,即料液比1∶20 g/mL、超声时间25 min、超声功率100 W 和树脂添加量10 %,在此条件下葵花籽蛋白的L*值为81.52、a*值为4.3、b*值为13.30。因此,选择正交实验的参数为最佳脱色工艺条件。超声波辅助大孔树脂处理对葵花籽蛋白色泽的影响如图2所示。
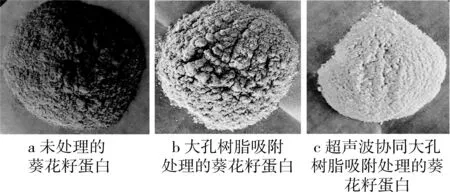
图2 超声波辅助大孔树脂处理对葵花籽蛋白色泽的影响
2.4 功能特性分析
由表4可知,未处理葵花籽蛋白的得率较低为33.6%,大孔树脂吸附处理后葵花籽蛋白的得率降低至31.2%。这可能是由于大孔树脂吸附脱除多酚的同时部分蛋白质也被吸附脱除,导致蛋白得率下降。经超声波协同大孔树脂吸附处理后葵花籽蛋白的得率提高至50.35%。这是由于超声波探针所产生的空化效应在介质中产生较高的湍流和剪切力,促使细胞壁破裂,所以蛋白溶出物就越多[13]。
未处理葵花籽蛋白的功能特性较差,这可能由于蛋白质会与多酚类化合物相互作用后的发生褐变变成苯酚,苯酚很容易暴露在空气中被氧化成醌类物质,从而影响其功能特性[1]。经大孔树脂吸附处理和超声波辅助大孔树脂吸附处理后葵花籽蛋白的功能特性都显著改善(P<0.05)。有研究报道,多酚物质被脱除后葵花籽蛋白的溶解性、起泡性、乳化性和持水性均显著提升[1,14,15]。超声波探针所产生的空化效应在介质中产生较高的湍流和剪切力会破坏蛋白质结构,蛋白质与水的相互作用增强,可溶性蛋白含量增加,从而使蛋白质溶解度增强[16,17]。蛋白结构被破坏之后,埋藏在分子内部的疏水基团和亲水基团数量发生变化,使蛋白质更易在空气和水的界面上展开,从而使乳化性、起泡性和持水性增强[18-20]。泡沫稳定性的降低可能与超声波的空化效应产生的小分子蛋白没有足够的强度来维持泡沫的稳定有关。
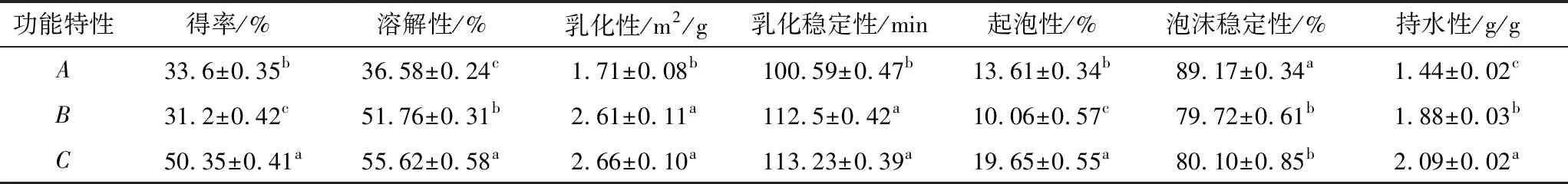
表4 超声波协同大孔树脂吸附处理对葵花籽蛋白功能特性的影响
3 结论
大孔树脂筛选结果表明,超声波辅助AB-8大孔树脂吸附处理后葵花籽蛋白的脱色效果最佳,其L*值为80.10、a*值为3.9、b*值为13.1。通过单因素实验和正交实验进行优化,得到制备浅色葵花籽蛋白的最佳工艺条件为:料液比1∶20 g/mL、超声时间25 min、超声功率200 W 和树脂质量分数10%,在此条件下制备的葵花籽蛋白的L*值高达82.87,与未处理的葵花籽蛋白相比提高了32.79%。超声波辅助大孔树脂吸附处理后葵花籽蛋白的得率、溶解性、乳化性、乳化稳定性、起泡性和持水性均显著改善(P<0.05),分别提高了33.27%、19.04%、0.95 m2/g、0.73 min、6.04%、0.65 g/g。超声波辅助AB-8型大孔树脂吸附处理的方法不仅可以改善葵花籽蛋白的色泽,还能显著提高得率和功能特性(P<0.05)。

