金松酸对HepG2细胞中甘油三酯蓄积的影响
温思思,陆元超,丁 珏,余宁翔,聂小华,孟祥河
(浙江工业大学食品科学与工程学院,杭州 310014)
肥胖已成为中国亟需重视的大众健康问题,2015年至2019年期间,17岁以下青少年肥胖率为11.5%,成人肥胖率为16.4%[1]。肥胖通常是由于能量的摄入、消耗以及储存之间的不平衡造成的。节食、药物甚至手术是常见的减肥方式,但这些方法都有一定的弊端,比如节食难以长期坚持并可能导致认知功能损伤、药物通常副作用明显、手术则风险性较高[2]。因此,开发有效的减肥食品具有明显的安全优势。香榧是我国药食同源的食物[3],据报道香榧油具有一定降脂功效[4],有可能满足减肥食品开发的需求。
香榧(T.grandis)是一种常绿树种,主要分布于中国亚热带丘陵地区,例如浙江、福建、安徽等地[5],其种子作为名贵坚果在中国已有近千年食用历史。然而,目前香榧仍以休闲坚果形式食用为主,深加工产品极其缺乏,严重制约了香榧产业的可持续发展。香榧仁油脂丰富,质量分数在40%~65%[6],且富含维生素E、角鲨烯等天然生物活性物质,具有抗炎[7]、抗肿瘤[8]等诸多生理作用。香榧油中,尤其值得关注的是独特的Δ5多亚甲基间隔不饱和脂肪酸,金松酸(SA)[9]。Endo等[10]给大鼠分别饲喂等量含有10%香榧油(含有10.93% SA)、玉米油和大豆油的饲料,发现香榧油组大鼠血浆和肝脏中甘油三酯(TG)含量最低,比玉米油组低37.14%和53.33%。随后该实验组给大鼠分别投喂等量含有不同质量分数SA(0、5%、10%)的玉米油的饲料(其中玉米油占饲料的10%);结果发现,10% SA组大鼠血浆和肝脏中TG含量分别比空白组低27.27%和52.94%[11],但SA具体降脂机制没有涉及。SA对TG代谢(脂类合成、分解途径)的影响也不清楚。
脂质代谢研究中常用的细胞模型有大鼠BRL肝细胞、人L02肝细胞和人HepG2肝癌细胞。BRL肝细胞经脂肪酸诱导后TG升高不明显;L02肝细胞通过脂肪酸诱导的高脂模型接近于临床的肝细胞脂肪变性状态。而HepG2肝癌细胞虽然为癌症细胞,但其拥有与正常肝细胞一样的糖、脂代谢功能,最大的优点是状态稳定、易培养,且用油酸进行诱导后,细胞内油脂积累明显,容易形成脂滴,利于降脂实验的表观观察。所以,本研究选择该细胞作为实验对象。
鉴于前人的研究结果及SA Δ5多亚甲基间隔的特殊结构[12],假设SA摄入后可能会影响脂肪酸合成、脂肪酸氧化以及TG代谢相关基因的表达,从而间接影响TG的蓄积。研究表明OA能够显著上调脂质合成代谢、抑制分解代谢[13]。因此本研究以油酸(Oleic acid,OA)为“阳性”对照,采用HepG2细胞模型,探讨不同SA替代量对TG蓄积的影响,并结合RT-qPCR技术分析SA对TG代谢关键基因表达的调节作用,以解明SA对TG蓄积的影响,为今后以SA为功能因子的健康食品开发提供参考。
1 材料与方法
1.1 材料与试剂
HepG2细胞,购自中国培养物保藏中心。
DMEM培养基、磷酸缓冲盐溶液、胎牛血清、二甲基亚砜、噻唑蓝、胰酶消化液、双抗(含100 U/mL青霉素和100 mg/mL链霉素)、油红O干粉、TG浓度测定试剂盒。其他试剂均为分析纯。
1.2 仪器与设备
CKX41倒置显微镜,ACB-4A1超净工作台,QB-9001台式振荡器,TDL-60B/16B离心机,MDF-U32V超低温冰箱,Power Wave XS酶标仪,3111二氧化碳培养箱。
1.3 方法
1.3.1 香榧油以及SA的制备
1.3.1.1 气流膨化预处理水酶法制备香榧油。
去壳的香榧仁在气流膨化机中进行气流膨化,在罐内压力升到5个大气压后,释放压力,进行气流膨化制得质地酥松的香榧仁。香榧仁进行粉碎后,在料液比1∶5、pH 9.5、碱性蛋白酶质量分数0.8%、酶解温度45 ℃的条件下,酶解4 h。结束后,8 000r/min条件下,离心20 min后,收集上层清油,得到香榧油(其中金松酸质量占总脂肪酸的7.76%)。将收集的香榧油放置在棕色玻璃瓶中,-80 ℃冰箱保存。
1.3.1.2 SA的制备
将香榧油∶95%乙醇∶Lipozyme TL IM固定化酶以1∶2∶0.5的质量比在37 ℃下搅拌反应5 h后得到脂肪酸乙酯。将30 g尿素与200 mL 95%乙醇进行混合,在70 ℃下磁力搅拌并回流至溶解;而后加入10 g脂肪酸乙酯,继续回流2 h。反应结束后在 4 ℃冰箱中放置12 h进行包合。结晶后的混合物趁冷过滤,滤液转移至分液漏斗,加入等体积的正己烷重复萃取两次,合并萃取液,旋转蒸发去除有机相后得到富集后的产物(其中金松酸为60.98%)。
将硝酸银溶解于90%的甲醇溶液后,与硅胶混匀,在暗处放置30 min。银化硅胶置于100 ℃干燥,在使用前于130 ℃下活化1 h。用正己烷/乙酸乙酯(95∶5)的洗脱剂以1 mL/min的流速洗脱。通过银离子柱层析获得SA纯品(>99%)。制得的高纯度金松酸在-80 ℃冰箱中保存。
1.3.2 细胞培养
HepG2细胞培养于DMEM完全培养基中(DMEM中添加了10%(体积分数,下同)胎牛血清和1%双抗),在37 ℃和5% CO2恒温恒湿的环境下培养。每2~3 d可传代1次,待细胞长满后,分别接种到实验所需的平板中进行实验。
1.3.3 MTT 法检测细胞存活率
将SA配置成200 mmol/L的母液置于4 ℃条件下备用,随后用DMEM基础培养基稀释至对应的实验浓度。将细胞接种于96孔板中(约1万个/孔),分别加入含有不同浓度SA(100、300、500、700μmol/L)和OA(100、250、500、750 μmol/L)的培养液,在37 ℃下培养24 h,每个浓度3个平行实验组。随后,每孔加入5 mg/mL的MTT溶液10 μL,37 ℃培养4 h;结束后移除上清液并在每孔加入二甲基亚砜150 μL,振荡10 min;最后测定490 nm处的吸光度值(Optical density,OD)[14]。确定OA和SA的临界安全浓度。
1.3.4 细胞内脂滴蓄积情况的观察
将HepG2细胞接种于24孔板中,待细胞生长到70%~80%时,换用含不同脂肪酸组成(脂肪酸总添加量为500 μmol/L,用不同浓度的SA替换OA)的培养液继续培养24 h,每个浓度3个平行实验组;接下来,细胞用油红O染料染色后在显微镜下进行形态学观察。观察拍照结束后,用60%异丙醇溶解脂滴吸附的油红染料,测定在490 nm处的OD值,并以OA组为对照,计算相对脂质积累量[15]。
1.3.5 细胞内脂滴蓄积量的检测
采用GPO-PAP法试剂盒定量测定细胞中的TG含量。首先,将HepG2细胞接种于12孔板中,分别用含有不同脂肪酸组成的培养液培养处理24 h;然后,每孔加1 mL细胞裂解液裂解细胞后,根据试剂盒中步骤进行操作;最后,用酶标仪于510 nm波长处测定OD值用以计算每孔中的TG含量。同时用BCA试剂盒测定蛋白浓度。
1.3.6 RT-qPCR 实验
将细胞(约25万个/mL)接种于6孔板中,每孔2 mL,待细胞呈指数增长时,按实验分组处理细胞24 h,弃掉旧培养基。采用RT-qPCR法检测细胞内与脂质代谢相关基因的表达[16]。用Trizol提取细胞内的RNA,并使用cDNA试剂盒将RNA逆转录为cDNA。按照ChamQ Universal SYBR qPCR Master mix试剂盒的方法,依次加入cDNA、上游引物、下游引物(引物序列如表1所示)和ChamQ Universal SYBR qPCR Master mix试剂;然后在Bio-Rad CFX-96上进行RT-qPCR反应:将 PCR 管在95 ℃下孵育5 min;在95 ℃下持续5 s,在60 ℃下持续31 s,作为一个循环,进行40个扩增循环。
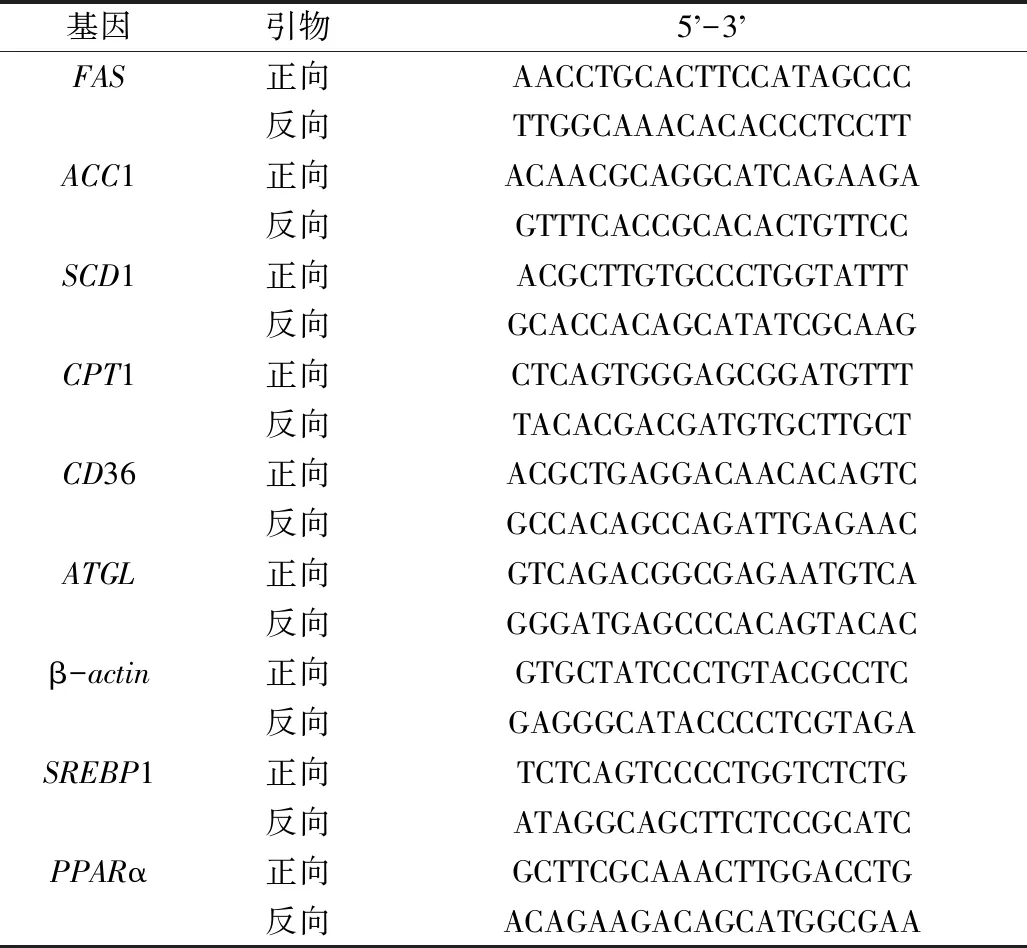
表1 实时荧光定量PCR引物
1.4 数据分析
使用GraphPad Prism 8.0.2软件通过One-way ANOVA检验,进行显著性分析,每个实验重复3次以上,数据表示为平均值±标准偏差。
2 结果与讨论
2.1 添加不同浓度OA和SA后HepG2细胞的存活率
为选择合适的脂肪酸临界安全浓度,用MTT法检测不同浓度OA和SA作用24 h后HepG2细胞的存活率,结果如图1所示。当OA的浓度低于500 μmol/L时,HepG2细胞的存活率几乎不随OA浓度的增大而改变;当OA的浓度大于500 μmol/L时,随着OA浓度的增加,HepG2细胞存活率呈下降趋势,750 μmol/L OA处理后的细胞存活率下降至49.41%。可见,高浓度OA会降低HepG2细胞的存活率。因此,本研究选择500 μmol/L OA作为后续实验浓度。
当细胞暴露于SA时,随着SA浓度的增加,其存活率基本没有变化。由此可见,SA不会剂量依赖性地降低HepG2细胞的存活率。为对比供给SA和OA后HepG2细胞TG的蓄积情况,后续实验将脂肪酸的总添加量固定为500 μmol/L,用不同浓度SA替代OA(SA替换量从0%到100%),培养24 h,测定HepG2细胞TG代谢相关指标。
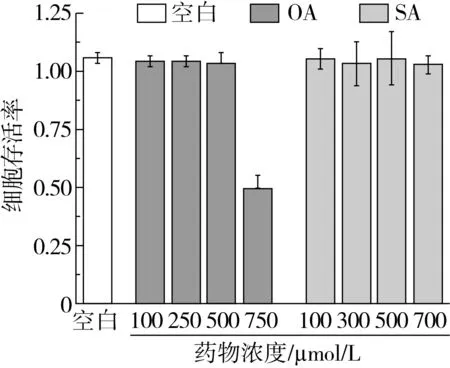
图1 OA和SA对HepG2细胞存活率的影响(n=3)
2.2 SA对HepG2细胞内TG蓄积的影响
油红染色法是观察细胞内脂滴状态常用的方法。本研究通过油红染色法观察了SA对HepG2细胞内TG蓄积情况的影响,结果如图2所示。当500 μmol/L OA作用于细胞时,细胞内聚集大量的红色脂滴,在40倍放大倍数下,细胞呈现红色不透明状(图2)。随着SA替换量增加(从0%增加到100%),细胞内红色脂滴越来越少,细胞内红色逐渐变少,颜色变浅(图2),说明细胞TG蓄积逐渐减少,最终减少了33.0%(图3)。
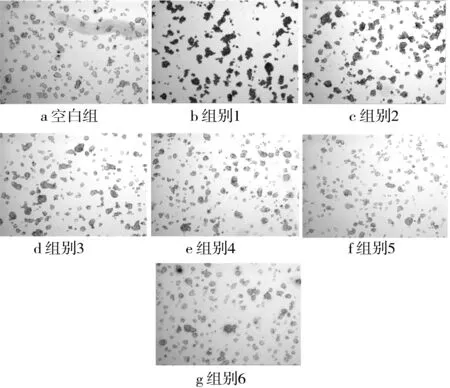
注:图中组别1为OA(500 μmol/L)、组别2为SA(100μmol/L)/OA(400 μmol/L)、组别3为SA(200 μmol/L)/OA(300 μmol/L)、组别4为SA(300 μmol/L)/OA(200 μmol/L)、组别5为SA(400 μmol/L)/OA(100 μmol/L)、组别6为SA(500 μmol/L)。余同。图2 油红染色图(40×)
与油红染色结果一致,TG试剂盒定量结果表明(图4),OA组(0.033 mmol/g)脂质积累量是空白组(0.017 mmol/g)的2倍;随着SA替换量的增加(从0%增加到100%),HepG2细胞内TG的蓄积程度降低,TG从0.033 mmol/g减低到0.017 mmol/g。结果表明,与OA相比,SA作用于HepG2细胞24 h后,细胞内TG的蓄积程度较少。
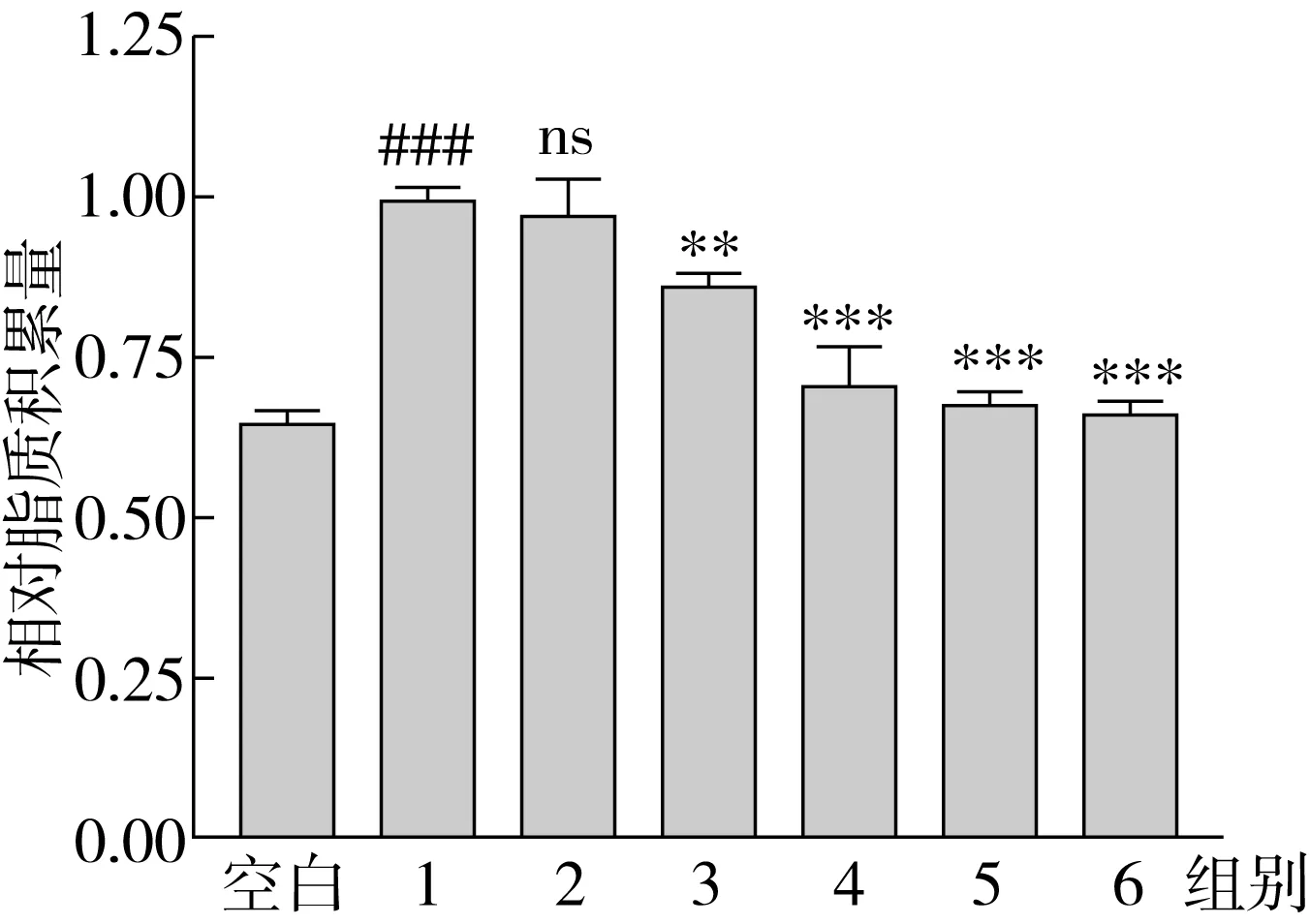
注:n=3,#P<0.05,###P<0.001, #### P<0.0001 vs空白组,*P<0.05,**P<0.01,*** P<0.001和****P<0.000 1 vs组别1。图3 用异丙醇处理染色后的HepG2细胞,用OD 490 nm处的吸光度测定脂质积聚
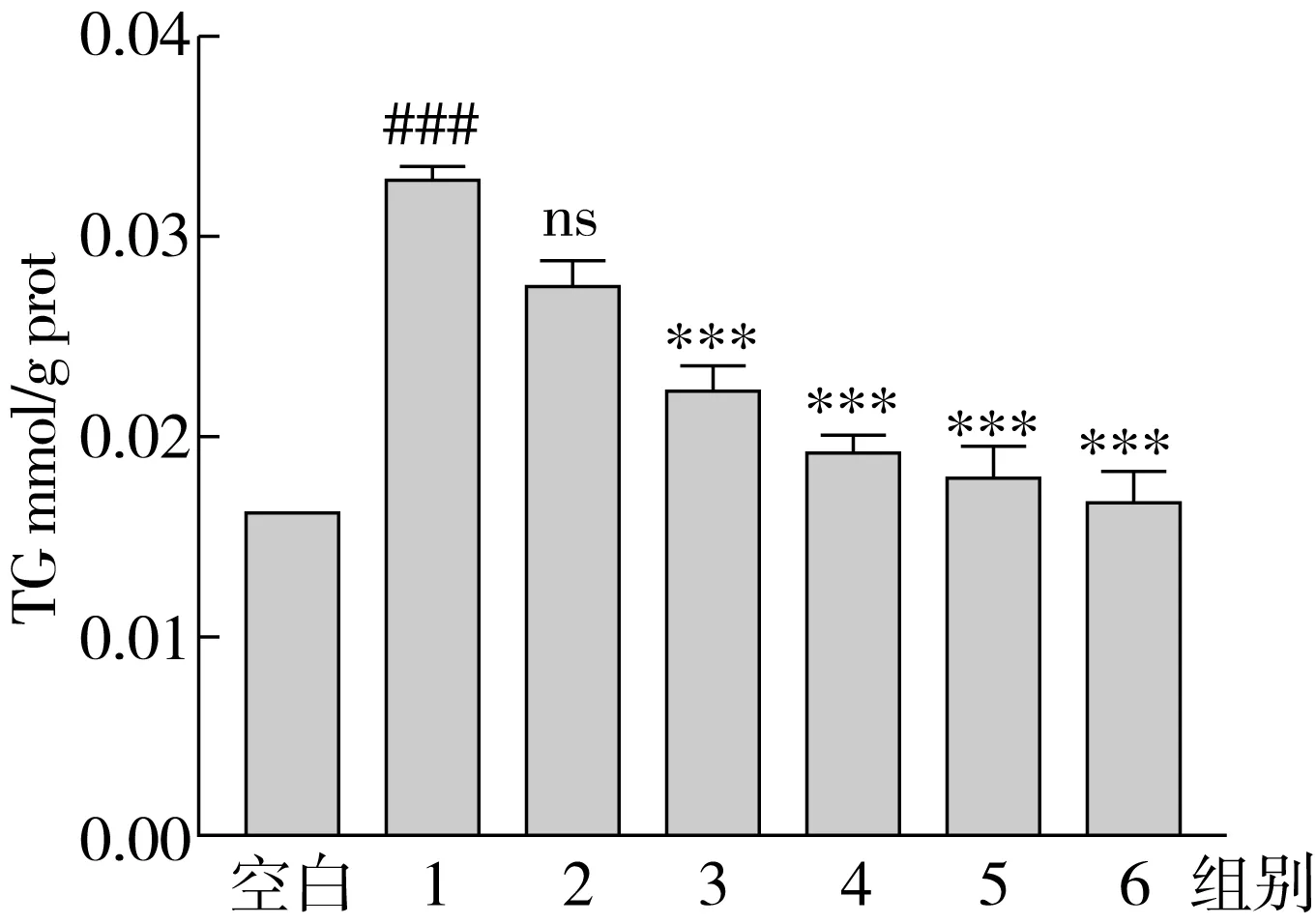
图4 TG试剂盒测定细胞中的TG含量
2.3 SA对HepG2细胞内脂质代谢关键基因的表达的影响
参与脂肪酸合成、脂肪酸β-氧化、脂肪酸转运、TG代谢的关键限速酶或转录因子有9种:硬脂酰辅酶A去饱和酶1(Stearoyl-coA desaturase 1,SCDl)、乙酰辅酶A羧化酶1(Acetyl-coA carboxylase 1,ACC1)、脂肪酸合成酶(Fatty acid synthase,FAS)、肉碱棕榈酰基转移酶1(Camitine palmitoyltransferase 1,CPT1)、CD36(Cluster of differentiation 36)、脂肪甘油三酯脂肪酶(Adipose triglyceride lipase,ATGL)、胆固醇调节元件结合蛋白1(Sterol-regulatory element binding proteins 1,SREBP1)和过氧化物酶体增殖物激活受体α(Peroxisome proliferators-activated receptor α,PPARα)[17]。因此,本研究以β-actin作为内参基因,通过RT-qPCR技术测定了不同实验组HepG2细胞内上述相关基因的表达情况,从而探究SA对HepG2细胞内脂质代谢关键基因的表达的影响。
2.3.1 脂肪酸合成关键基因的表达情况
ACC1、SCD1、FAS是脂肪酸从头合成途径中的关键限速酶,SREBP1是调节这些合成酶表达的重要核转录因子。因此,本研究测定了不同实验组中,上述4种相关基因的表达情况,表达结果如图5所示。结果表明:OA处理组细胞内ACC1、FAS、SCD1、SREBP1的基因表达水平显著高于空白组,分别为空白组的3.29、1.87、1.21、1.95倍;与OA处理组相比,随着SA替换量的增加(从0%增加到100%),ACC1、SCD1、FAS和SREBP1的基因表达水平呈现降低趋势,最终分别降低了62.01%、40.92%、25.56%和43.79%。
ACC是脂肪酸从头合成途径的限速酶,可以控制脂肪酸的合成[18]。ACC能够催化乙酰辅酶A形成丙酰辅酶A,而丙酰辅酶A可以作为长链脂肪酸从头合成的重要碳来源,合成的长链脂肪酸可以进一步作为原料合成TG[19]。同时丙酰辅酶A能抑制CPT1的表达,是脂肪酸氧化代谢过程的抑制剂[20]。FAS是脂肪合成中的另一限速酶,可以控制脂肪酸的合成[21]。在哺乳动物中,FAS位于细胞的胞浆中,是由多种酶形成的复合体,它能以乙酰辅酶A和脂肪酰辅酶A为原料,合成长链饱和脂肪酸。SCD1是形成单不饱和脂肪酸过程中的重要酶,主要起到Δ9去饱和的作用,将饱和脂肪酸转化为单不饱和脂肪酸[22]。
SREBP1主要控制TG的合成,并且调节ACC、FAS、SCD1的表达水平[23-25]。SREBP的N端形式(成熟形式SREBP1)易位到细胞核内,并促进脂肪酸合成基因的表达[26]。SREBP1 siRNA转染肝细胞,即沉默SREBP1的表达后,FAS的表达水平下调,脂质堆积显著减少[27]。
RT-qPCR结果表明,添加等量脂肪酸的情况下,随着SA替换量的增加,HepG2细胞内脂肪酸合成基因的表达程度降低,减少从头合成途径产生的脂肪酸,从而一定程度上避免TG蓄积。
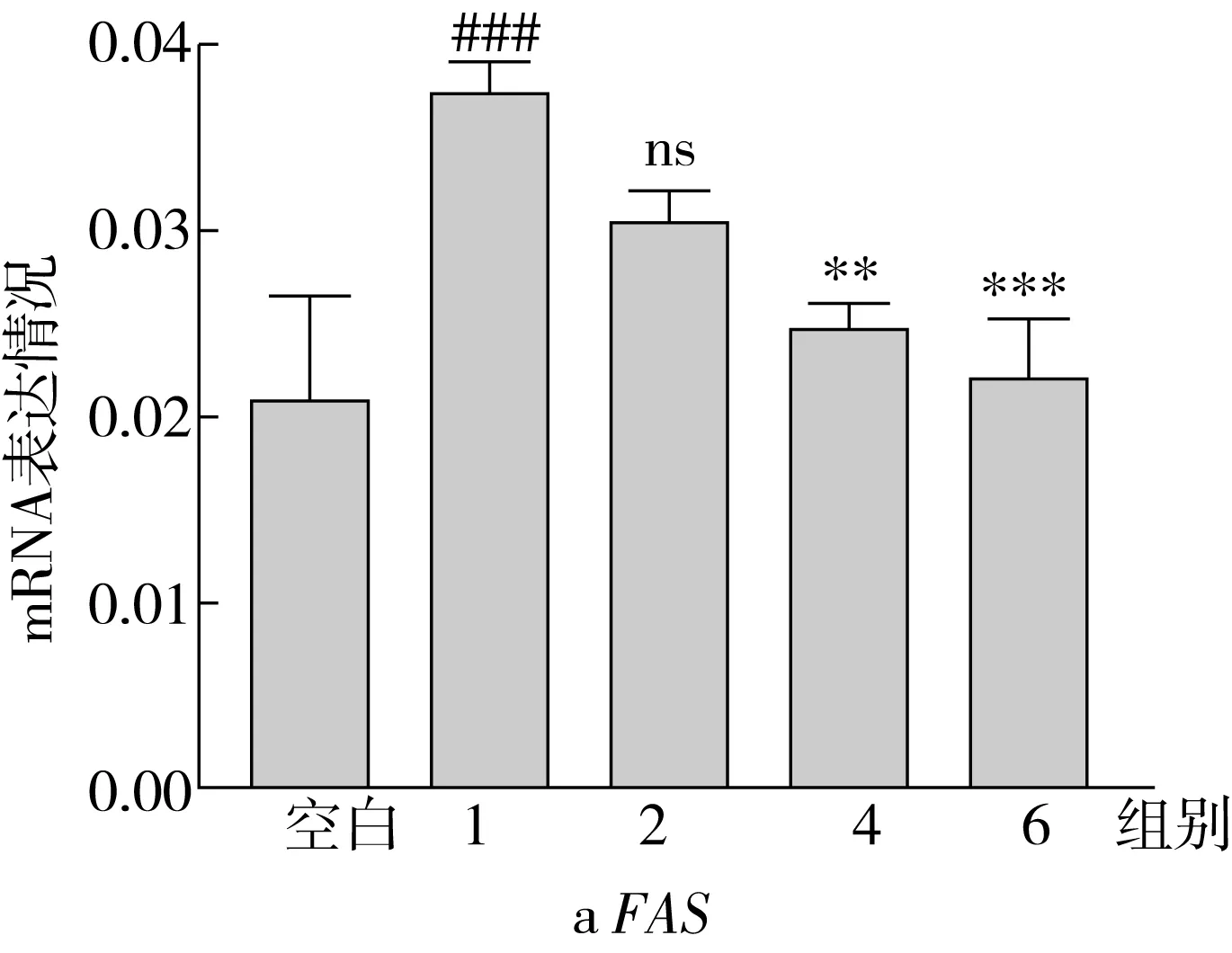
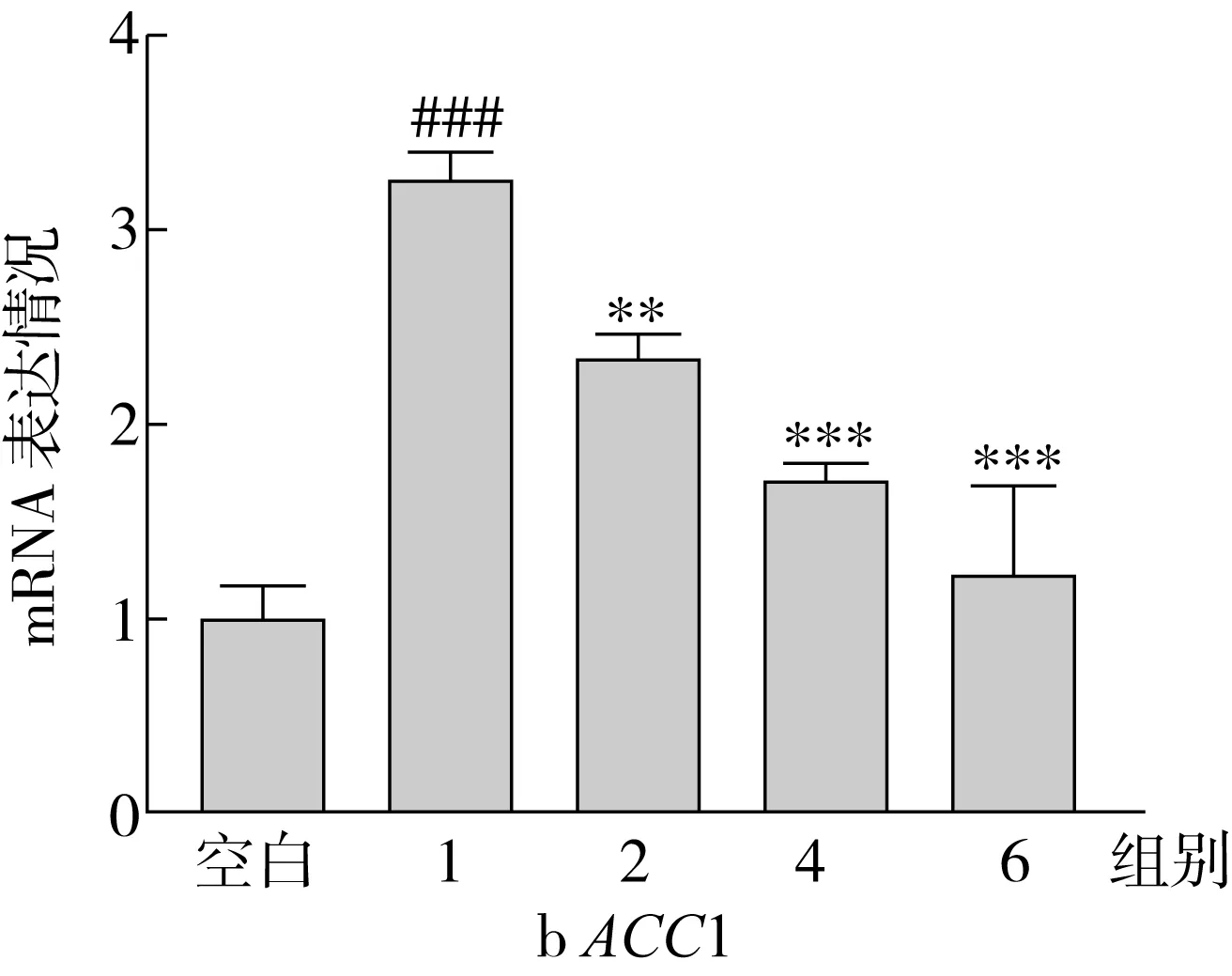
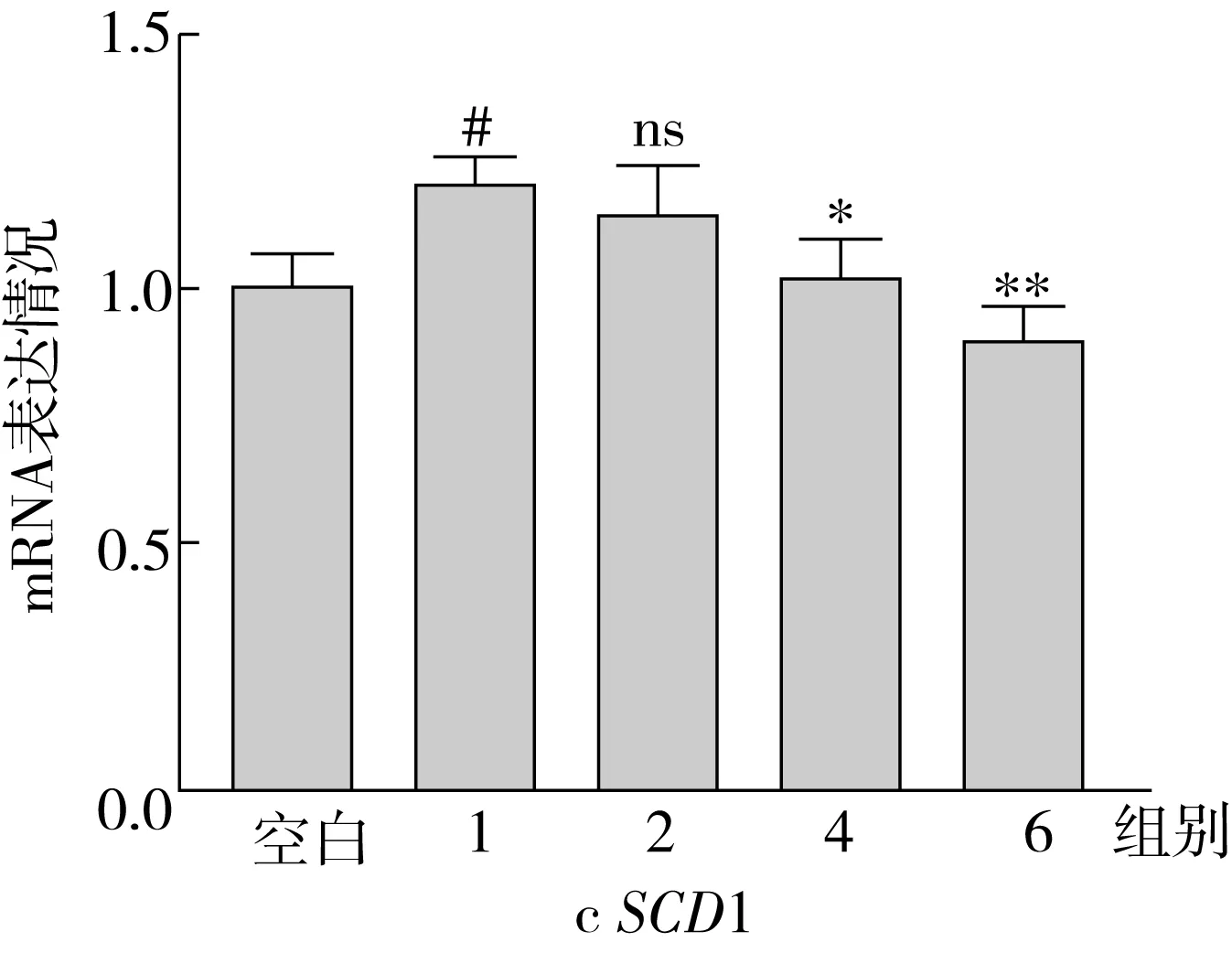
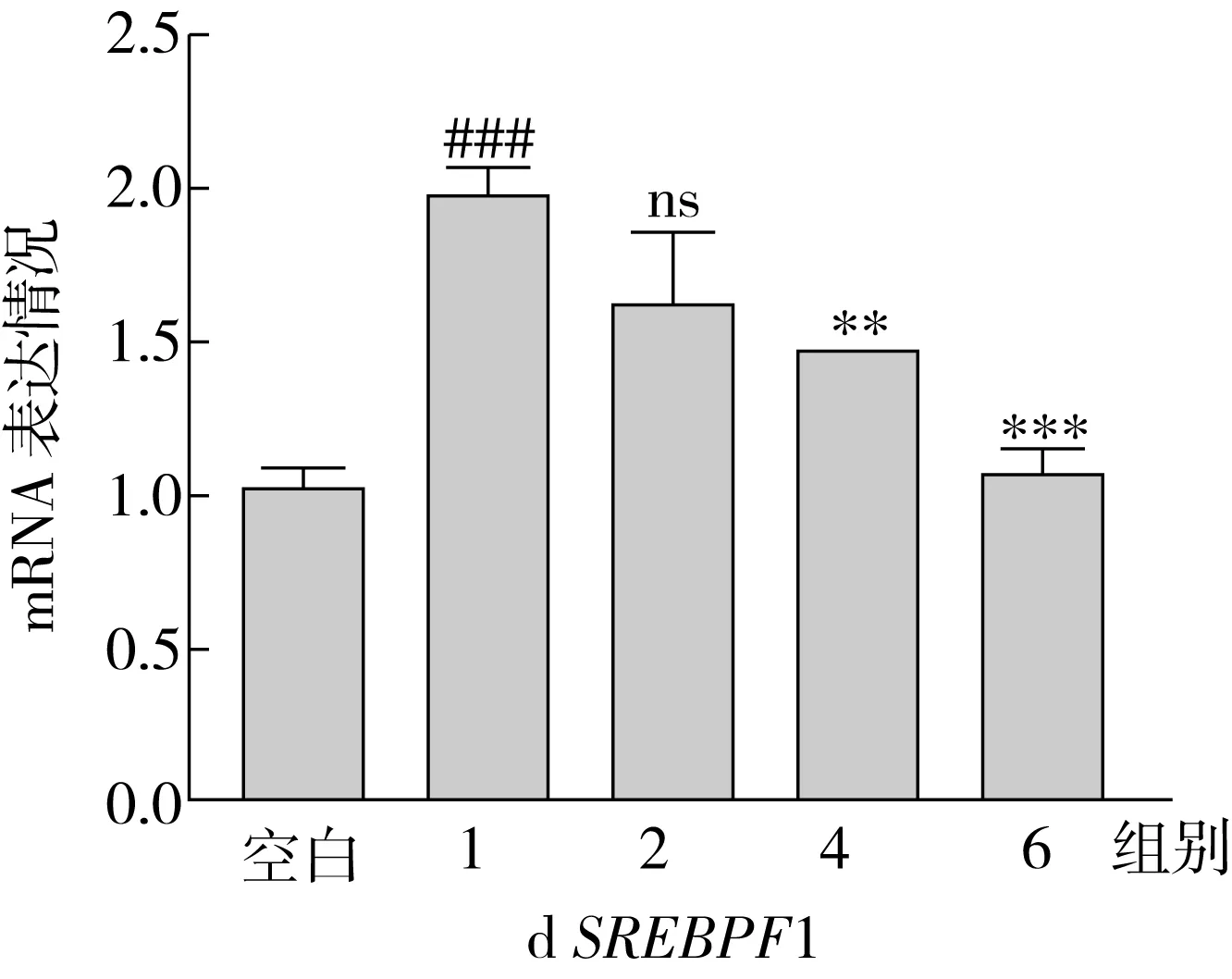
图5 HepG2 细胞中的脂肪酸合成相关基因表达
2.3.2 脂肪酸氧化和摄取关键基因的表达情况
CPT1是脂肪酸β-氧化过程中的关键限速酶,而PPARα作为一种转录因子能够控制CPT1的表达;CD36是重要的跨膜蛋白,参与脂肪酸的转运。因此,本研究测定了不同实验组中相关基因的表达情况,表达结果如图6所示。结果表明:OA处理组细胞内CPT1和PPARα的基因表达水平显著低于空白组,相较于空白组的比值分别为0.63和0.32;与OA处理组相比,随着SA替换量的增加(从0%增加到100%),CPT1、PPARα的基因表达水平均增加,最终分别增加了143.94%、445.11%;此外,CD36的表达水平随着SA替换量的增大呈上升趋势,最终比OA组升高了38.59%。

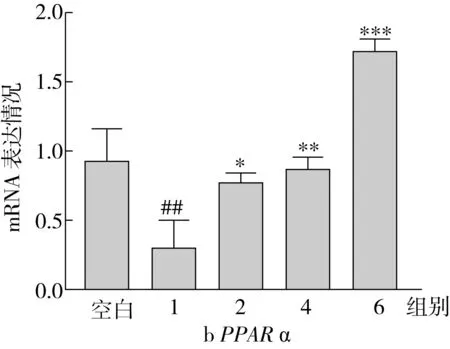
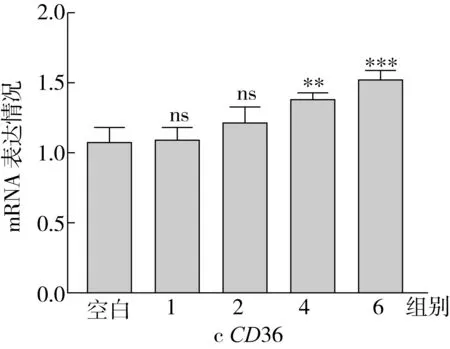
图6 HepG2细胞中的脂肪酸摄取和氧化相关基因表达
CPT1是一种载脂蛋白,可以将脂肪酸运送到线粒体内进行β-氧化[28],其活性受丙酰辅酶A影响。本研究发现,在SA作用下,CPT1催化长链脂酰辅酶A进入线粒体内进行β-氧化,从而使HepG2细胞中脂类分解代谢过程加快,TG蓄积减少。PPAR是配体活化的受体超家族,是一种核转录因子。PPARα是过氧化物酶体增殖物激活受体的一种亚型,能够促进CPT1的表达[29],从而调节脂肪酸的氧化[30]。CD36是肝细胞中重要的跨膜蛋白,是脂肪酸转运体,参与促进极低密度脂蛋白和长链游离脂肪酸的摄取。
因此,RT-qPCR结果表明,SA能显著增加HepG2细胞中脂肪酸氧化基因的表达水平,促进自身合成和外界摄取得到的脂肪酸进行β-氧化,从而使得细胞内TG蓄积程度降低。
2.3.3 TG合成与分解关键基因的表达情况
ATGL能够特异性水解TG,是TG分解中的限速酶。因此,本研究测定了不同实验组中,ATGL基因表达情况,表达结果如图7所示。结果表明:OA处理组细胞内ATGL的基因表达情况表达与正常组没有显著性差异;与OA组相比,随着SA替换量的增加(从0增加到100%),ATGL的基因表达水平显著增加,并呈剂量依赖性,最终增加了123.71%。
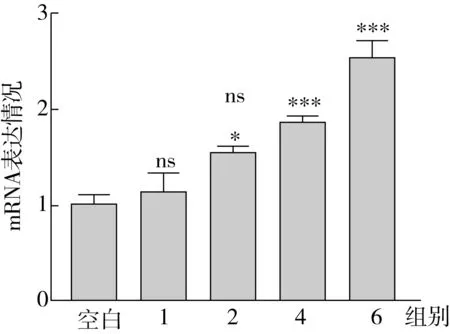
图7 HepG2 细胞中的TG合成相关基因表达
ATGL是近年来研究发现的启动脂肪动员的又一关键脂肪酶。ATGL能特异性地水解TG,是TG分解代谢的限速酶。ATGL在各组织的脂代谢过程中都起到重要作用,其介导的脂解过程与许多代谢疾病存在关联,如肥胖、糖尿病、脂肪肝等[31]。TG可以被ATGL分解成二酰甘油和一个游离脂肪酸分子,而二酰甘油通过磷酸化的激素敏感性甘油三酯脂肪酶可以进一步分解成单酰甘油和一个游离脂肪酸分子[32]。
RT-qPCR结果表明,SA作用HepG2细胞后,能显著增加TG分解关键基因的表达,促进TG的分解,从而降低了细胞内TG蓄积。
3 结论
添加等量脂肪酸的情况下,随着SA替换量的增加,HepG2细胞内TG的蓄积程度减少。其作用机制通过的途径为:SA能抑制脂肪合成酶(FAS、ACC1、SCD1)的过度表达,减少细胞内通过从头合成途径产生的脂肪酸,从而减少细胞内TG的合成代谢;SA能促进脂肪氧化(CPT1)和TG的分解(ATGL)关键酶的表达,从而增加细胞内TG的分解代谢。总的来说,SA通过促进TG分解代谢同时抑制TG合成代谢,使得HepG2细胞内TG蓄积减少。因此SA在健康食品开发方面具有良好的前景。

