2021年北京市野生天鹅死亡案例的诊断及其H5N8禽流感病毒的遗传变异分析
吴 迪 , 张启龙 , 马志军 , 韦海涛 , 徐发荣 , 李 扬 , 高晓龙 , 王 培 , 程汝佳 , 王慧强 , 刘晓冬 , 罗伏兵
(北京市动物疫病预防控制中心 , 北京 大兴 102629)
2021年2月北京市海淀区圆明园遗址公园内3只野生黑天鹅异常死亡,本试验对送检病死黑天鹅样品进行病毒分离,鉴定为H5N8亚型禽流感病毒,根据基因序列分析和鸡胚死亡时间判定为高致病性毒株,通过病毒表面HA基因的同源性比较和遗传进化分析,显示该毒株属于2.3.4.4分支。水禽是禽流感病毒众多谱系的主要宿主,在这些谱系的禽流感病毒保存和传播过程中发挥极为重要的作用[1],本试验为摸清该病毒传入来源和制定科学防控措施提供了理论依据。
1 材料与方法
1.1 主要材料 MagaBio plus病毒DNA/RNA纯化试剂盒,购自杭州博日科技股份有限公司,批号:20200101;禽流感病毒H5N8亚型RNA检测试剂盒,购自哈尔滨国生生物科技股份有限公司,批号:P572201013。
1.2 临床剖检 对3只病死黑天鹅按常规方法进行剖检,观察各组织器官病变,并取疑似病变组织器官进行下一步实验室检测。
1.3 实验室检测 样品提取核酸后使用禽流感病毒H5N8亚型RNA检测试剂盒进行禽流感病毒H5N8亚型荧光定量逆转录聚合酶链反应(Reverse transcription-polymerase chain reaction,RT-PCR)检测。
1.4 病毒分离 由中国农业科学院哈尔滨兽医研究所对北京市动物疫病预防控制中心送检的1只死亡天鹅肺脏和1只死亡黑天鹅脾脏样品剪碎后,接种SPF鸡胚,进行禽流感病毒的分离鉴定。
1.5 基因组测序与分析 通过GISAID数据库查找禽流感病毒,IRD Influenza Research Database分析网站对蛋白质序列进行特征性位点分析,并将H5N8亚型全基因组序列BLAST进行多序列比对分析,MEGA 7.0构建HA和NA基因进化树,进行遗传演化树分析。
2 结果
2.1 临床剖检 结果显示,3只病死黑天鹅头部和面部水肿;角膜充血,一侧失明;喉头点状出血,消化道、呼吸道黏膜广泛充血、出血;胰腺点状出血,肝脏肿大、坏死,肺部淤血;腺胃乳头出血,腺胃和肌胃之间交界处可见坏死灶;心冠和腹部脂肪出血。上述临床剖检病理变化与典型的高致病性禽流感病理变化相符,临床初步判定为疑似高致病性禽流感病毒感染。
2.2 实验室检测 取3只病死黑天鹅肺脏组织进行核酸提取,荧光定量RT-PCR扩增检测结果为禽流感病毒H5N8亚型(图1)。
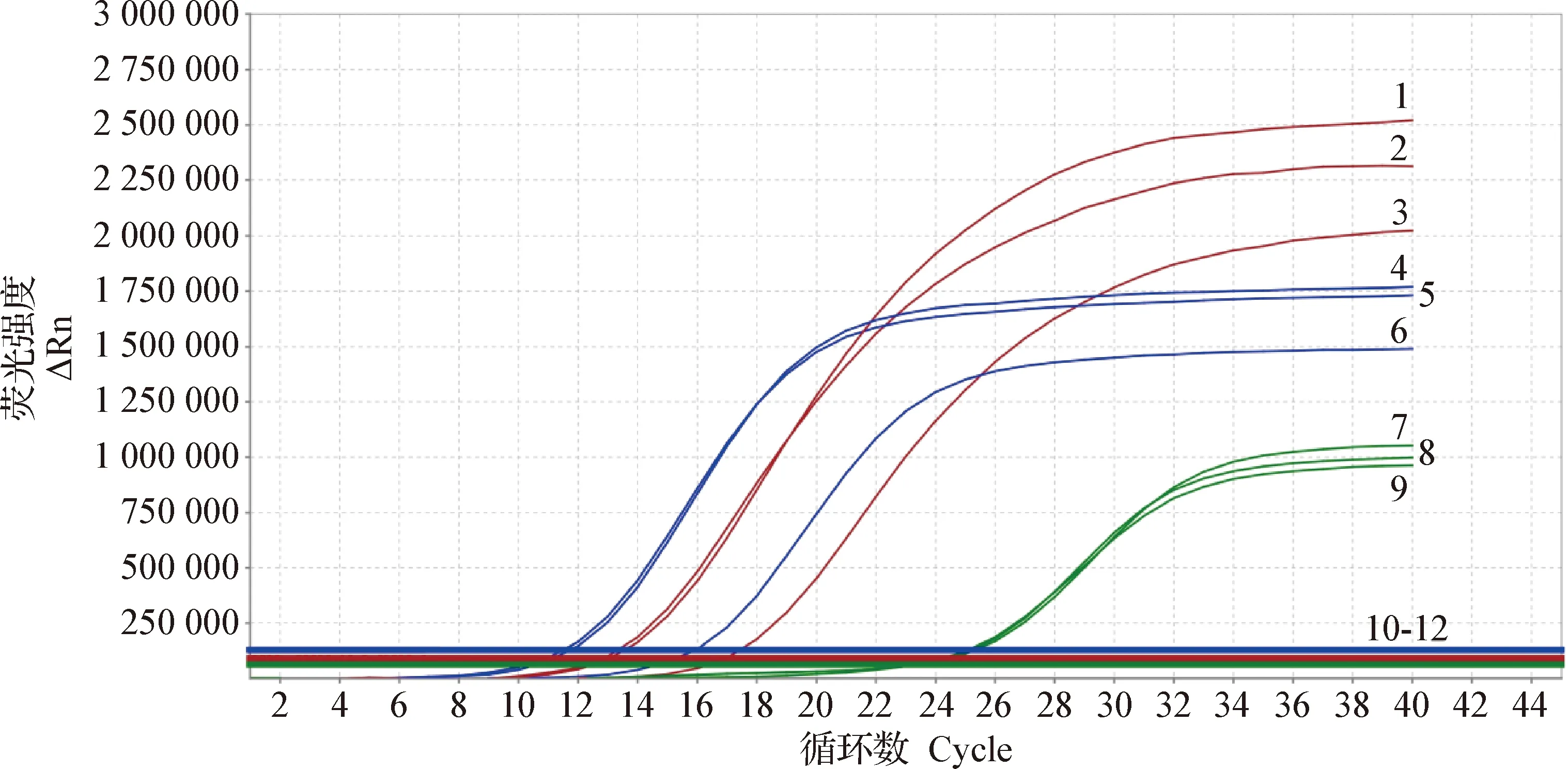
图1 组织样品的荧光定量RT-PCR检测Fig.1 Fluorescence quantitative RT-PCR detection of tissue samples1~3:H5亚型阳性; 4~6:N8亚型阳性; 7~9:阳性对照; 10~12:阴性对照1-3:H5 subtype positive; 4-6:N8 subtype positive; 7-9:Positive control; 10-12:Negative control
2.3 病毒分离 从1只死亡天鹅肺脏和1只死亡黑天鹅脾脏样品中均分离到H5N8亚型禽流感病毒。
2.4 基因序列测定和特征性位点分析 分离获得的病毒株命名为A/Wild Swan/Beijing/YMY06/2021(H5N8),通过全基因组测序后进行BLAST比对分析,结果显示,分离毒株HA基因与A/mallard/Kagoshimma/KU-d89/2021毒株相似度最高,为99.77%;与A/Astrakhan/3212/2020毒株相似度为99.41%。分离毒株NA基因与A/Cygnus columbianus/Hubei/51/2020(H5N8)毒株相似度最高,为99.43%。对HA节段氨基酸序列分析显示,分离到的病毒HA蛋白裂解位点氨基酸序列为KRRKR/GLF,具有5个连续性碱性氨基酸,结合鸡胚死亡时间,鉴定为高致病性禽流感病毒。该病毒HA蛋白含有7个潜在糖基化位点,NA蛋白含有5个潜在糖基化位点(表1)。
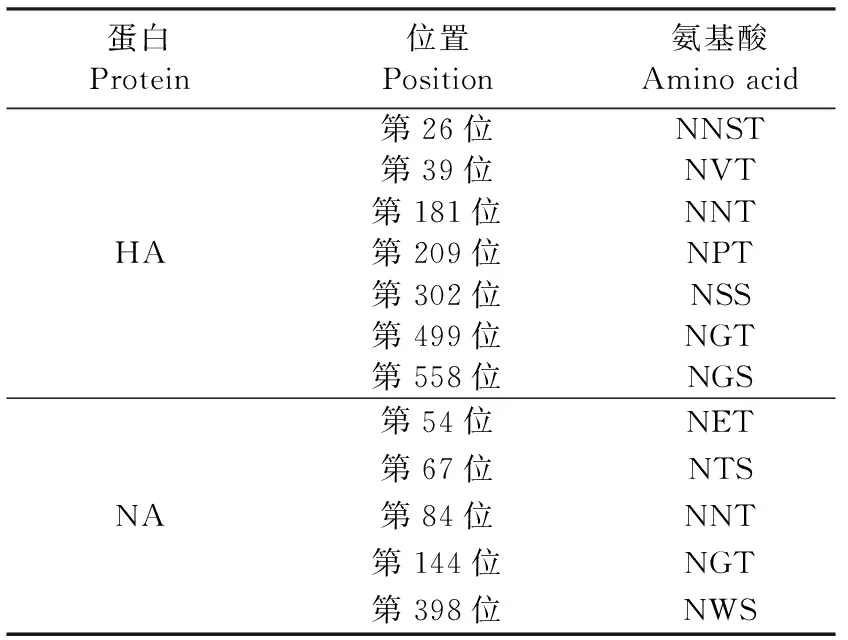
表1 A/Wild Swan/Beijing/YMY06/2021(H5N8)潜在糖基化位点分析Table 1 Analysis of potential glycosylation sites of A/Wild Swan/Beijing/YMY06/2021(H5N8)
该分离毒株氨基酸位置的确定参照A/Aichi/2/1968 (H3N2)毒株顺序,病毒特殊氨基酸位点分析见表2,具有典型的禽型α2-3受体结合位点226Q、228G和138A。

表2 A/Wild Swan/Beijing/YMY06/2021(H5N8)特殊氨基酸位点分析Table 2 Analysis of special amino acid sites of A/Wild Swan/Beijing/YMY06/2021(H5N8)
2.5 基因遗传进化分析 对A/Wild Swan/Beijing/YMY06/2021(H5N8)毒株全基因组序列进行遗传进化分析。HA基因进化树结果显示,分离毒株与A/mallard/Kagoshimma/KU-d89/2021毒株高度同源,均属于clade 2.3.4.4分支(图2)。NA基因进化树结果显示,分离毒株属于clade 2.3.4.4分支Gochang-like群(图3)。
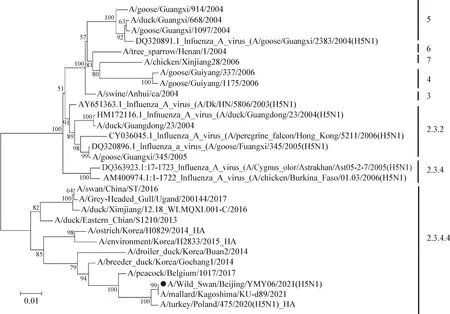
图2 分离毒株HA基因进化树Fig.2 HA gene evolution tree of isolated virus strain●:本试验分离病毒株;下同●:Virus strain isolated in this study. The same as below
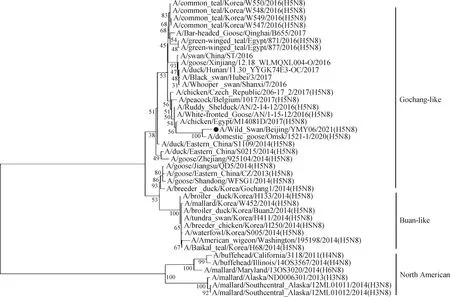
图3 分离毒株NA基因进化树Fig.3 NA gene evolution tree of isolated virus strain
3 讨论
禽流感的流行病学非常复杂,禽流感病毒不断通过突变和重组进化,出现新的亚型,对动物健康和生产造成重大影响[2]。本试验分离到的H5N8亚型高致病性禽流感病毒属于2.3.4.4分支,与日本、俄罗斯的毒株基因相似性很高,与2021年山东、2020年湖北毒株高度同源,分析该病毒可能发生了不同亚型的重配现象,并且有洲际重配的可能性[3]。
HA蛋白与宿主表面受体结合能力的强弱决定着禽流感病毒能否感染宿主,而唾液酸受体结合区(Receptor binding domain,RBD)对受体结合起着关键作用[4]。A型流感病毒宿主特异性与HA蛋白RBD上的氨基酸位点密切相关,HA蛋白可以识别α-2,3和α-2,6半乳糖连接的2种唾液酸受体类型[5],人类上呼吸道上皮表面含有α-2,6半乳糖连接的唾液酸受体,禽类呼吸道细胞含有α-2,3半乳糖连接的唾液酸受体[6],人流感病毒易与α-2,6受体结合,禽流感病毒易与α-2,3受体结合。流感病毒进化过程中HA蛋白第134位(G)、第136位(S)和第153位(W)氨基酸很保守,而第226位和第228位氨基酸最易发生突变,引起宿主特异性的改变[7]。本试验分离病毒具有典型的禽型α2-3受体结合位点226Q、228G和138A。该毒株具备高致病性禽流感病毒的分子特征,HA蛋白含有7个潜在糖基化位点,HA 受体结合区糖基化位点158 N的缺失,可能导致病毒对α-2,6受体的亲和力增加[8],应引起重视。
高致病性禽流感病毒HA基因裂解位点处含有多个碱性氨基酸,这种裂解位点可以被宿主细胞内普遍存在的类枯草杆菌蛋白酶识别并裂解,使病毒可以进入全身多种类型细胞并进行复制,因此高致病性禽流感病毒感染宿主后,常导致全身性感染。本试验分离病毒的HA蛋白裂解位点氨基酸序列为KRRKR/GLF,具有5个连续性碱性氨基酸,鉴定为高致病性禽流感病毒。
在全球候鸟迁徙路线中我国有3条,分别为东非—西亚迁徙路线、中亚—印度迁徙路线以及东亚—澳大利亚迁徙路线,每年从我国过境的候鸟种类和数量约占迁徙候鸟的20%~25%,北京处于东亚—澳大利亚迁徙路线上,是众多候鸟春秋两季迁徙的必经之路。仅在2020年初的候鸟迁徙高峰期,全市88个候鸟监测站共监测到鸟类上百万只,同比增加30多万只,由此推测野禽携带病毒继而引发疫情的风险较大[9]。
目前,H5亚型高致病性禽流感疫情仍在欧洲、亚洲和非洲蔓延,导致受感染场所内的禽鸟死亡和扑杀,给养殖业造成巨大的经济损失。更有可能的是,这些暴发中的传染源可通过野鸟在当地传播。因此,对野鸟进行监测,提高养殖场生物安全等措施是防控的关键[10]。

