化工产品中氨基的保护与脱保护
郭艳浩,蒿庆辉,郝思媛,张亚通,苏 荣,段迎梅
(河北科技大学 理学院,石家庄 050018)
0 引 言
在有机反应中,1 个试剂往往会与其中2 个或2 个以上的官能团作用,基团保护就是先将不需要发生反应的基团保护起来,待其他基团反应完成后,再去除保护基。
保护基的过程分为上保护基和去保护基,上保护基过程是使保护试剂与需要被保护的基团发生反应;去保护基的过程是选择合适的反应条件恢复到原来基团的状态。
理想的保护基应是:(1) 能选择性地、容易地与被保护的基团反应,达到高转化率;(2) 与保护基反应后,所生成的结构部分在与其他官能团的反应中是稳定的;(3) 当反应结束后,方便地裂解、分离除去;(4) 保护基易得,反应易操作,污染少。
在多步有机合成中,氨基通常需要保护。目的保护基团主要包括酸[如叔丁基氧羰基(Boc)基]、碱[如9- 芴基甲基氧羰基(Fmoc)基和三氟乙酰基]、催化加氢(如苄基)、光照射(如2- 硝基苯乙基氨基甲酸酯和6- 硝基戊基氨基甲酸酯)和氟[如三甲基硅基乙基氧羰基(Teoc)基]去保护基团。
曾报道的1,3- 二硫安-2- 基甲氧基羰基(Dmoc)基团在去保护条件方面提供了不同维度的胺保护正交性。然而,在化工产品合成过程中,胺类化合物对有些反应很敏感,如氧化反应和取代反应等。
在化学反应中,有时需要其他官能团进行反应,因此,应先把氨基保护起来,防止氨基被反应。保护氨基的方法主要有5 大类:酰基化、烷基化、烷氧羰基化、质子化反应及螯合反应。
1 酰基类保护基
酰基化常用的保护基有邻苯二甲酰基(Pht)、对甲苯磺酰基(Tos)、三氟乙酰基(Tfa) 等,应根据化合物的特性来选择相应的保护基。
1.1 邻苯二甲酰基(Pht) 的保护与脱保护作用
Pht- 氨基酸在碱性条件下易发生开环,生成其他杂质。所以,用Pht 作为保护基时,应注意反应条件。Pht 在催化加氢、酸性等条件处理比较稳定,而在碱性条件下不稳定,常用肼来去除该保护。
查文献发现,人们最早引入Pht 保护基是用对应酸酐和氨基酸在高温下进行熔融反应,该反应在实验室条件不易进行,且放大生产困难,难以推广。
目前,最好的方法是Neftkens 等人改进的工艺,该工艺条件温和,易操作,可用于放大生产,也可在仲胺存在的条件下选择性的保护伯胺。
Pht 保护氨基的反应式如图1 所示。

图1 Pht 保护氨基的反应式Fig.1 Reaction formula of Pht protecting amino
Meffre 等人使用邻苯二甲酸酐在三乙胺和甲苯存在的条件下,进行加热回流引入Pht 来保护氨基,收率>80%,该反应条件易控制,可以用来放大生产。
Aguilar 等人使用邻苯二甲酸单乙酯在PyBOP耦联试剂条件下引入Pht 来保护氨基,该反应时间长,后处理复杂,收率>90%。
W.Shijun 等人使用N- 乙氧羰基邻苯二甲酰胺在弱碱碳酸氢钠条件下引入Pht 来保护氨基,该反应成本低,条件温和,后处理简单,收率为75%,可以用于放大生产。
一般用肼就可脱去Pht,而其他保护基Cbz 和Boc 等基团都能稳定存在。在浓盐酸回流或硼氢化钠条件下,均可脱去Pht 保护基。
W.Shijun 等人用水合肼的方法脱去Pht,该反应后处理需调节pH 值,处理过程较为复杂,适用于小试,不利于放大生产。
Lee 等人在盐酸回流条件下脱去Pht,反应时间长,但收率高达95%。
Pht 脱除的反应式如图2 所示。
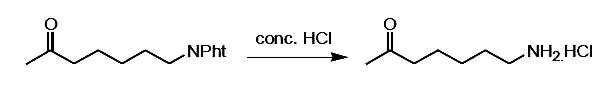
图2 Pht 脱除的反应式Fig.2 Reation formula of Pht removal
J.O.Osby 等人在硼氢化钠条件下脱去Pht,该反应时间较长,反应阶段较多,在不同阶段反应温度不一样,不易控制,不利于生产。
1.2 对甲苯磺酰基(Tos) 的保护与脱保护作用
将甲苯和氯磺酸按顺序加入反应釜中,同时加入无机盐,反应温度为40 ℃~80 ℃,微负压,反应结束后,处理得到Tos。
Tos 是最稳定的氨基保护基之一,它对碱性水解和催化还原都很稳定,含有该保护基的化合物,在工艺上更易结晶,成本更低。
对甲苯磺酰氯在碱性条件下和含有氨基的化合物反应,易得到Tos 衍生物。Arthur G 等人在三乙胺条件下引入Tos,该反应时间长,后处理复杂,收率仅为60%,收率不高,不易生产。
Tos 保护氨基的反应式如图3 所示。

图3 Tos 保护氨基的反应式Fig.3 Reation formula of Tos protecting amino
Tos 保护基在酸性、氢化和皂化等条件下很稳定,一般用萘钠、Na/NH3(液)、Li/NH3(液)可处理脱去,使用HBr/苯酚和Mg/MeOH 也可处理脱去。但萘钠、Na/NH3(液)、Li/NH3(液)脱Tos 的方法危险系数高,操作要求高,不易生产。
Calvisi 等人用HBr/ 苯酚脱除Tos,反应温度高,反应时间较长,但收率高达95%,视情况选择该条件。
脱除Tos 的反应式如图4 所示。

图4 Tos 脱除的反应式Fig.4 Reation formula of Tos removal
Nenajdenko 等人用Mg/MeOH 脱除Tos,反应时间短,后处理简单,收率为90%,可用于工业生产。
1.3 三氟乙酰基(Tfa) 的保护与脱保护作用
文献报道,Weygand 等人最先引入Tfa 保护氨基用于合成常用的肽。三氟醋酐引入Tfa 保护基,在碱性条件下,可脱去Tfa。N-Tfa- 氨基酸在缩合时,易发生消旋,保护氨基时应特别注意。
Weygand.F 等人报道在低温下于三氟醋酸溶液中用三氟醋酐酰化,这样引入Tfa 的效果不错。
Chambers 等人在TFAA、DMAP、三乙胺等存在的条件下,引入Tfa 的收率达到92%,适用于放大生产。
Knoops 等人使用三氟乙酸乙酯引入Tfa,收率高达98%,但采用柱层析的方法进行纯化,不适用于放大生产。
Whitlock 等人使用氟乙酸乙酯选择性保护氨基,在仲胺的存在下保护伯胺,该反应条件温和,但纯化方法不理想,收率为85%。
Tfa 保护氨基的反应式如图5 所示。

图5 Tfa 保护氨基的反应式Fig.5 Reation formula of Tfa protecting amino
Tfa 是一个较易脱去的基团,脱去条件比较温和,在碱性条件下即可脱去。
Whitlock 等人使用碳酸钾在甲醇和水的条件下脱去Tfa,该反应条件温和,后处理简单,收率>85%,可用于生产。
脱除Tfa 的反应式如图6 所示。

图6 Tfa 脱除的反应式Fig.6 Reation formula of Tfa removal
Chambers 等人使用氢氧化钾在甲醇和水的条件下脱去Tfa,该反应时间长,后处理复杂,收率为59%。
2 烷基类保护基
烷基化常用的有三苯甲基保护基(Trt) 和苄基保护基(Bn) 等,应根据化合物的性质来选择合适的保护基。
2.1 三苯甲基保护基(Trt) 的保护与脱保护作用
Trt 最早使用在多肽合成上,现已逐渐应用到氨基的保护。Trt 位阻效应影响较大,一般适用于末端的氨基,在酸性条件下易脱去Trt。
Trt 由于位阻效应影响,一般采用Trt-Cl/Me3Si Cl/Et3N 或Trt-Cl/TMSCl/Et3N 来引入。
Hoffman 等人使用氨基酸在Trt-Cl/Me3SiCl/Et-3N 条件下很好地引入了Trt 来保护氨基,该反应后处理复杂,收率仅为53%。
Trt 保护氨基的反应式如图7 所示。

图7 Trt 保护氨基的反应式Fig.7 Reation formula of Trt protecting amino
Gros 等人使用氨基醇在Ph3C-Cl、三乙胺存在的条件下成功引入了Trt 来保护氨基,该反应条件温和,后处理简单,采用柱层析法进行纯化,收率达到83%。
Trt 在pH<7 的条件下可脱去,如在醋酸或50%醋酸水溶液中均可顺利地被脱去,此时Boc 保护基可稳定不变。Trt 在三氟乙酸条件下也可顺利地被脱去。
Vago 等人使用醋酸在60 ℃条件下可很好地脱去Trt,后处理简单,收率仅为64%。
脱除Trt 的反应式如图8 所示。

图8 Trt 脱除的反应式Fig.8 Reation formula of Trt removal
Pickersgill 等人在TBS 和Boc 官能团存在的条件下,使用BF3-HOAc 可很好地脱去Trt,该反应条件温和,后处理简单,收率达到88%,可放大生产。
2.2 苄基保护基(Bn)
Bn 是最稳定的氨基保护基之一,对很多反应都很稳定。Bn 一般通过苄溴或苄氯和K2CO3、DIPEA、NaH、Et3N 及n-BuLi 在 有 机 溶 剂(如DMF、DCM 和ACN 等)中反应来引入,或经C6H4CHO/NaBH4、NaBH3CN 或NaBH(OAc)3还原胺化来引入。
Cossy.J 等人在BnBr、K2CO3、n-Bu4NI 条件下很好地引入了Bn,收率达到81%,但反应时间长,不易生产。
Rompaey 等人在NaBH(OAc)3条件下,通过还原胺化很好地引入了Bn,但后处理复杂,且收率低,不适合生产。
Bn 保护氨基的反应式如图9 所示。

图9 Bn 保护氨基的反应式Fig.9 Reation formula of Bn protecting amine
一般使用H2/Pd-C 氢化、HCOONH4/Pd-C 氢化、ClCOOCH2CCl3、Na/NH3等方法脱除Bn。
Basso 等人使用H2/Pd-C 氢化脱Bn,该反应操作简单,后处理也简单,收率>90%,适合放大生产。
脱除Bn 的反应式如图10 所示。

图10 Bn 脱除的反应式Fig.10 Reation formula of Bn removal
Tilekar 等人使用HCOONH4/Pd-C 氢化脱Bn,该反应操作简单,收率>85%,适合工业化生产。
3 烷氧羰基类保护基
氨基酸中的氨基常用烷氧羰基类保护基来保护,它可以减少在肽合成中的外消旋的程度。
常用的烷氧羰基类保护基有叔丁氧羰基(Boc)、苄氧羰基(Cbz) 和笏甲氧羰基(Fmoc)等保护基。
3.1 叔丁氧羰基(Boc) 的保护与脱保护作用
Boc 是常用的氨基保护基。Boc 保护氨基后一般都能重结晶,纯度很高,避免了复杂的后处理过程。在酸性条件下,室温搅拌即可脱去Boc。
常用的引入Boc 的方法是在碱性条件下与Boc2O 反应得到,该反应的副产物容易除掉,且对反应没有影响。对亲核性较强的胺,通常采用醇和Boc 酸酐直接反应,不需要碱,后处理也简单。
Anderson 等人在氢氧化钠和叔丁醇条件下,使用苯丙氨酸与Boc2O 反应,氨基被很好地保护起来,该反应在室温条件下就可反应,收率>80%。
Boc 保护氨基的反应式如图11 所示。

图11 Boc 保护氨基的反应式Fig.11 Reation formula of Boc protecting amino
Alessandro Dondoni 等人在氨基酸酯中,使用三乙胺和Boc2O 反应来保护氨基,该反应时间长,收率>90%。
Luo Qun-Li 等人在三乙胺条件下,使用芳胺和Boc2O 反应来保护氨基,该反应温度为40 ~50 ℃,反应时间长,收率仅为49%。
Boc 保护氨基的反应式如图12 所示。

图 12 Boc 保护氨基的反应式Fig.12 Reation formula of Boc protecting amino
Macleod 等人在NaHMDS 和Boc2O 存在的条件下,芳胺可很好地被保护,该反应时间约为16 h,后处理简单,收率达到78%。
Lars G. J 等人在DMAP 和三乙胺存在的条件下,与Boc2O 反应,酰胺的氨基可很好地被保护,该反应时间长,后处理复杂,收率可达90%。
G.Tong 等人在DMAP 和Boc2O 存在的条件下,采用一锅法将吲哚的氨基保护起来,该反应时间短,后处理简单,收率高达95%,可适用于放大生产。
Boc 酸解产物为异丁烯和CO2,Boc 的脱除一般可用TFA 或50%TFA,常用的是盐酸的有机溶剂(盐酸的乙酸乙酯溶液、盐酸的二氧六环溶液)。
C. Mühlemann 等人使用三氟乙酸脱除Boc,在室温条件下进行反应,后处理简单,收率>95%,可用于放大生产。
J.Wehbe 等人使用盐酸脱除Boc,该反应时间短,直接过滤即得产品,收率>98%,可用于放大生产。
脱除Boc 的反应式如图13 所示。

图 13 Boc 脱除的反应式Fig.13 Reation formula of Boc removal
3.2 苄氧羰基(Cbz) 的保护与脱保护作用
Cbz 保护基是Bergmann 早在1932 年发现的一个保护基。其优点在于:
(1) 制备Cbz 的溶剂和进行氨基保护时都很容易。
(2) 含有Cbz 保护基的化合物或肽一般情况下可以重结晶,纯度高,且比较稳定。
脱去Cbz 保护基时的条件都比较温和。
Cbz-Cl 是常用的引入Cbz 保护基的试剂。需要保护的氨基在pH>10 的条件下,可以和Cbz-Cl反应得到相应的化合物。
Konda-Yamada 等人使用游离氨基酸在碳酸钠的条件下和Cbz-Cl 反应,氨基很好地被保护,该反应时间短,后处理不复杂,但收率较低,不适合放大生产。
Cbz 保护氨基反应式如图14 所示。

图14 Cbz 保护氨基的反应式Fig.14 Reation formula of Cbz protecing amino
Cbz 的脱除主要有钯碳氢化、酸性条件裂解和Na/NH3(液) 还原。目前,实验室通用的方法为钯碳氢化,该条件在实验室易达到。
B.Pierfrancesco 等人在氢氧化钯存在的条件下很好地脱去了Cbz,该实验反应条件和后处理简单,收率>85%,可以放大生产。
脱除Cbz 的反应式如图15 所示。

图15 Cbz 脱除的反应式Fig.15 Reation formula of Cbz removal
Alargov,D.K 等人在甲酸铵和钯碳存在的条件下,反应温度为室温,采用回流很好地脱去了Cbz,该反应后处理简单,收率达到98%,可适用于放大生产。
4 质子化反应和螯合反应
从理论上讲,对氨基最简单的保护方法是使氨基完全质子化,即占据氮原子上的孤电子对,以阻止取代反应的发生。但实际上,在使氨基完全质子化所需的酸性条件下,可进行的合成反应很少。所以,这种方法仅用于防止氨基的氧化。
例如2,2- 二氨基取代苯,在硫酸中硝化时得到4- 硝基衍生物,但用二氨基的双酰化物(如丁酰胺)进行硝化时,得到的主产物为3- 和5- 位硝基取代物。
也可采用形成季铵盐的方法来保护氨基,脱除保护时,需调节溶液的pH 呈碱性,即可去质子。
另外,一个与质子化相似而有效的保护方法是利用氮原子上的孤电子对形成螯合物,例如α-2和β-2 氨基酸,可与过渡金属形成稳定的配合物。
应用络氨酸铜配合物,苯乙酰化反应只在酚基上发生,不在氨基上发生反应。二元氨基酸也可选择只在一个氨基上进行酰化反应。复合物用硫化氢处理很容易得到酰化物。
选择螯合反应,能特异性地保护氨基,脱保护时,只需加入与螯合剂螯合能力强的反应剂即可。
5 结 语
列举了氨基保护与脱保护的实例,可为生产化工相关产品提供参考,解决了化工生产不能合理利用氨基的实际问题。氨基的保护与脱保护,需根据化合物的特性来选择合适的条件,使氨基的保护在化学合成中发挥越来越多的作用。

