微生物菌剂对干旱胁迫下小麦生长生理和叶绿素荧光参数的影响研究
屈魏蕾,田玉磊,井方宇,孙婷婷,张蓓蓓
(陕西省灾害监测与机理模拟重点实验室/宝鸡文理学院 地理与环境学院,陕西 宝鸡 721013)
0 前言
植物在生长过程中会面临多种非生物胁迫,干旱胁迫是植物最容易遭受的非生物胁迫之一,缺水是制约半干旱地区作物生长的关键因素之一[1-2]。研究表明,干旱胁迫会造成植物低矮、叶面积减少等变化,导致叶绿素含量下降、细胞活性氧(ROS)增加以及膜脂过氧化损伤,同时降低光合碳同化、光合相关酶活性[3],促使作物减产,甚至会导致植物死亡。小麦是半干旱地区广泛种植的一种禾本科作物,养活了全世界35%~40%的人口[4]。因此,寻找干旱胁迫的改良措施对于提高小麦产量与品质的稳定性以及保障粮食安全具有重要的意义。微生物菌剂作为一类由有益微生物组成的新型肥料[5],近年来已被视为逆境环境下提高农作物产量和质量的优良替代品。芽孢杆菌(Bacillus)是应用最为广泛的微生物菌剂之一,其能通过自身代谢分泌IAA、VOCs等刺激植物生长[6]。丛枝根菌真菌(Arbuscular Mycorrhiza Fungi, AMF)可以与植物共生,其菌丝可以通过分泌球囊霉素(GRSP)来提高土壤持水性,使根系从土壤吸收更多的营养和水分[7],从而提高作物的品质及产量。芽孢杆菌和AMF皆能改善植物生长,促进土壤养分的良性循环,帮助农作物抵御干旱、盐胁迫等逆境,促使作物增产增收[8-9]。
光合作用是作物积累生物量的生理过程,其对干旱较敏感。植物进行光合作用时,主要依靠叶绿体中的天线色素(Chl)吸收光能,光能会以光合电子传递、热能、叶绿体荧光这3种形式被利用或释放[10]。叶绿素荧光技术以生物膜流动为基础,可以不损伤植物的叶片,通过快速荧光诱导动力学曲线监测植物光合生理的变化,从而可以了解在逆境胁迫、病虫害危害、水肥管理中植物在光能利用、分配以及光合电子传递等方面的状况[11]。近年来,关于干旱胁迫的研究多集中于作物生长生理[12]和光合特性[13]等方面;关于微生物菌剂与小麦互作的研究则多集中于小麦生长发育[14]、病害防治[15]、土壤改良[16]等方面,而对于严重干旱胁迫下微生物菌剂对小麦生长及光合荧光生理的研究较少。鉴于此,本文采用30%土壤含水量来模拟干旱胁迫,分析了在该胁迫下不同微生物菌剂接种对小麦生长及光合作用的改良效果,以期筛选出适宜的微生物菌剂接种方案,为提高小麦产量提供参考。
1 材料与方法
1.1 试验材料
供试小麦品种为小偃22号。供试芽孢杆菌菌剂为枯草芽孢杆菌(Bacillus subtilis);供试丛枝菌根菌剂为根内根孢囊霉(Rhizophagus intraradices)及异形根孢囊霉(Rhizophagus irregularis),其中,枯草芽孢杆菌购自绿龙生物科技有限公司,丛枝菌根菌剂由华南师范大学姚青老师提供。供试土壤由宝鸡地区大田土壤和栽培基质(用于增加土壤的疏松度)按5∶1混合而成,其全氮含量为1.51 g/kg,全磷含量为0.86 g/kg,pH值为7.40。
1.2 试验设计
试验于2022 年3 月在宝鸡文理学院地理与环境学院植物生长模拟室进行。首先选择颗粒饱满的小麦种子,对其进行消毒、催芽处理,然后放置于25 ℃恒温箱内,进行黑暗发芽;待种子露白后,将其播种于直径为12 cm、高为10 cm 的花盆中,每盆定植10 株。设5 个处理:T1、T2、T3、T4分别接种菌剂Bs(枯草芽孢杆菌)、Rin(根内根孢囊霉)、Bs+Rin、Rin+Rir(异形根孢囊霉);CK 不接种菌剂;每个处理3 次重复。将各处理的麦苗放置在FytoScope LED 光源培养箱中进行培养,其光周期为光照16 h/黑暗8 h,昼/夜温度为25 ℃/15 ℃。芽孢杆菌菌剂按0.5 kg/hm2的剂量接种;丛枝菌根菌剂按每盆15 g 的剂量均匀接种至土壤表面1~2 cm 深处;双菌接种时每种菌剂的剂量减半。采用称重法每隔1 d 补水1 次,使土壤含水量保持在30%左右。
1.3 测定指标及方法
1.3.1 生长指标及生理指标的测定 在接种处理后第30天,每个花盆随机选取1株小麦,利用直尺分别测定其株高(PH)、叶长(LL)和叶宽(LW);用万分之一天平测定叶片的鲜重(FW),并将叶片在纯水中浸泡24 h后测定其饱和重(TW),之后将叶片在75 ℃下烘干至恒重,测定其干重(DW)。比叶面积(SLA)根据公式SLA=(LL×LW×0.75)/DW计算;叶片含水量(RWC)根据公式RWC(%)=(FW-DW)/(TW-DW)×100%计算。
可溶性蛋白含量采用考马斯亮蓝G-250法测定[17];可溶性糖含量采用蒽酮法测定[18];叶绿素含量用乙醇—丙酮(体积比为1∶1)法测定[19]。
1.3.2 叶绿素荧光诱导动力学曲线和参数的测定 采用FluorPen FP 100 Max(Brno, Czech)对不同微生物菌剂处理下的小麦叶片进行测定。先随机选取叶片进行20 min暗适应,再测定快速荧光诱导动力学曲线,相关的荧光参数如表1所示。利用Vt=(Ft-Fo)/(Fm-Fo)、△Vt=处理的Vt-对照的Vt对OJIP曲线进行归一化处理,得到标准化后的相对可变荧光曲线Vt以及相对于对照的可变荧光曲线△Vt。

表1 叶绿素荧光的相关参数
1.4 数据处理
采用Excel 2016软件整理试验数据;用SPSS 25.0软件进行单因素方差分析;采用LSD法进行差异多重比较(P<0.05);利用Origin 2021软件制作插图。
2 结果与分析
2.1 不同微生物菌剂对小麦生长的影响
由表2可知,不同微生物菌剂处理下小麦的株高、叶长、叶重、比叶面积以及叶片含水量均有显著性差异(F=25.17、7.54、42.50、5.63、8.98,P<0.05)。其中,T4处理下小麦的长势最好,其株高、叶长、叶重、比叶面积及叶片含水量分别较CK增加了44.01%、23.03%、71.88%、18.89%和0.11个百分点;T2处理小麦的长势次之,其株高、叶长、叶重、比叶面积及叶片含水量均较CK有所增加。说明在干旱胁迫下,不同接菌处理均能显著促进小麦的生长,但以T4处理的促生效果最好,T2次之。

表2 菌剂接种对小麦生长的影响
2.2 不同微生物菌剂对小麦生理的影响
由表3可知,在不同处理下小麦的可溶性蛋白、可溶性糖、叶绿素a、叶绿素b以及总叶绿素含量具有显著性差异(F=20.24、87.89、469.08、10.58、122.67,P<0.01)。可溶性蛋白、可溶性糖和叶绿素a含量均以T4处理最高,分别较CK高15.94%、100.67%和27.40%。叶绿素b和总叶绿素含量均以T2处理最高,分别较CK高31.58%和27.17%。叶绿素a/b值以T2处理最小,T4处理最大,但各处理间差异不显著(F=1.15,P>0.05)。说明在严重干旱胁迫下,T2和T4处理下小麦叶片吸收和捕获的光能较多,光合效能较强。
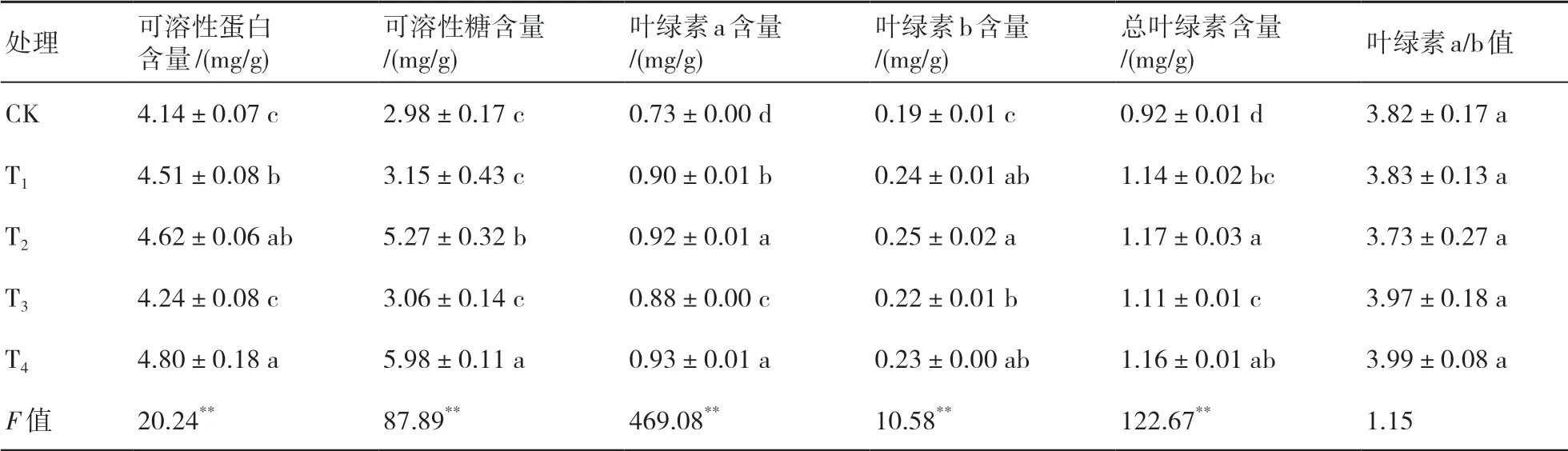
表3 菌剂接种对小麦叶片生理的影响
2.3 不同微生物菌剂对小麦叶片叶绿素荧光参数的影响
由表4可以看出,接菌处理对小麦叶片的Fo和Fm均有显著影响(P<0.01)。在不同微生物菌剂处理下,Fo在T3处理下达到最大,与其他处理存在显著差异(P<0.05);Fm以T4处理最大,与T1、CK差异显著(P<0.05),且以CK下最小。Fv/Fo反映PSⅡ反应中心的潜在活性[20];Fv/Fm是PSⅡ的最大光化学效率,反映植物的光抑制程度[21]。Fv/Fo、Fv/Fm均在T4处理下达到最大,分别较CK增加了50.92%和9.21%。PIabs是光化学性能指数,反映植物光合机构的整体状态[22],较Fv/Fm更加灵敏,其在T2处理下最高,T4处理次之,且这2个处理显著高于其他处理的。
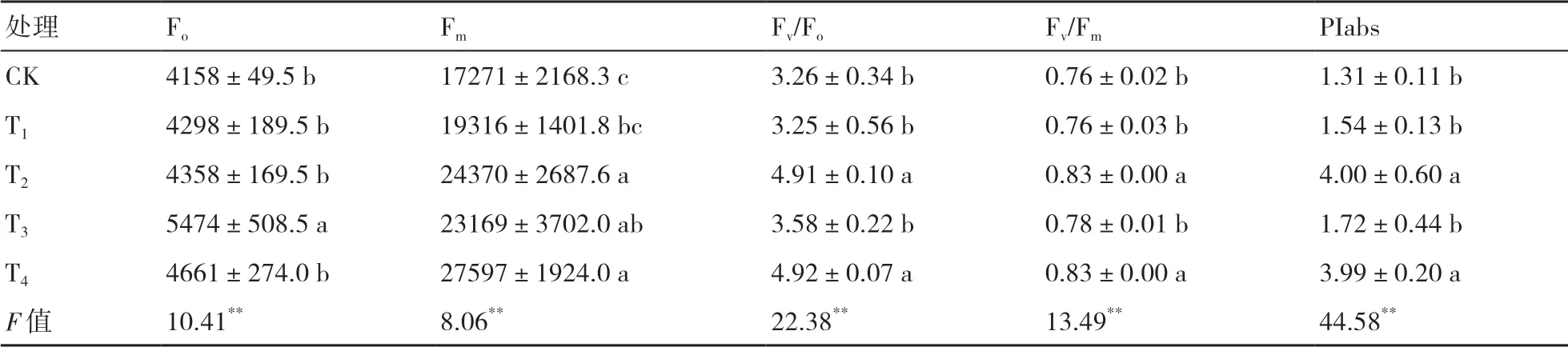
表4 菌剂接种对小麦叶片叶绿素荧光参数的影响
Mo、Vj、Vi、Ψo、φEo、φDo等参数可以反映PSⅡ受体侧的变化[23]。Mo代表PSⅡ的初始斜率。从表5可以看出,Mo在CK下达到最大,显著高于T2和T4处理的,说明在CK下QA-被还原的程度最大,电子传递能力最弱。Vj和Vi分别表示PSⅡ在J和I点时反应中心的关闭程度,均以CK最高。Ψo和φEo以T4处理最大,说明在T4处理下电子传递的量子产额和相对速率最大。φDo为用于热耗散的量子比率,以CK、T1处理最大,与T2、T4存在显著差异,说明CK、T1用于热耗散的电子较多。
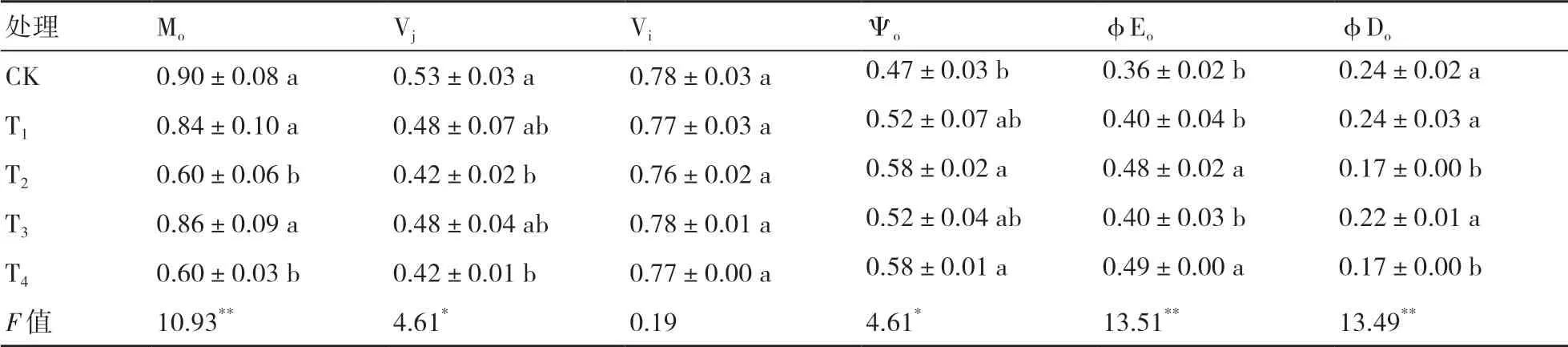
表5 菌剂接种对小麦PSⅡ受体侧的影响
活 性 参 数ABS/RC、TRo/RC、ETo/RC和DIo/RC能反映PSⅡ中光合机构对光能的吸收、传递以及耗散状况[13]。由表6可知:T1、T3处理的ABS/RC、TRo/RC、ETo/RC较CK均有所增加,但无显著差异;T2、T4处 理 的ABS/RC、TRo/RC、DIo/RC较CK显 著下降,而ETo/RC较CK略微增加,差异不显著。

表6 菌剂接种对小麦PSⅡ反应中心活性参数的影响
2.4 不同微生物菌剂对小麦OJIP曲线的影响
叶绿素快速荧光诱导(OJIP)曲线能反映PSⅡ反应中心的原初光化学反应信息[24]。J相荧光强度的升高与部分光反应中心的闭合相关,反映了QA-的还原水平及累积程度;I相与QB、PQ库的还原程度相关;P相与PSI受体侧电子受体的还原相关[25]。在不同微生物菌剂处理下小麦叶片的OJIP曲线如图1A所示:在O点(0.02 ms)时,在各处理间小麦叶片的荧光强度差异较小,以T3处理最高,CK最低;在J点(2 ms)时,在各处理间荧光强度的差异逐渐增大,但仍然以T3最高,T2和T4次之,三者分别比CK高28.89%、25.83%和25.55%;在I点(30 ms)时,在各处理间荧光强度差异显著增大,以T4处理的荧光强度最大,比CK、T1、T2、T3处理分别高46.22%、26.64%、5.08%和7.45%;在P点时,各处理的荧光强度在达到最大值后趋于稳定,表现为T4>T2>T3>T1>CK。
归一化处理可以减少误差,更加真实地反映小麦叶片的光化学过程[22]。由标准化后的相对可变荧光Vt(图1B)可知,在不同微生物菌剂处理间Vt值在J点的差异最为显著。从相对于CK的可变荧光ΔVt(图1C)可以看出,随着时间的推移,在各处理之间的ΔVt值差异呈先增大后减小的变化趋势,且ΔVt值大多小于0,说明接菌处理提高了放氧复合体的OEC活性,有效地缓解了水分亏缺对小麦叶片光系统的伤害。
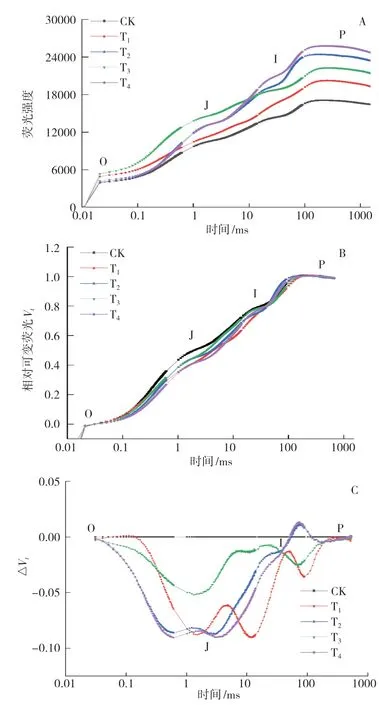
图1 菌剂接种对小麦叶片OJIP曲线(A)、V(tB ) 和ΔV(tC)的影响
2.5 不同微生物菌剂对小麦叶片光响应曲线的影响
对比5种不同处理的小麦叶片光响应曲线(图2),可以看出:T2、T4处理下叶片的量子产额(QY)在50 μmol/(m2·s) PPFD左右达到最大值0.64,表明其光补偿点(LCP)在50 μmol/(m2·s)PPFD左右;在其余处理下叶片的QY在20 μmol/(m2·s) PPFD左右达到最大值。上述结果表明T2、T4处理下的小麦更适宜在光照下生长。

图2 不同菌剂接种下小麦叶片量子产额(QY) 的光响应曲线
2.6 不同处理下小麦叶片生长、生理指标与叶绿素荧光参数的相关性分析
由表7可以看出:小麦叶片的生长指标(株高、叶长、叶重、比叶面积、叶片含水量)与叶绿素荧光参数(Fv/Fo、Fv/Fm、PIabs、Ψo、φEo)总体上呈显著正相关,而与Mo、Vj、φDo、ABS/RC、TRo/RC、DIo/RC总体上呈显著负相关;小麦叶片的生理特性指标(可溶性蛋白、可溶性糖、叶绿素a、叶绿素b、总叶绿素含量)与Fv/Fo、Fv/Fm、PIabs、Ψo、φEo均呈显著正相关,而与Mo、Vj、φDo、ABS/RC、TRo/RC、DIo/RC均呈负相关;叶片叶绿素a/b值与Fv/Fo、Fv/Fm、PIabs、Ψo、φEo呈负相关,与其余参数呈正相关。

表7 小麦生长、生理指标与叶片叶绿素荧光参数间的相关系数
3 小结与讨论
前人的研究结果表明,干旱会抑制植物的生长和产量的提高,而适量的微生物菌剂可以改善植物的生长状况,缓解干旱压力[26];其本质是利用不同菌种的功能提高植物生存所需要的养分含量或改善植物根系的生长[12]。在本试验中,接种不同微生物菌剂能有效地提高小麦的株高、叶长、叶重、比叶面积和叶片含水量,其中接种Rin+Rir的生长效果最好,其原因可能是丛枝菌根混合接种提高了菌根的侵染率,易于在小麦根际形成更加复杂的菌丝网络,从而改善了小麦植株的营养与水分状况,提高了叶片的水分传导率。这与在玉米上的研究结果[27]类似。
本试验发现,接种微生物菌剂对小麦叶片的生理指标(可溶性糖、可溶性蛋白、叶绿素a、叶绿素b及总叶绿素含量)都有显著的提升效果。洪文君等[28]研究发现微生物菌肥能减缓土沉香幼苗叶绿素的分解;适量施磷可以促进叶片叶绿素的合成[29]。本试验发现接种Rin和Rin+Rir后小麦叶片的叶绿素a、叶绿素b和总叶绿素含量均处于较高的水平,这可能是由于根内根孢囊霉和异形根孢囊霉双接种处理更有效地活化了土壤中的磷,提高了磷元素的有效性[30],使植物对土壤磷的吸收能力增强,从而促进了叶片ATP、NADPH的合成,有效地减缓了干旱对叶片叶绿素合成的抑制作用。可溶性蛋白和可溶性糖含量通常是反映植物细胞、组织的渗透调节能力以及植株代谢能力的指标。本试验结果表明,经接菌处理后小麦叶片的可溶性糖和可溶性蛋白含量都有显著提高,植株长势也优于对照,说明接菌能有效地增加小麦植株内渗透调节物质的含量。这是由于接菌有利于增强植物体内的淀粉水解作用,从而促使糖类不断积累,同时通过调节自身激素促进氨基酸合成为可溶性蛋白[31];此外接菌后形成的菌根结构可以增强小麦根系对水分的吸收,减缓干旱胁迫对植物细胞和组织的损伤,保证植株代谢活动的正常进行。
叶绿素荧光参数能反映接菌处理对干旱胁迫下小麦叶片光反应系统PSⅡ的影响。在本试验中,Rin+Rir处理提升了小麦叶片的Fo、Fm值,说明该处理增大了叶片的荧光强度,降低了PSⅡ反应中心的非辐射耗散,从而提高了叶片对光能的捕获能力[32]。其次,在Rin和Rin+Rir处理下小麦叶片的Fv/Fm、Fv/Fo、PIabs值较大,表明在这2个处理下小麦叶片的光合性能较优,比其他处理更能有效地减缓干旱胁迫的光抑制效应[23]。同时,接种Rin和Rin+Rir处理导致PSⅡ受体侧参数Mo、Vj、Vi较CK显著降低,说明接种Rin和Rin+Rir处理能有效地减少QA-的积累,减小PSⅡ受体侧的电子传递阻力,同时可以提高PQ库的电子接受能力[13]。与CK相比,其他接菌处理的Ψo、φEo增大而φDo减小,这进一步说明接菌处理可以减少还原QA的能量,将能量更多地用于PSⅡ电子传递[25]。综合上述结果可知,接种Rin和Rin+Rir处理的小麦叶片的光反应活性居前2位,这与张文科等[33]的研究结果一致。同时,经Rin和Rin+Rir处理的小麦叶片的ABS/RC、TRo/RC、ETo/RC、DIo/RC较低,说明这2个处理能更好地维持干旱胁迫下PSⅡ反应中心吸收和捕获的能量转移之间的能量平衡[34-35]。
OJIP曲线可以清晰地反映小麦叶片PSⅡ的光合生理的变化。与CK相比,接菌处理的荧光值在OJ段差异逐渐增大,说明叶片的ROC数量减少,而QA-的积累量增加;在JI段和IP段荧光值大幅上升,说明PQ库的电子数量减少,PQH2向PSⅠ末端电子受体(铁氧还原蛋白和NADP)的电子转移速率和量子产率增加[10,36]。对比OJIP、Vt和ΔVt曲线并结合PIabs来看,Rin+Rir为本试验条件下的最适处理,说明根内根孢囊霉+异形根孢囊霉混合接种处理可以有效地保护小麦叶片的PSⅡ,使小麦叶片表现出更强的光合能力和更高的光化学效率。
本研究的相关分析结果表明,在小麦植株生长指标、生理指标、叶片叶绿素荧光参数之间具有显著的相关性,推测是由于微生物菌剂接种处理不同程度地改善了小麦根际环境和土壤团聚体结构,促进了小麦对水分、N、P 等营养元素的吸收[6-9,27,30]。
综上所述,在4种微生物菌剂接种处理下小麦的生长、生理指标以及光合性能均有所提高。其中,在Rin+Rir处理下小麦的株高、叶面积、叶重和叶片含水量达到最大,长势最好,且可溶性蛋白、可溶性糖、叶绿素含量和PSⅡ光化学性能也得到了显著提升,因此,Rin+Rir处理为本研究条件下的最适菌剂接种方案。

