非布司他心脏不良反应信号的数据挖掘和分析
钟燕 姜怡雯 蒋娅莉 刘文艺 郭睿


中图分类号 R 971+.1 R969.3 文献标志码 A 文章编号 1001-0408(2022)02-0225-05
DOI 10.6039/j.issn.1001-0408.2022.02.16
摘 要 目的 挖掘和分析非布司他上市后心脏不良反应信号,为临床合理用药提供参考。方法 采用报告比值比法检测2009年第1季度至2020年第4季度美国食品和药物管理局不良事件报告系统中非布司他的不良反应信号,统计并分析心脏病症信号的相关信息。结果 从8 282份以非布司他为首要怀疑药品的不良事件报告中共检测出不良反应信号209个,其中心脏病症信號27个,涉及不良事件报告754份。症状类信号上报数(262份)最多,包括头晕、外周水肿、胸痛、心悸、重力性水肿等;随后依次为冠状动脉粥样硬化性心脏病信号、心力衰竭信号、心律失常信号、心脏性猝死信号(报告数分别为233、157、90、12份)。其中一半以上的信号在药品说明书中有所提及,而未被提及的信号主要为各种心力衰竭、心律失常、期前收缩等。应用非布司他发生心脏不良事件的患者中,男性多于女性,年龄集中在60岁及以上,用药剂量多为药品说明书推荐剂量(即40 mg/d或80 mg/d),相关不良事件多发生在用药1个月内。结论 临床需在使用非布司他的过程中常规关注其心脏安全性,且后期仍需进一步评价和验证该药的心脏不良反应信号。
关键词 非布司他;心脏不良事件;不良反应信号;数据挖掘
Data mining and analysis of febuxostat-induced cardiac ADR signals
ZHONG Yan,JIANG Yiwen,JIANG Yali,LIU Wenyi,GUO Rui(Dept. of Pharmacy, Hospital of Chengdu Office of People’s Government of Tibetan Autonomous Region, Chengdu 610041, China)
ABSTRACT OBJECTIVE To mine and analyze the cardiac adverse drug reaction (ADR) signals induced by febuxostat in post-marketing experience, and to provide reference for rational drug use in clinic. METHODS Reporting odds ratio (ROR) method was used to mine the ADR signals induced by febuxostat from the FDA Adverse Event Reporting System during the first quarter of 2009 to the fourth quarter of 2020; the information of cardiac disease signals was counted and analyzed. RESULTS A total of 209 ADR signals were detected in 8 282 adverse drug event (ADE) reports with febuxostat as the primary suspected drug, involving 27 cardiac signals and 754 ADE reports. The most reported signals were symptoms (262 reports), including dizziness, oedema peripheral, chest pain, palpitations and gravitational oedema and so on, followed by coronary atherosclerotic heart disease signal, heart failure signal, arrhythmia signal, sudden cardiac death signal (233, 157, 90, 12 reports, respectively). More than half of the signals were mentioned in the drug instructions, while the unmentioned signals were mainly kinds of cardiac failure, arrhythmia and extrasystoles, etc. The patients with cardiac ADEs who received febuxostat were more male than female, and the age was 60 and over; the drug dosage was mostly 40 mg/d or 80 mg/d as recommended in the drug instructions, and cardiac ADEs mostly occurred within 1 month of medication. CONCLUSIONS Routine attention should be paid to the cardiac safety of febuxostat during medication, further evaluation and validation of febuxostat-induced cardiac ADR signals are still needed.
KEYWORDS febuxostat; cardiac adverse event; ADR signal; data mining
随着计算机技术和医药卫生相关数据库的发展,数据挖掘为探索药品不良反应(adverse drug reaction,ADR)信号和发现药品上市后安全性问题提供了新的思路和途径[1]。我国国家药品监督管理局对ADR信号的定义为:从发展的趋势来看,有可能发展为ADR的药品不良事件(adverse drug event,ADE)[2]。近年来,我国学者也采用数据挖掘技术对不同药品的ADR信号进行了挖掘和分析评价[3-4]。
非布司他是一種新型的非嘌呤类黄嘌呤氧化酶(xanthine oxidase,XO)抑制剂,能特异性地抑制XO。2009年2月,美国食品和药物管理局(Food and Drug Administration,FDA)批准其上市申请,准许其用于痛风患者高尿酸血症的长期治疗;2013年该药进入我国。非布司他的降尿酸作用呈剂量依赖性,轻中度肾功能不全的痛风患者用其治疗时无需调整剂量;其还被《中国高尿酸血症与痛风诊疗指南(2019)》推荐作为痛风患者的一线降尿酸药物[5-6]。值得注意的是,一项随机对照的Ⅲ期试验结果显示,相较于别嘌醇治疗组,非布司他治疗组患者具有更高的心血管事件发生率[7]。同时,基于CARES研究结果[8],美国FDA于2019年增加了非布司他可能增加心脏相关性死亡风险的黑框警告[9]。但是,后续的亚洲人群队列研究和FAST研究结果显示,与别嘌醇相比,非布司他并没有增加患者发生心血管ADE的风险[10-11]。目前,尚未见到药品上市后ADR自发呈报系统中有关非布司他ADR的全面数据分析研究。郭钦惠等[12]回顾性分析了2014-2019年国内外关于非布司他导致 ADR的文献报道19例,但其中无心脏ADR的个案报道;Gandhi等[13]仅对美国FDA不良事件报告系统(FDA Adverse Event Reporting System,FAERS)中2009-2011年非布司他致心血管血栓事件的单一信号进行了研究。基于此,本研究拟通过数据挖掘技术检测真实世界大数据库中非布司他2009-2020年的心脏ADR信号,为临床合理用药提供参考。
1 资料与方法
1.1 数据来源
所有数据均来源于FAERS中2009年第1季度至2020年第4季度的原始季度数据包。FAERS是美国FDA用于监测上市后药品安全性的数据库,包括但不限于美国医疗保健专业人员、消费者和制造商自愿上报的药品在临床试验、文献资料、临床使用等阶段中所发现的ADE,并向公众免费开放[14]。该数据库信息结构符合人用药品注册技术要求国际协调会(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH)发布的个例安全性报告规范(ICH E2B),ADE使用ICH《国际医学用语词典》(Medical Dictionary for Regulatory Activities,MedDRA)的术语进行编码。每季度数据包含说明以及个人信息记录(demographic and administrative information,DEMO)、药物使用记录(drug/biology information,DRUG)、不良事件记录(adverse events,REAC)、不良事件结果(patient outcomes,OUTC)、不良事件来源(report sources,PRSP)、药物治疗时间(drug therapy start and end dates,THER)、药物适应证(indications for use/diagnosis,INDI)7个文件,文件间由同一ISR号或Primaryid号联系起来,数据丰富且信息量大。
1.2 数据整理
利用Microsoft Office Access 2007和Ecxel 2007软件对数据进行筛选、统计、分析等处理,去除重复、非药品以及不确定药品名称的REAC表数据条目。以药品名称“Febuxostat”“Feburic”“adenuric”“uloric”或药品活性成分名称“febuxostat”,联合药品在ADE中的角色名称“primary suspect(PS)”在DRUG表中进行筛选,并与REAC表创建查询设计,获得非布司他为首要怀疑药品的ADE报告总份数和ADE名称。
1.3 信号检测
目前,国内外常用的ADR信号检测方法主要为比例失衡法,包括报告比值比(reporting odds ratio,ROR)法、比例报告比法、贝叶斯置信度递进神经网络法和伽玛泊松分布缩减法等[15]。鉴于ROR法较其他信号检测方法具有灵敏度高、结果偏倚小的优点[16],故本研究应用ROR法对处理后的ADE报告进行信号检测。该方法的计算建立在四格表(表1)基础上,确定产生1个ADR信号的条件为ADE报告数(a)>3、ROR值的95%置信区间(confidence interval,CI)下限>1[15]。具体计算公式为:ROR=ad/bc,95%CI=elnROR±1.96[√1/a+1/b+1/c+1/d] 。
1.4 信号分类
本研究采用MedDRA 23.1(英文版)对检测到的ADR信号按照系统器官进行分类(system organ class,SOC)。SOC具有多轴性,即一个首选术语(preferred terms,PT)可出现在多个SOC中,但只有一个被确定为主SOC。为了给临床提供更全面的心脏安全性数据,只要PT对应SOC涉及心脏或属于心血管实验室指标的信号均被本研究纳入心脏病症ADR信号分析。
2 结果
2.1 ADR信号检测结果
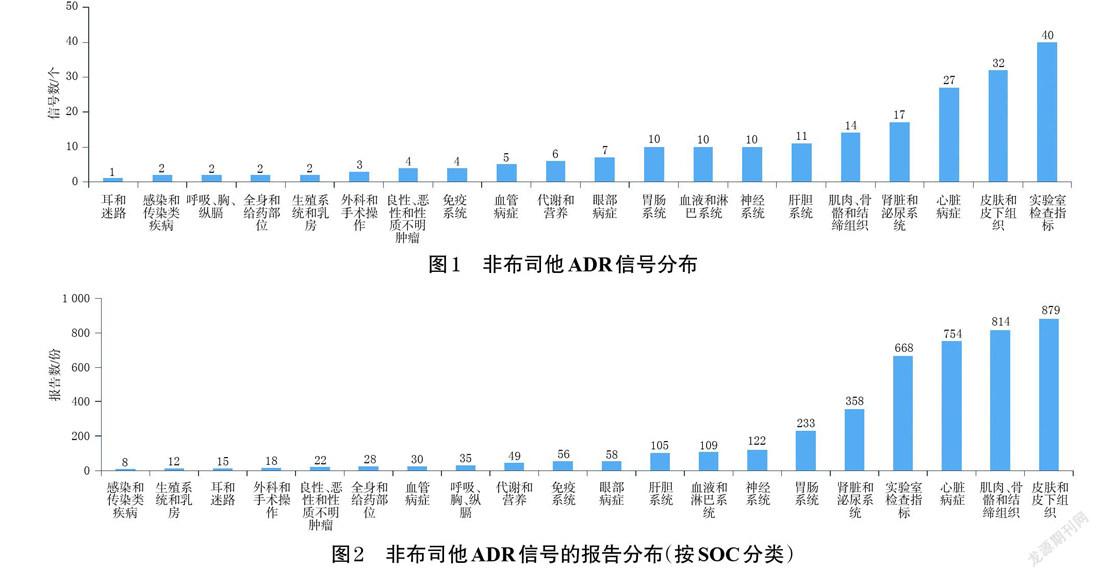
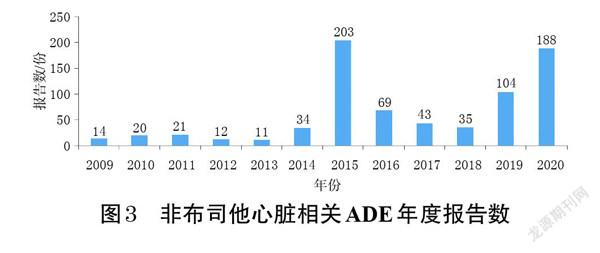
经数据整理后,一共得到ADE报告40 402 975份,其中以非布司他为首要怀疑药品的ADE报告有8 282份;经ROR法检测,非布司他ADR信号报告共有4 373份,含ADR信号209个,涵盖20个SOC,其心脏病症ADR信号数和报告数均位居第3,分别如图1、图2所示。
2.2 心脏病症信号
非布司他心脏病症信号共有27个,涉及ADE报告754份。结合内科学心脏疾病对信号进行归类可知,症状类信号上报数(262份,占34.75%)最多,包括头晕、外周水肿、胸痛、心悸、重力性水肿;随后依次为冠状动脉粥样硬化性心脏病信号、心力衰竭信号、心律失常信号、心脏性猝死信号(报告数分别为233、157、90、12份,占比分别为30.90%、20.82%、11.94%、1.59%)。其中,一半以上的信号在非布司他药品说明书中有所提及,而未被提及的信号主要为各种心力衰竭、心律失常、期前收缩等。非布司他心脏病症ADR信号如表2所示。
同时,笔者针对非布司他27个心脏病症信号,利用相同检测方法挖掘同时间段内别嘌醇的ADE报告,发现除不稳定型心绞痛、冠状动脉狭窄、慢性心力衰竭、左心室衰竭、心房扑动、猝死以外,其余21个非布司他心脏病症信号,别嘌醇均有相应的ADE报告,但是仅外周水肿、重力性水肿、心力衰竭、急性心力衰竭、心源性休克、室性心动过速、房室传导阻滞形成了信号,具体如表2所示。
2.3 心脏病症ADR信号报告分析
2.3.1 基本信息 非布司他27个心脏病症信号对应的754份ADE报告的患者性別、年龄、用药剂量、ADE发生时间等基本信息如表3所示。由表3可知,使用非布司他发生心脏相关ADE的患者中,男性多于女性;患者最小年龄为29岁,最大为98岁,主要集中在60岁及以上即老年人群;用药剂量多为药品说明书推荐剂量即40 mg/d或80 mg/d;ADE多在用药1个月内发生,用药当天至用药后7年余均有报告。
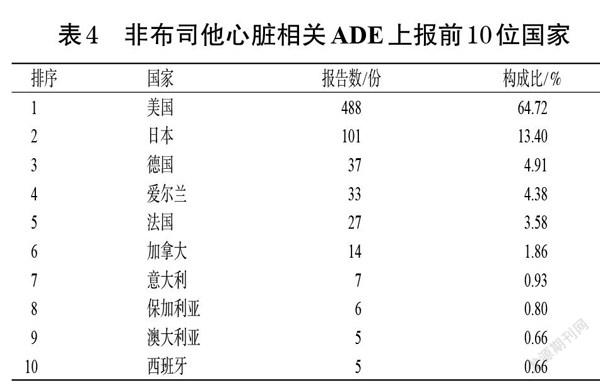
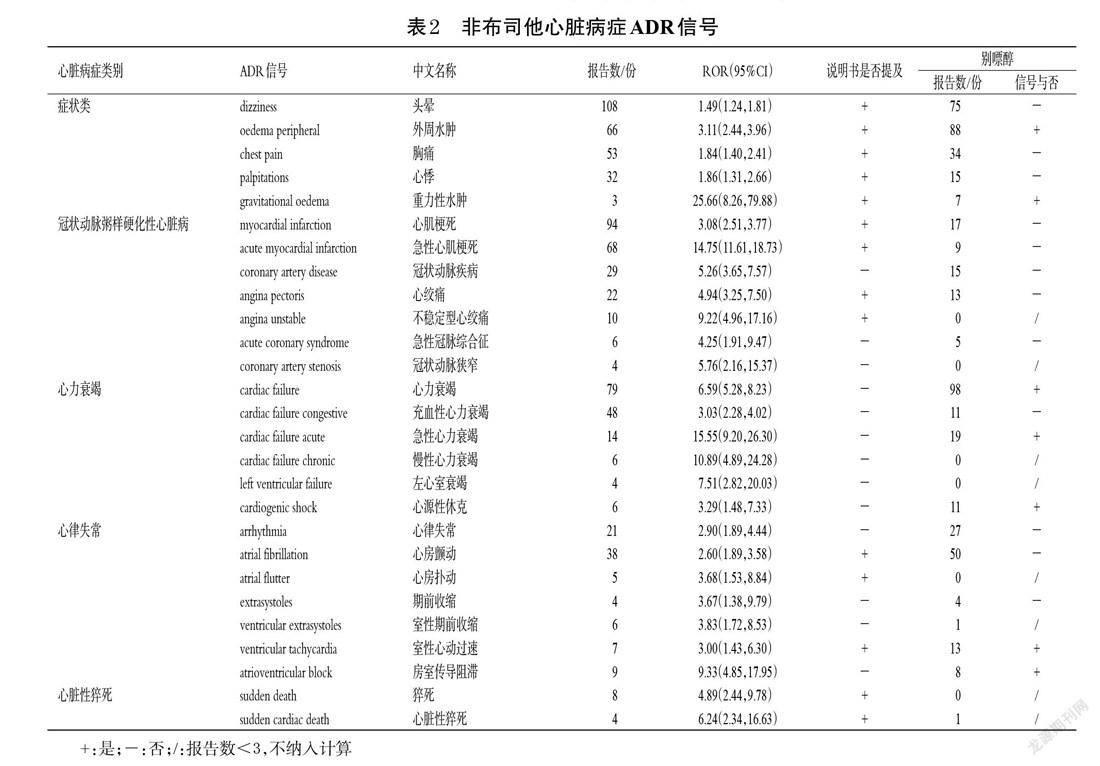
2.3.2 上报情况 754份ADE报告大多数集中在2015年(203份)、2019年(104份)和2020年(188份)上报(图3)。共有26个国家上报了非布司他的心脏相关ADE,其中64.72%(488份)发生在美国;亚洲国家中以日本发生得最多(101份);中国(含台湾地区)共上报2份。非布司他心脏相关ADE上报前10位国家如表4所示。此外,该类ADE上报者中,以医师最多(307份),其次为患者(199份),随后依次为其他卫生专业人员(138份)、律师(68份)和药师(21份)等。
3 讨论
本研究发现,自2019年美国FDA发布黑框警告以来,FAERS数据库中非布司他心脏相关ADE报告的上报数量较往年(2015年除外)上升明显,这可能与其临床使用增多有关,但同时该数据库为自发呈报系统,也存在一定的随机性。本研究共挖掘出非布司他心脏病症信号27个,包含了其药品说明书上记录的心脏ADR(心悸、心肌梗死、心绞痛、心房颤动、心房扑动、室性心动过速等),说明本研究方法具有一定适用性。另外,本研究还检测出(充血性)心力衰竭、心律失常、(室性)期前收缩等信号,为非布司他药品说明书未提及的ADR;同时,美国FDA黑框警告提示头晕、胸痛、水肿可作为心脏疾病症状[9],这些均表明非布司他实际发生的心脏ADR较其药品说明书所示更为多样,临床用药中需注意识别。此外,与同时间段别嘌醇的上报情况比较,非布司他的心脏病症ADE报告数和ADR信号数均更多,同时别嘌醇致(急性)心肌梗死、心悸均未形成ADR信号,致(心脏性)猝死ADE报告数太少,在一定程度上提示非布司他使用者相较于别嘌醇使用者具有更高的心血管事件发生概率,医师在应用非布司他时要注意监护患者的心脏ADR,特别是要关注其有无心肌梗死和卒中的症状和体征。
非布司他心脏ADR信号所涉及的人群特点和用药情况为:男性患者多于女性,年龄主要集中在60岁及以上,用药剂量多为药品说明书推荐剂量(40 mg/d或80 mg/d),心脏ADE多在用药1个月内发生,上报地区中日本上报量占第2位。结合痛风患病人群、药物用法用量和人种特征等情况,建议我国医师在应用非布司他时应常规关注患者的心脏ADE。此外,上报ADE的人群中,医师最多,其次为患者,药师最少,反映了越来越多的患者具备安全用药的意识,而药师在ADR监测方面尚可发挥更大的专业作用。
但是,本研究也存在一定局限性,需谨慎看待这些安全信号。首先,药品上市后确定的ADE是从未知数量的患者中自发报告的,因此不可能准确评估其发生频率或判定其与药品暴露的因果关系。其次,本研究中影响药品安全性的相关因素(如性别、年龄、剂量等信息)缺失较多,尤其是剂量,导致无法更细致地对该类ADR信号作出进一步预警。最后,数据挖掘产生的信号只是形成了某种假设或猜想,表明药品-ADE组合的信号有统计学关联,仅具有提示作用,需进一步采用适当的因果推断方法综合数据挖掘结果、临床试验结果及真实世界ADR案例等共同进行评价和验证[17-18]。
参考文献
[ 1 ] FUKAZAWA C,HINOMURA Y,KANEKO M,et al. Significance of data mining in routine signal detection:analysis based on the safety signals identified by the FDA[J]. Pharmacoepidemiol Drug Saf,2018,27(12):1402-1408.
[ 2 ] 国家药品监督管理局.相关政策:什么是药品不良反应信号?[EB/OL].(2011-07-05)[2021-01-20]. https://www.nmpa.gov.cn/xxgk/kpzhsh/kpzhshyp/20110705165101239.html.
[ 3 ] 赵洪琼,田晓江,唐学文,等.基于FDA不良事件数据库对甲巯咪唑与丙硫氧嘧啶药物风险信号的数据挖掘与评价[J].医药导报,2018,37(10):1261-1266.
[ 4 ] 王宇,饶友义,宁红,等.索非布韦神经精神不良反应的信号挖掘[J].医药导报,2019,38(5):663-667.
[ 5 ] KHANNA D,FITZGERALD J D,KHANNA P P,et al. 2012 American College of Rheumatology guidelines for management of gout: part 1:systematic nonpharmacolo- gic and pharmacologic therapeutic approaches to hyperuricemia[J]. Arthritis Care Res (Hoboken),2012,64(10):1431-1446.
[ 6 ] 中华医学会内分泌学分会.中国高尿酸血症与痛风诊疗指南:2019[J].中华内分泌代谢杂志,2020,36(1):1-11.
[ 7 ] SCHUMACHER H R Jr,BECKER M A,WORTMANN R L,et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout:a 28-week,phase Ⅲ,randomized,double-blind,parallel-group trial[J]. Arthritis Rheum,2008,59(11):1540-1548.
[ 8 ] WHITE W B,SAAG K G,BECKER M A,et al. Cardiovascular safety of febuxostat or allopurinol in patients with gout[J]. N Engl J Med,2018,378(13):1200-1210.
[ 9 ] FDA. FDA adds boxed warning for increased risk of death with gout medicine Uloric (febuxostat)[EB/OL].(2019-02-
21)[2021-01-20]. https://www.fda.gov/drugs/drug-safety- and-availability/fda-adds-boxed-warning-increased-risk-
death-gout-medicine-uloric-febuxostat.
[10] ZHANG M,SOLOMON D H,DESAI R J,et al. Assessment of cardiovascular risk in older patients with gout initiating febuxostat versus allopurinol:population-based cohort study[J]. Circulation,2018,138(11):1116-1126.
[11] MACKENZIE I S,FORD I,NUKI G,et al. Long-term cardiovascular safety of febuxostat compared with allopurinol in patients with gout (FAST):a multicentre,prospective,randomised,open-label,non-inferiority trial[J]. Lancet,2020,396(10264):1745-1757.
[12] 郭欽惠,方宏,陈俊文,等.非布司他药物相关不良反应文献分析[J].中国医学创新,2020,17(22):104-107.
[13] GANDHI P K,GENTRY W M,BOTTORFF M B. Cardiovascular thromboembolic events associated with febuxostat:investigation of cases from the FDA adverse event reporting system database[J]. Semin Arthritis Rheum,2013,42(6):562-566.
[14] FDA. Questions and Answers on FDA’s Adverse Event Reporting System (FAERS)[EB/OL].(2018-06-04)[2021- 01-20]. https://www.fda.gov/drugs/drug-safety-and-avai- lability/fda-adds-boxed-warning-increased-risk-death-gout-
medicine-uloric-febuxostat.https://www.fda.gov/drugs/
surveillance/questions-and-answers-fdas-adverse-event-
reporting-system-faers.
[15] 任经天,王胜锋,侯永芳,等.常用药品不良反应信号检测方法介绍[J].中国药物警戒,2011,8(5):294-298.
[16] PARK G,JUNG H,HEO S J,et al. Comparison of data mining methods for the signal detection of adverse drug events with a hierarchical structure in postmarketing surveillance[J]. Life (Basel),2020,10(8):E138.
[17] 张晓兰,夏佳.浅谈药物警戒中的安全信号与信号管理[J].药物流行病学杂志,2012,21(2):90-94.
[18] 钟燕,吴逢波,张志勇,等.应用Hill准则评价培美曲塞心血管不良事件信号的因果关系[J].中国医院药学杂志,2020,40(19):2064-2068.
(收稿日期:2021-09-27 修回日期:2021-12-30)
(编辑:胡晓霖)

