外周血中TAP含量预测Her-2阳性乳腺癌新辅助化疗疗效价值的研究
李景龙,朱德淼
(1.锦州医科大学附属第一医院;2.锦州医科大学,辽宁 锦州 121000)
乳腺癌新辅助化疗技术现已成为分子分型提示较差的局部晚期乳腺癌患者的一项极其重要的治疗手段。新辅助化疗技术的主要目的在于降低肿瘤的负荷,消灭残存的微小转移灶,提供有保乳意愿患者的保乳机会,指导后续辅助阶段治疗等。达到pCR的乳腺癌患者可望得到DFS(无进展生存期)及OS(总生存期)的获益[1]。据近期研究成果表明:随着对抗Her-2信号通路的小分子靶向药的问世,已接受过NAC(新辅助化疗)的Her-2阳性乳腺癌患者的pCR率远远高于已接受过新辅助化疗的TNBC(三阴型)与Luminal型患者[2],但是现行条件下的乳腺癌新辅助化疗疗效预测评估手段相对匮乏,传统的乳腺癌血清肿瘤标志物乳腺癌组和:癌胚抗原(CEA)、糖类抗原 153(CA-153)敏感性较差,特异度不高难以有效进行新辅助化疗疗效评估[3]。TAP是肿瘤的异常糖链蛋白,在肿瘤细胞增殖分裂过程中发挥重要作用,研究显示:TAP通过加速纺锤体的分裂的方式来提升肿瘤细胞中的DNA扩增速度,故血液中TAP的表达升高可能预测肿瘤患者病情进展[4]。本研究通过检测117例Her-2阳性乳腺癌患者接受TCbHP方案新辅助化疗前、后外周血中TAP值变化情况对新辅助化疗疗效进行预测。
1 资料与方法
1.1 一般资料
本次研究收集2019年1月至2022年6月于锦州医科大学附属第一医院乳腺外科接受新辅助化疗的Her-2阳性乳腺癌患者外周血中TAP含量,分析第1周期和第3周期新辅助化疗前TAP含量变化对新辅助化疗疗效的预测价值。本研究共纳入了117例Her-2阳性乳腺癌患者。按照术后病理结果进行分组,分为pCR组和non pCR组,纳入标准:(1)18岁以上,首次穿刺病理为浸润性导管癌乳腺癌的II期或III期患者,且经免疫组化病理及FISH检测证实为Her-2阳型;(2)无其他慢性内分泌系统疾病、风湿性疾病、心血管系统疾病、急性感染性疾病等影响TAP检查结果的病变,且符合新辅助化疗指征者;(3)在进入研究组前尚未做过其他影响乳腺病变的处理,包括进行手术、化疗、放疗、内分泌治疗、免疫治疗等;(4)病人知情并自愿参加本项研究,并了解该研究方法的基本状况和注意事项。排除标准:(1)临床资料掌握不完全的患者;(2)除已确诊的Her-2阳性乳腺癌外还同时伴有乳腺炎、炎性乳腺癌、Paget’s病、导管内原位癌、乳房良性肿瘤和伴发其他原发的恶性肿瘤疾患人;(3)在妊娠期期间或者哺乳期期间;(4)既往进行过的原发性其他类型的乳腺癌治疗,包括乳腺癌的放疗、化疗以及合并了其他罕见病例的病人。
1.2 实验方案
所有入组的Her-2阳性乳腺癌患者均选择csco指南IA类推荐的TCbHP方案:白蛋白结合型紫杉醇+卡铂联合曲妥珠单抗(汉曲优)、帕妥珠单抗(帕杰特),其中白蛋白结合型紫杉醇的用药剂量为260 mg/m2、卡铂的用药剂量按照指南指示为:AUC×6、曲妥珠单抗第1周期用量为体重×8 mg/kg,其余周期体重×6 mg/kg、帕妥珠单抗第1周期用量为840 mg,其余周期420 mg。化疗期间给予止吐、补液、保肝、心电监护等常规治疗。新辅助化疗疗程采用3周疗法即21天1个疗程。全部患者均完成6周期新辅助化疗,记录第1、3周期化疗前外周血中CEA、CA153及TAP含值并计算差值进行后续统计学分析。
1.3 TAP的检测方法
所有患者于第1、3周期新辅助化疗前采集手指末梢血液2~5 mL,恒温干燥后滴加相关凝集素后等待血液标本自然干燥。由专业病理科医师使用显微镜来观察所产生的特异形状的斑点凝集物,并测量其面积的大小,记录TAP的值。
1.4 疗效评价标准
根据MDAnderson肿瘤中心提出的RCB分级系统,计算乳腺浸润癌新辅助治疗后RCB评分。RCB-0与病理完全缓解(PCR)意义相同,表示浸润病灶已达到完全缓解;RCB评分0~1.36为Ⅰ级,可见微小浸润癌残留,浸润病灶部分缓解;1.37~3.28为Ⅱ级,可见中等程度浸润癌残留,浸润病灶部分缓解;评分>3.28为Ⅲ级,可见广泛浸润癌残留[5]。
1.5 统计学方法
采用SPSS 26.0软件进行统计学分析,采用均数±标准差对乳腺癌患者的TAP水平等计量资料进行描述,多变量分析采用多因素Logistic回归分析新辅助化疗PCR的影响因素,相关性采用Pearson法进行分析,采用MedCalc 19.0软件绘制ROC曲线,以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组患者病理学特征对比
HR的特性在pCR组和non pCR组之间的差别有统计学差异(P<0.05)。年龄大小,初始肿物是否超过2 cm,腋窝及锁骨上淋巴结是否发生转移,组织学病理分级,Ki-67的表达,P53的表达状态在pCR组和non pCR组中无明显差异(P>0.05),见表1。
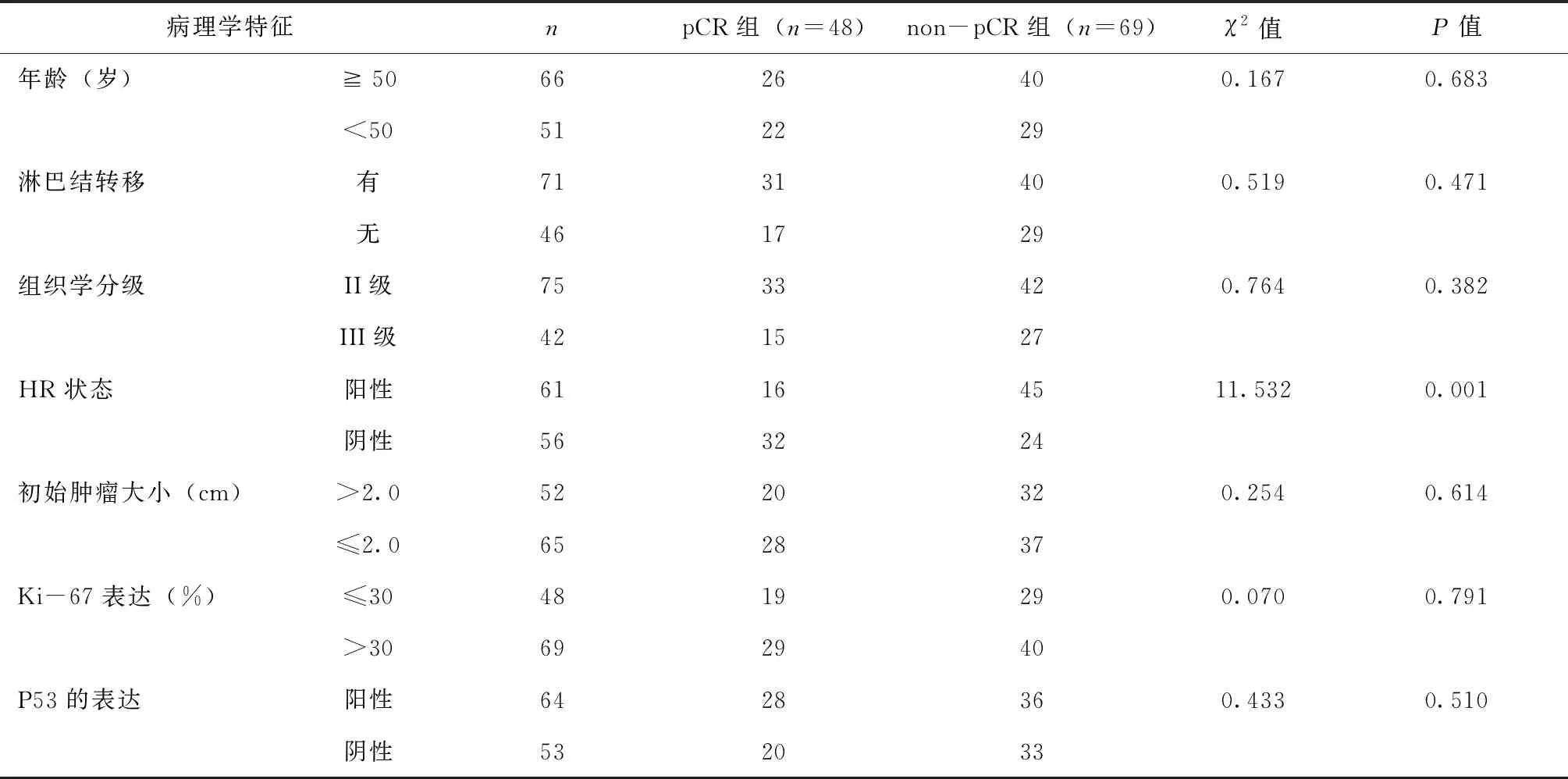
表1 两组患者病理学特征对比
2.2 两组患者CEA与CA153变化情况
肿瘤的CEA含量及CA153的含量在pCR组及non-pCR组中新辅助化疗前后的变化无明显差异(P>0.05),二者的差值在pCR组及non-pCR组中无明显差异(P>0.05),见表2。

表2 两组患者CEA,CA153变化情况
2.3 两组患者TAP变化情况
新辅助化疗前pCR组患者TAP含量(174.26±25.97)与non pCR组TAP含量(171.58±29.85)未见显著差异(P>0.05)。新辅助化疗后pCR组TAP含量(111.74±25.42)与non pCR组TAP含量(140.09±33.18)相比显著下降有统计学意义(P<0.05)。pCR组新辅助化疗前后的差值(62.53±12.00)与non pCR组新辅助化疗前后的差值(31.49±16.50)存在统计学差异(P<0.05),见表3。

表3 两组患者TAP变化情况
2.4 确定TAP含量差值的变化是达到pCR的影响因素的多因素分析
对第1周期及第3周期新辅助化疗前TAP含量的差值进行二元Logistic分析(将患者病理学完全缓解和非病理学完全缓解作为因变量,以TAP值作为自变量),分析后的结果明显显示:Her-2阳性乳腺癌患者在接受新辅助化疗后能否达到pCR的一项重要影响因素是TAP含量的差值(P<0.01)。将差异有统计学意义的TAP差值变化进行ROC曲线分析,探讨TAP含量的变化对Her-2阳性乳腺癌在新辅助化疗疗效中的预测价值。发现曲线下方面积88.70%,0.766是ROC曲线下对应的最大约登指数,而最大约登指数对应的曲线的截断值为40.9 μm2。Her-2阳性乳腺癌患者新辅助化疗两周期结束后TAP含量降低达到40.9 μm2以上的患者更容易达到pCR,见表4、表5、图1。

表4 二元Logistic回归分析

表5 ROC曲线分析
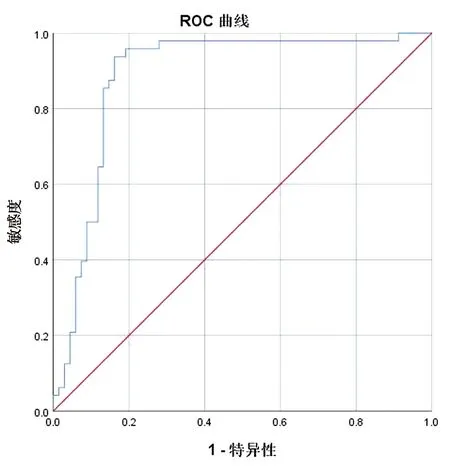
图1 ROC曲线分析
3 讨 论
乳腺癌现已成为在妇女人群中较为普遍的恶性肿瘤之一,而乳腺癌按照其分子类型又可粗略分成4个分子类型:Luminal A型、Luminal B型、Her-2扩增型、三阴型,其中Her-2扩增型约占20%~25%[6-7]。随着对抗Her-2靶点的分子靶向药效不断提高,产品日新月异。对于Her-2阳性乳腺癌患者的治疗手段也出现了更多、更好、更个体化的选择,特别是曲妥珠的问世较大程度地改善了患者的生存预后以及生活质量。曲妥珠单抗阻断Her-2受体细胞外IV区的同时联加用帕妥珠单抗可以继续阻断Her-2受体细胞外II区,二者发挥协同作用,进而提高NAC治疗的pCR率[8]。根据研究显示,Her-2阳性型乳腺癌在双靶联合化疗下可望获得更高的pCR率,达到pCR的患者可以获得DFS和OS的获益[9]。
尽管Her-2阳性乳腺癌相比于其他类型乳腺癌接受NAC后pCR率较高,但受其他诸多因素影响,比如:肿瘤负荷状态,HR表达状况,依然有相当一部分患者在接受NAC后出现肿瘤退缩不佳的情况,在对影响患者能否达到pCR的临床及病理特征分析中,我们的结果显示HR的性质与pCR息息相关,HR阴性的患者相较于HR阳性的患者更容易达到pCR,这可能与内分泌受体的表达导致恶性肿瘤细胞对曲妥珠单抗及帕妥珠单抗产生了耐药性[10]。也可能是因为在双分子靶向治疗过程中内分泌受体基因与Her-2基因之间产生有新型信号分子通路的产生,从而影响了分子靶向治疗的疗效[11-12]。探索新辅助化疗早期就能预测疗效的指标,以便医生能尽早调整化疗方案,可能是提高pCR率的有效手段。临床上对NAC疗效评价手段较为局限,主要依靠影像学和病理学检查、彩超或增强核磁共振的方式测量肿瘤最大径变化情况来评估疗效具有一定滞后性并且对肿瘤成分变化无法评价。穿刺病理活检的方式通过分析肿瘤密度变化来判断新辅助化疗疗效,但因为有创操作,患者医从性往往较差[13]。因此在对Her-2阳性乳腺癌NAC治疗中需要更多敏感、有效的疗效评估手段。
大部分恶性肿瘤在发生、发展过程中都会引起外周血中肿瘤标志物含量的变化,肿瘤标志物的检测创伤小,费用低,尤其是外周血的肿瘤标志物检测更易于患者接受[14]。CEA及CA15-3这一对常规的乳腺癌组和作为预测肿瘤发生、发展的肿瘤生物学标记物已经多年应用于乳腺癌患者的临床实践当中,能否有效快速地评价Her-2阳性乳腺癌的新辅助化疗疗效?在我们的实验成果表明:新辅助化疗开始前与用药后CEA与CA153值的变化并不能有效预测新辅助化疗疗效,见表2、表3。TAP是一种新颖的肿瘤标志物,当正常的上皮细胞发生癌性病变时,存在于细胞表面的糖链蛋白会发生变化,产生多种的异常糖连蛋白及钙组蛋白的复合物。这种多样复合物统称为肿瘤异常糖链蛋白(TAP),当TAP在血中达到一定浓度,通过外周血即可检测,方便易行。大量研究表明,外周血中TAP的含量与癌细胞的扩散、转移等恶性生物学行为密切相关[15-17]。本项研究采用了分析117个Her-2阳性乳腺癌患者的辅助化疗病人的临床数据,结果表明:Her-2阳性乳腺癌在新辅助化疗联合双靶治疗的条件下pCR率较高,其中有48例患者的术后病理结果达到病理性完全缓解(pCR),69例患者未达到病理性完全缓解。对比两组患者第一、三新辅助化疗周期前TAP含量,我们发现pCR组患者的TAP值较non pCR组TAP值显著下降,差异有统计学意义。pCR组的TAP下降值较non pCR组TAP下降值显著升高,差异有统计学意义,以上结论提示TAP值变化对NAC的疗效可能具有预测作用。二元Logistic数据分析结果表明:TAP数值的下降差与接受新辅助化疗病人能否获得pCR显著有关,因此可以作为预测新辅助化疗效果的独立影响因素。ROC曲线分析通过计算约登指数(敏感度+特异度-1)结果显示:当TAP值下降达到40.9 μm2以上时接受新辅助化疗的Her-2阳性患者最容易达到pCR。
综上所述,对Her-2阳性病人进行新辅助化疗以及联合靶向疗法时,TAP含量的改变也与治疗效果可能有关,达到pCR的患者化疗前、后TAP值下降较高。对于Her-2阳性型乳腺癌患者接受新辅助化疗后能否达到pCR可能具有一定预测作用,尤其是当第3周期新辅助化疗用药前TAP值较第1周期新辅助化疗用药前的TAP值下降达到40.9 μm2以上的这部分患者通过新辅助化疗的更容易达到pCR。外周血中TAP含量可能成为新辅助化疗疗效评估的有效手段之一,对指导新辅助化疗方案调整,提高pCR率具有一定的临床价值。

