核桃JrPUBs(U-box)基因家族鉴定与响应冷温胁迫基因筛选
姬新颖,冯启科,刘志月,刘 凯,张俊佩,王红霞
(1.中国林业科学研究院 林业研究所/ 国家林业和草原局林木培育重点实验室,北京 100091;2.河北农业大学 山区研究所/河北省山区农业技术创新中心/国家北方山区农业工程技术研究中心,河北 保定071000;3.河北农业大学 园艺学院,河北 保定 071000)
核桃树体高大,在我国分布范围广,由于存在生物逆境、非生物逆境(特别是倒春寒和晚霜),严重限制了核桃产业的健康发展[1]。泛素化修饰在植物响应低温胁迫、干旱胁迫和光胁迫等非生物胁迫的过程中具有重要作用,主要由E1( 泛素激活酶)、E2 (泛素结合酶)、E3(泛素连接酶)完成[2-4]。U-box 型蛋白属于E3 连接酶,因其含有U-box保守结构域而得名,自1995 年从酵母蛋白UFD2中首次鉴定出具有70 多个氨基酸组成的U-box 蛋白[5],陆续又在拟南芥、水稻、香蕉、番茄、柑橘[6-10]等植物中鉴定了U-box 基因家族。Cho 等研究指出拟南芥PUB22和PUB23在干旱胁迫下能够泛素化RPN12a 来改善植株抗旱能力[11];Wang等研究揭示了PUB25和PUB26在冷诱导下泛素化MYB15,在拟南芥低响应低温胁迫中具有精确调节作用[12];Bergler 等研究指出PUB18/PUB19在ABA 诱导或盐胁迫中可能作为调节成分协同作用[13];Li 等研究指出PUB12/PUB13负调控植物体内的SA 积累、正调控JA/ET 信号传递进而调控植物抗性[14]。除了模式植物拟南芥,在水稻、苹果、苜蓿、大豆等植物中也发现了与抗性相关的U-box泛素连接酶。Min 等研究表明水稻U-box 型E3 泛素连接酶OsPUB24 通过OsBZR1 的26S 蛋白酶体依赖性降解在BR 信号通路中起负调节作用[15];Byun等研究证实2 种同源水稻U-box E3 连接酶OsPUB2和OsPUB3 是对冷应激反应的正调节因子[16];Han 等 表 明 苹 果(Malus×domesticaBorkh.) 中MdPUB29可能正调控耐盐性[17];前人研究表明U-box 基因家族在响应冷胁迫过程中起到重要作用,而有关核桃中U-box 基因家族的鉴定和分析尚未见报道。本研究通过生物信息学在核桃基因组中挖掘JrPUBs(U-box)家族成员,并对该家族成员结构进行分析,结合低温胁迫转录组数据对该家族差异表达基因在不同组织中的表达特异性以及对低温胁迫和激素的响应,解析核桃JrPUBs基因家族的生物学功能。
1 材料与方法
1.1 材料与处理
供试材料为盆栽的2 年生嫁接苗[嫁接‘辽宁8 号’(耐冷)和‘清香’(不耐冷)],本砧,盆栽。采样及测序参照刘凯[18-19]方法。测序数据已上传至国家基因组科学数据中心(https://bigd.big.ac.cn/?lang=zh),项目 ID 为PRJCA006073,并结合转录组分析对家族成员进行鉴定。
1.2 核桃JrPUBs 基因家族分析
核桃JrPUBs家族成员鉴定参照代文强和李津津等[20-21]方法。核桃JrPUBs 家族基因的基因结构和保守基序使用在线分析工具Gene Structure Display Server 和MEME(http://meme-suite.org/)进行分析。JrPUBs 和AtPUBs 家族系统发育树的构建使用利用MEGA7.0 软件,采用生物进化距离法(Neighbour-Joining, NJ)进行构建,Bootstrap 值为1 000。
1.3 核桃JrPUBs 基因的生物信息学分析
分别利用https://www.ncbi.nlm.nih.gov/orffnder/查找开放阅读框,利用https://web.expasy.org/ protparam/查找蛋白质的分子量、疏水性和稳定系数,利 用NetPhos 3.1 Server 和Net NGlyc 1.0 Server 进行糖基化和磷酸化位点的预测,利用http://www.cbs.dtu.dk/services/SignalP 进行信号肽预测,利用http://www.cbs.dtu.dk/services/TMHMM/进行跨膜区预测,利用Plantcare 在线工具查找启动子序列功能。
2 结果与分析
2.1 核桃基因组JrPUBs 家族成员鉴定
构建PUB基因的隐马尔科夫模型,结合转录组测序,从核桃全基因组序列中鉴定出85 个核桃PUBs家族基因。利用Pfam 进行结构域分析,去除冗余后最终得到55 个核桃PUB基因(表1),编码55 条蛋白质序列。由表2 可知,JrPUB 蛋白的长度在169(JrPUB42)~1 505 AA(JrPUB33)之间;等电点在5.08 ~9.03 之间,有62% 核桃JrPUBs家族成员为偏酸性蛋白。JrPUBs基因长度在555(JrPUB8)~10 277 bp(JrPUB49)范围内;开放阅读框长度在510(JrPUB42)~4 518 bp(JrPUB33)范围内;外显子除JrPUB49和JrPUB16以外在1 ~8个之间,43%的JrPUBs只含有1 个外显子,内含子除JrPUB49和JrPUB16以外在0 ~7 个之间。

表1 核桃JrPUBs 家族成员的基因信息Table 1 Basic information of JrPUBs family genes in walnut
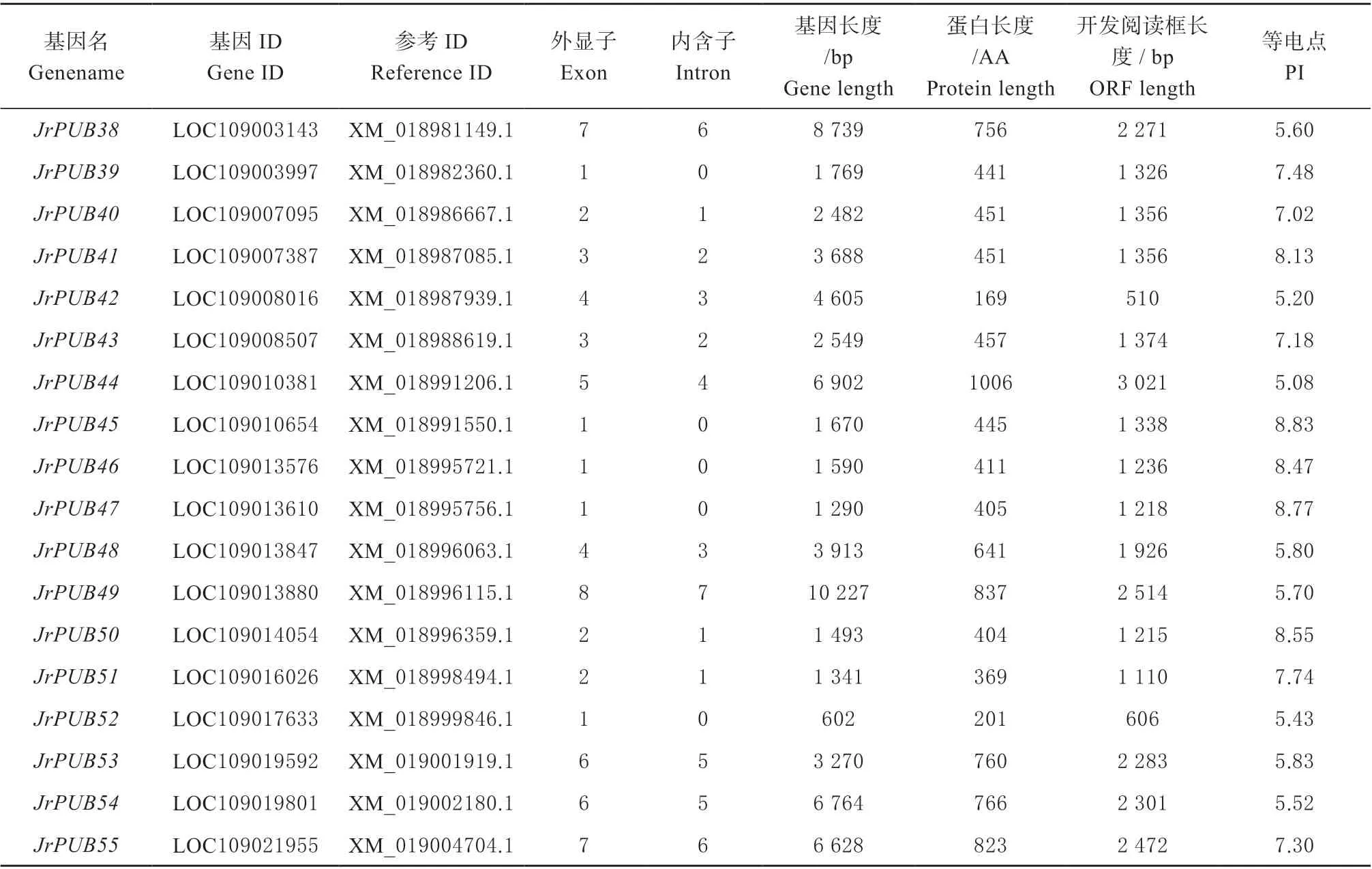
续表:
由表2 可知,JrPUBs 分子量最大为167.90(JrPUB33)kD, 最 小 为21.08(JrPUB8)kD;JrPUBs 蛋白的不稳定系数在34.64(JrPUB30)~58.51(JrPUB6)之间,不稳定蛋白占82%,稳定蛋白仅为18%;从JrPUBs 蛋白的平均疏水性预测数据来看,亲水蛋白占75%,疏水蛋白仅占25%;蛋白质的信号肽和跨膜结构预测结果显示:核桃JrPUBs 家族中53 个成员无跨膜结构和,仅有2 个成员(JrPUB4 和JrPUB13)有跨膜结构,2 个成员(JrPUB1 和JrPUB40)有信号肽分泌蛋白;仅有JrPUB44 蛋白定位于细胞核和细胞质,其他均位于细胞核。分析核桃JrPUBs 家族成员在蛋白翻译后修饰的差异有助于后续对蛋白功能的研究。
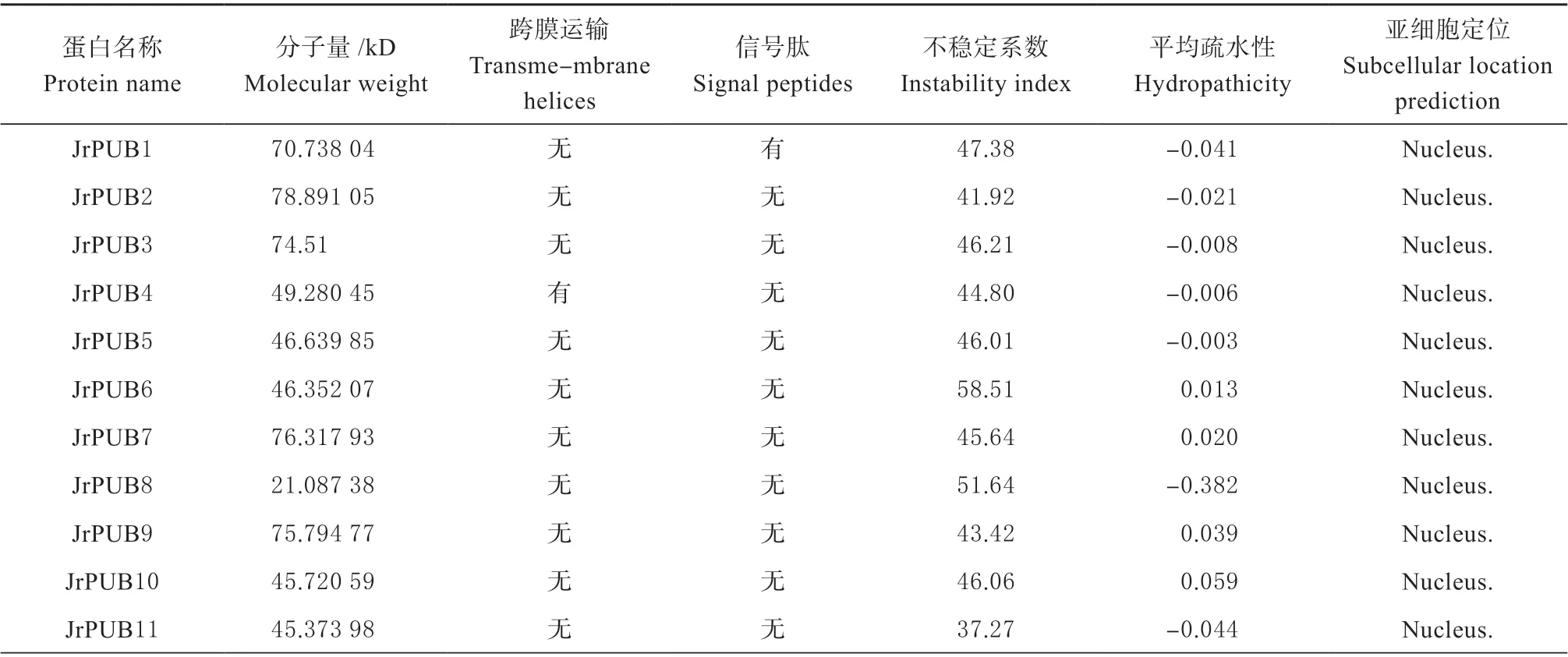
表2 核桃JrPUBs 家族蛋白的理化性质Table 2 Basic information of JrPUBs family proteins in walnut

续表:
2.2 核桃基因组JrPUBs 家族系统进化树分析
利用MEGA7.0软件将本研究筛选出的核桃(55个)与拟南芥(61 个)PUBs 蛋白序列进行了系统发育分析(图1)。结果发现,核桃与拟南芥PUBs 家族基因有一定的同源性,将核桃55 个家族成员分为2 类,一类是与拟南芥Class2 聚到一起的30 个蛋白,另一类是与拟南芥Class3 聚到一起的25 个蛋白,表明核桃JrPUBs 与拟南芥相似成员具有不同生物学功能。
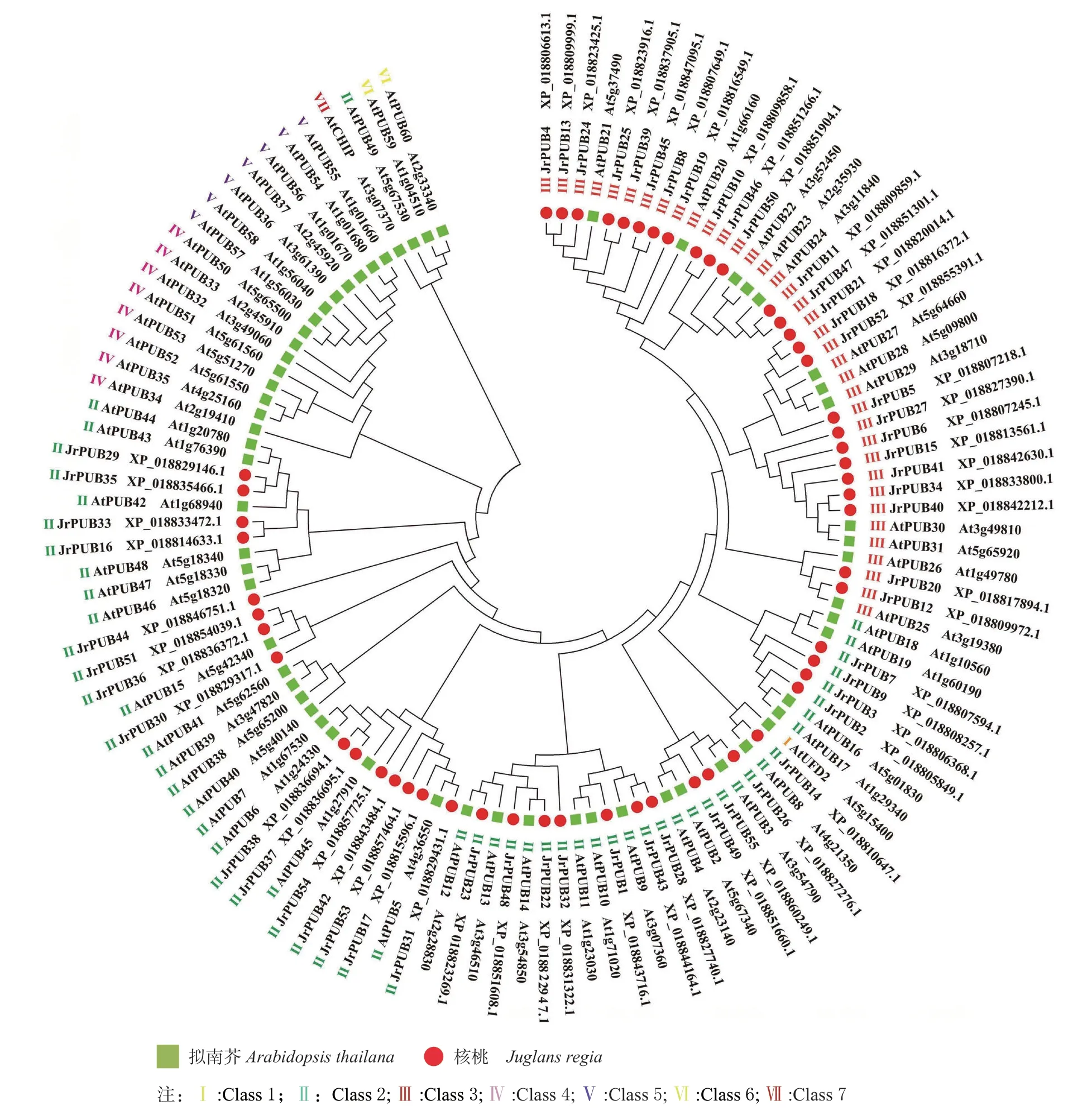
图1 核桃和拟南芥PUBs 家族基因的系统发育树分析Fig.1 Phylogenetic tree of JrPUBs family genes of Juglans regia and Arabidopsis thaliana
2.3 核桃基因组JrPUBs 家族蛋白域保守基序与基因结构
由图2 可知,分析其保守基序分布,数量最多的亚组为第10 组,含有13 个成员;最少的为第5组,仅含有1 个成员JrPUB27。不同亚家族内具有极高相似度的保守基序,而且不同亚家族中分别含有自己特有的保守基序。通过基因结构分析可以看出(图3),核桃基因组JrPUBs家族成员均包含内含子,数量1 ~17 个不等,相同亚组中的基因具有相似的基因结构。
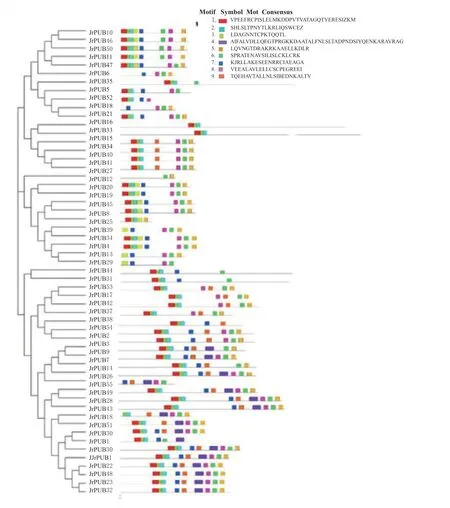
图2 核桃JrPUBs 家族蛋白保守基序分析Fig. 2 Conserved motif analysis of JrPUBs family from Juglans regia

图3 核桃JrPUBs 家族基因结构分析Fig. 3 Gene structure analysis of JrPUBs family from Juglans regia
2.4 核桃PUBs 家族基因启动子元件分析
由图4 可知,核桃PUBs家族基因启动子区分布着大量的激素信号和胁迫反应元件,可能与核桃响应非生物胁迫相关。
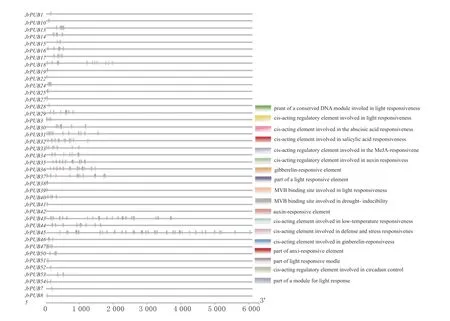
图4 核桃JrPUBs 启动子区与抗逆和激素相关元件分布Fig.4 Stress and hormone related cis-elements in the promoter region of JrPUBs genes
2.5 核桃PUB 家族成员的表达分析
以 FPKM 为转录水平描述标准,以padj<0.05 and log2(FC) >1 为差异表达基因筛选标准, ‘辽宁 8 号’(耐低温)和‘清香’(不耐低温)在冷胁迫48h 后共获得了15 个差异表达基因,分别 是JrPUB3、JrPUB7、JrPUB9、JrPUB12、JrPUB17、JrPUB18、JrPUB20、JrPUB21、JrPUB23、JrPUB26、JrPUB32、JrPUB35、JrPUB40、JrPUB42、JrPUB48。由图5 可以看出,该家族15 个成员在冷胁迫下转录水平都发生了不同程度的变化,推测该15 个基因可能会参与核桃响应冷胁迫的过程。对该15 个差异表达基因进行不同组织转录水平分析,发现该15 个差异表达基因存在特异性转录表达,JrPUB7、JrPUB9、JrPUB17、JrPUB18、JrPUB20、JrPUB21在根中转录水平较高;JrPUB42和JrPUB48在老叶中转录水平较高;JrPUB3、JrPUB9和JrPUB12在老叶中转录水平较低;JrPUB42在嫩茎和雄花中转录水平较低。以上说明该家族15 个成员可能响应冷胁迫并参与植物器官发育。
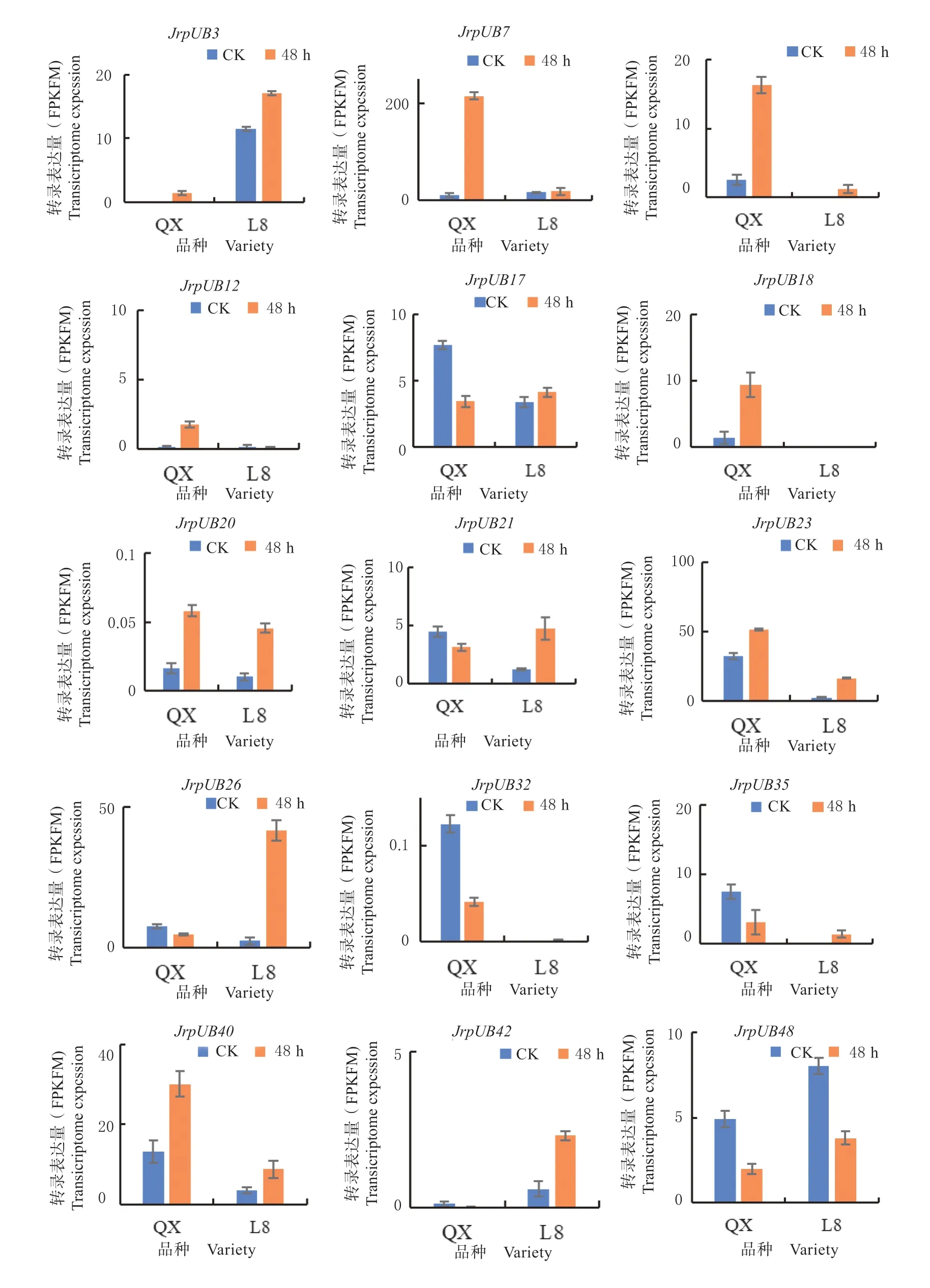
图5 冷胁迫48 h 后‘辽宁8 号’与‘清香’DEGs 转录表达分析Fig.5 Transcriptional analysis of DEGs in ‘Liaoning NO.8’ and ‘Qingxiang’ under chilling stress for 48 h
3 讨论与结论
随着全基因组的测序,多个植物中u-box 家族已经被鉴定,如雷蒙德氏棉93 个[5],拟南芥64 个[6],番茄56 个[9],柑橘56 个[10]等。Xu 等利用M.truncatula幼苗在3 种不同非生物胁迫下的RNA-seq 数据,鉴定出33 个胁迫诱导植物U-box 基因(MtPUBs),包括到25 个NaCl、15 个干旱和16 个冷调控的MtPUB[22]。本研究鉴定出55 个核桃PUBs家族基因,并对结构进行分析,增加了植物PUBs家族的种类,也为进一步研究核桃PUBs基因提供了理论依据。此外,不同植物间PUBs基因数目的差异可能与物种有关,也可能与全基因组复制次数不同有关[23]。

图6 PUB 家族差异表达基因在不同组织中的表达分析Fig. 6 Expression analysis of PUB family genes in different tissues
本研究对核桃与拟南芥JrPUBs家族基因进行了系统发育分析,核桃 U-box 与拟南芥具有相同结构域的成员聚在一起,全部聚类到拟南芥2 和3 亚族,表明核桃JrPUBs与拟南芥相似成员具有不同生物学功能。进行启动子功能预测发现核桃PUBs基因启动子区存在丰富的激素信号和胁迫应答调控元件,核桃U-box 基因启动子区至少含一个植物激素响应元件。前人研究表明拟南芥中的AtPUB19对ABA和干旱反应有负调控作用[24],Kong L 等研究表明AtPUB12和AtPUB13正向调控ABA 信号途径[25],但AtPUB9 与ABI3 互作,负向调控ABA 信号通路[26];这些研究与本研究的预测一致,进一步证明了U-box 可能参与核桃响应非生物胁迫和生物胁迫。
通过冷胁迫转录表达分析共获得了15 个差异表达PUB基因,在冷胁迫下转录水平都发生了不同程度的变化,推测该15 个基因可能会参与核桃响应冷胁迫的过程。对该15 个差异表达基因进行不同组织转录水平分析,发现该15 个差异表达基因存在特异性转录表达,在不同的组织和不同的处理下存在表达差异。说明该家族15 个成员可能响应冷胁迫并参与植物器官发育。这些研究将为我们解析核桃U-box基因功能验证奠定基础,但具体作用机制有待进一步研究。

