芍药苷保肝药理作用及新剂型的研究进展
袁腾腾,王雷,唐亚楠,胡子晗,杜娇娇,王汝琳,张彩云*,陈卫东*
(1.安徽中医药大学药学院,安徽 合肥 230012;2.中药复方安徽省重点实验室,安徽 合肥 230012;3.现代药物制剂安徽省工程技术研究中心,安徽 合肥 230038)
芍药苷(paeoniflorin,PF)来源于芍药科植物芍药根、牡丹根和紫牡丹根,是一种单萜糖苷类化合物[1]。作为中药芍药的主要活性成分,PF具有多种药理作用,如保肝、抗炎、镇痛、抗抑郁、降低心肌耗氧量等[2]。然而,PF是一种高水溶性的酚类化合物,脂溶性差,不易通过细胞膜,虽然在一些疾病的治疗中表现出明显的优势,但起效较慢,生物利用度较低,限制了其广泛应用[3]。近年来,为改善PF的理化性质,针对PF剂型改造的研究越来越多,如将其制备成磷脂复合物、醇质体、脂质体等剂型可提高PF的生物利用度和药效。本文围绕PF的保肝药理作用和机制及相关新剂型的研究进行综述,以期为PF的应用和新剂型开发提供参考思路。
1 芍药苷保肝药理作用及机制
肝脏作为腹腔中最大的实质性器官,其功能复杂多样,主要包括代谢、合成、生物转化、分泌和排泄胆汁等。当肝脏功能受到损坏时,导致肝细胞坏死凋亡,从而引起肝衰竭。目前,肝脏疾病主要包括胆汁淤积性肝损伤、非酒精性脂肪肝(NAFLD)、肝纤维化、肝癌(HCC)及肝脏缺血/再灌注(I/R)损伤等。阐明各种肝脏疾病的发生发展机制,寻找有效治疗药物,减少该病的发病率与死亡率是人类世界亟须攻克的难题。
1.1 抗胆汁淤积性肝损伤 胆汁淤积性肝病包括原发性胆管炎(PBC)、原发性硬化性胆管炎(PSC)和雌激素所致胆汁淤积等。胆汁的积聚和成分的改变对肝细胞和胆管均有毒性作用,导致损伤和炎症。如果治疗延迟,可能会进一步发展为肝纤维化、肝硬化甚至肝癌[4]。研究报道,胆管结扎、α-萘异硫氰酸酯(ANIT)、雌激素和脂多糖(LPS)等是常用的用于模拟胆汁淤积性肝损伤的动物模型[5]。有趣的是,胆汁淤积的发病机制与诸多信号通路的调节有关,主要涉及炎症通路、肝脏转运蛋白表达失调以及肝组织氧化应激损伤等。
PF作为我国传统中草药芍药的主要活性成分已广泛应用于肝脏疾病中。研究报道,PF(0.2、0.1或0.05 g·kg-1)能显著抑制ANIT诱导的血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、血清总胆红素(TBIL)、直接胆红素(DBIL)、总胆汁酸(TBA)和γ-谷氨酰转肽酶(γ-GT)的变化,且组织学检查显示,PF对大鼠肝损伤和胆管增殖有明显的缓解作用。发挥这一保护作用的机制是通过磷脂酰肌醇-3-羟激酶(PI3K)/蛋白激酶B(Akt)依赖通路激活核因子红细胞相关因子2(Nrf2),增加谷胱甘肽(GSH)的合成[1]。此外,PF具有潜在的抗氧化作用,Zhao等[6]研究证明高剂量(0.2 g·kg-1)和中剂量(0.1 g·kg-1)的PF能显著抑制一氧化氮和丙二醛的生成,并能恢复ANIT引起的谷胱甘肽的减少;实验数据表明PF能抑制ANIT介导的活性氧(ROS)生成,可明显逆转ANIT诱导还原性烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NOX4)的过表达,提示PF可以通过抑制NOX4的表达来清除ROS。肝脏转运蛋白的调节、炎症反应和凋亡途径也是ANIT诱导的胆汁淤积性肝损伤的重要机制。胆汁酸的合成和分泌离不开位于肝细胞小管膜和基底外侧膜上的转运蛋白的操纵,包括小管转运体(BSEP和MRP2)和基底外侧转运体(NTCP)。它们的主要职责是负责胆汁酸和外源性物质的摄取和流出,PF(200和50 mg·kg-1)显著升高NTCP、MRP2、BSEP的表达,从而改善胆汁淤积所致的胆汁酸的积聚;核因子-κB(NF-κB)是将炎症信号从细胞质转移到细胞核的关键因子,诱导肝细胞中一系列炎症因子,主要包括白介素-1β(IL-1β)、白介素-6(IL-6)和肿瘤坏死因子(TNF-α)。PF处理后,肝组织中NF-κB和IL-1β的表达降低[7];细胞凋亡是胆汁淤积过程中胆汁酸介导损伤的主要结果。线粒体膜蛋白B细胞淋巴瘤-2(Bcl-2)和Bax基因(Bax)位于不可逆细胞损伤的上游,直接作用于线粒体,是凋亡的关键调控因子,而细胞色素c位于线粒体内外膜之间,它从线粒体释放到胞质中从而激发下游半胱氨酸天冬氨酸特异性蛋白酶(caspase)级联反应,激活caspase-9,随后激活caspase-3。因此胆汁酸被认为能直接引起线粒体细胞毒性,从而激活细胞凋亡的内在途径。Zhou等[8]研究证实PF(0.2、0.1和0.05 g·kg-1)能显著降低ANIT所致的促凋亡基因(Bax、caspase-9和caspase-3)表达的增加,同时逆转抗凋亡基因Bcl-2的表达增强,PF可通过线粒体依赖途径抑制体内细胞凋亡,从而减轻ANIT诱导的胆汁淤积。
PF也可通过干预胆汁酸代谢的相关靶点,在胆汁淤积性肝损伤的治疗中发挥关键作用。在胆管结扎的胆汁淤积大鼠中,采用超高效液相色谱-四级杆串联飞行时间质谱(UPLC-Q-TOF-MS)法对其血清进行分析,同时使用代谢组学的方法筛选出特异性代谢产物。在对胆汁淤积症大鼠肝组织进行靶点验证时,PF(200和50 mg·kg-1)可促进这些蛋白(MAP2K1、MAPK1、ILBP、ABCB1和LTA4H)的表达[9]。
1.2 抗非酒精性脂肪肝 非酒精性脂肪肝(NAFLD)是指除酒精和其他明确肝损伤因素所致的以肝脏中脂肪过度沉积为主要表现的临床病理综合征[10]。NAFLD发生发展的机制是复杂的、多因素的。现有的研究主要遵从“多重打击”学说,主要包括以下几个几点:①胰岛素抵抗;②线粒体功能失调;③氧化应激和ROS的产生;④内质网(ER)应激;⑤炎症通路的激活和促炎细胞因子的释放;⑥直接毒性和凋亡激活机制等[11]。由于传统中药多成分、多靶点的独特性质,已被应用于各种疾病的研究中。研究表明PF可以通过多种信号通路抑制NAFLD的发生。在高脂饮食(HFD)诱导的NAFLD大鼠中,20 mg·kg-1的PF治疗可显著降低肝脏指数,降低血清总胆固醇、游离脂肪酸、ALT和AST水平且病理损伤减轻。此外,PF治疗可显著降低肝脏的脂质积聚,发挥这一作用的机制是PF通过调节脂质代谢、抑制氧化应激和调节IRS/Akt/GSK3β等通路来实现的[12]。在进一步的研究中,PF[20 mg·(kg·d)-1]显著降低高胆固醇高脂肪(HCF)饲料诱导NASH大鼠的血清ALT和AST的活性,显著降低总胆固醇、低密度脂蛋白和TNF-α水平。同时,PF可改善肝脏脂肪变性和炎症,抑制CD68和转化生长因子β1(TGF-β1)的表达。PF减轻大鼠NAFLD的机制可能还与下调肝组织Rho激酶(ROCK)活性和抑制 NF-κB信号通路的激活有关[13]。在探究PF对果糖诱导的胰岛素抵抗和肝脂肪变性的影响中,Li等[14]研究发现PF(10~40 mg·kg-1)提高了肝脏中AMP激活的蛋白激酶(AMPK)和PKB/Akt的磷酸化水平,抑制了乙酰辅酶A羧化酶1(ACC1)的磷酸化;提高了肝脏肉碱棕榈酰转移酶(CPT)-1 mRNA和蛋白的表达,降低了固醇调控因子结合蛋白(SREBP)1c、硬脂酰辅酶A脱羧酶(SCD)-1和脂肪酸合成酶(FAS)mRNA的表达。此外,PF还显著增加了肿瘤抑制因子丝氨酸/苏氨酸激酶(LKB)1的肝脏蛋白表达,但不增加Ca2+/CaM依赖性蛋白激酶激酶(CaMKK)β的表达。提示PF的保护作用可能与激活LKB1/AMPK和胰岛素信号通路有关,从而抑制脂肪生成,激活β-氧化和糖生成,改善胰岛素抵抗和肝脏脂肪变性。在添加0.05% PF饮食处理的NAFLD模型中,PF发挥保护作用机制是通过阻断炎症基因的激活和降低糖异生基因的表达所介导的[15]。
1.3 抗肝纤维化 肝纤维化是大多数慢性肝损伤的病理反应的结果,是一种由病因引起的轮廓刺激转化为病理状态的生理过程[16]。各种类型的慢性肝损伤可导致肝纤维化,逐渐发展为肝硬化,并可导致肝癌[17]。肝纤维化的标志是结缔组织成分的过度合成和异常沉积,特别是肝外细胞基质中的间质胶原[18]。而在放射性肝纤维化的研究中发现PF可显著减轻肝损伤,减少胶原沉积,PF(20、40和80 mg·kg-1)可下调信号蛋白Smad3/4和转化生长因子(TGF-β1)的表达,上调Smad7的表达。因此,PF可能通过调节TGF-β1/Smads信号通路抑制放射性肝纤维化[19]。在对四氯化碳(CCl4)诱导的小鼠肝纤维化模型中,PF(100 mg·kg-1)可明显改善肝损伤小鼠的肝功能和肝组织病理。PF干预后,血清单胺氧化酶(MAO)酶活性和羟脯氨酸含量显著降低。且波形蛋白(vimentin)、细胞骨架蛋白(α-SMA)、I型胶原蛋白(Col1a)和肌间线蛋白(desmin)的表达下降表明肝星状细胞活化受到抑制。有趣的是,PF干预显著上调了血红素加氧酶-1的表达,减轻了炎症细胞因子的产生以及CCl4诱导的氧化应激失衡。可见PF通过上调血红素加氧酶-1来调节氧化应激、炎症和肝星状细胞活化以减轻CCl4诱导的小鼠肝纤维化[20]。在对CCl4大鼠和HSC-T6细胞株进行肝纤维化实验中,PF(80~200 mg·kg-1)治疗可减轻肝纤维化,抑制HSC活化。PF通过降低血清ALT、AST、ALP水平,升高白蛋白(ALB)、总蛋白(TP)水平,显著增强肝功能。PF可抑制细胞外基质的降解,显著降低α-SMA和Ⅲ型胶原mRNA的表达。其机制是PF通过mTOR依赖途径抑制缺氧诱导因子-1α减轻肝纤维化[21]。
在探究二甲基亚硝胺(10 mg·kg-1)诱导的大鼠模型中潜在的抗纤维化作用,Chen等[22]发现,PF[20 mg·(kg·d)-1]处理的肝纤维化大鼠肝脏羟脯氨酸含量明显降低,组织病理学明显改善。发挥这一改善作用的原因部分是通过抑制主要器官的巨噬细胞激活(肝、脾、肺组织CD68表达明显降低)而降低二甲基亚硝胺诱导的大鼠肝纤维化。
血吸虫病是一种引起肝纤维化的慢性寄生虫病[23]。Harb等[24]将PF与吡喹酮(PZQ)进行抗寄生虫和抗纤维化性能比较评价发现,PF[50 mg·(kg·d)-1]治疗组能改善寄生虫学参数,包括降低虫重、幼虫、成熟卵和增加死亡虫卵。但PF对于血吸虫病引起的肝纤维化的治疗中发现,肝平均肉芽肿直径和纤维化面积明显减小,血清TNF-α、caspase-3和p53凋亡表达明显升高,血清IL-13、NF-κB、TGF-β1、α-平滑肌肌动蛋白表达明显降低,以上结果表明PF在靶向凋亡和减轻纤维化方面具有明显的优势。
1.4 抗肝癌 肝癌(HCC)是世界上最普遍的恶性肿瘤之一,主要的临床特点是侵袭性、预后较差和治疗选择有限,是长期慢性肝脏炎症和肝硬化的直接结果[25]。目前关于HCC成熟的分子机制主要涉及上皮-间充质转化、肿瘤-间充质相互作用和肿瘤微环境、肿瘤干细胞和衰老旁路。此外,循环肿瘤细胞、免疫调节和神经调节也参与HCC的发生发展[26]。因此,深入了解HCC进展的分子机制和寻找预后良好、毒副作用小的药物是迫切需要的。PF被认为是一种有效的抗转移、抗侵袭药物,Lu等[27]研究证实PF可能具有抗肿瘤活性。6.25~200 μmol·L-1的PF对HepG2和Bel-7402肝癌细胞株的生长有抑制作用,降低肝癌细胞株的侵袭、转移和黏附,其机制可能是PF降低了HepG2和Bel-7402细胞中基质金属蛋白酶(MMP-9)和细胞外信号调节蛋白激酶(ERK)的表达,增加了上皮型钙黏蛋白(E-cad)的表达。王昌高等[28]给予10、30 μmol·L-1PF抑制肝癌HepG2细胞的侵袭和迁移是通过抑制TGF-β1/Smads信号通路实现的。此外,晏雪生等[29]研究表明PF(2 mg·mL-1)能在一定程度上抑制HepG2细胞的增殖和诱导其凋亡,其作用机理之一可能是上调促凋亡基因Bax和P53的表达。张亚武等[30-31]的研究结果发现PF(0.5、 2 mg·mL-1)可能通过调节caspase-3活性和NF-κB信号通路诱导HepG2肝癌细胞凋亡,达到抗肿瘤效果。路景涛[32]证实PF(50、100和200 μmol·L-1)可激活Hedgehog/Gli信号通路、上调MAPK/ERK信号通路及增加MMP-9蛋白的表达参与肝癌Bel-7402细胞的侵袭转移。还有研究证实PF(1、5、10、20、40 μmol·L-1)可能通过蛋白酪氨酸激酶/信号传导及转录活化因子3(JAK/STAT3)通路调节程序性细胞死亡配体1(PD-L1),参与肿瘤患者的免疫调控系统,增强抗肿瘤免疫应答[33]。5-羟色胺1D受体(5-HT1D)是一种神经递质受体,具有多种生理功能,被认为与肿瘤发生有关,而5-HT1D可显著促进HCC细胞的增殖、上皮间质转化和转移。因此,通过下调5-HT1D来抑制Wnt/β-catenin通路是PF影响肝癌进展的又一机制。不同浓度的PF(0、5、10和20 μmol·L-1)刺激下,HepG2和SMMC-7721细胞中5-HT1D的表达显著下调,从而抑制细胞凋亡,延缓肝癌的进展[34]。
1.5 抗肝脏缺血/再灌注损伤 肝脏缺血/再灌注损伤(I/R)损伤是一个极其复杂的过程,起先是缺氧导致损伤,随后再灌注引起血液充氧,从而激活先天免疫反应,进而导致肝脏损伤[35]。小鼠尾静脉注射PF(5、10和20 mg·kg-1)可通过抗氧化、抗炎、抗凋亡途径对抗I/R。其中,线粒体结构完整性的破坏,导致呼吸链、内外膜及基质蛋白功能和ATP合成的抑制都可诱发肝细胞的凋亡,I/R导致线粒体功能障碍,而尾静脉注射30 mg·(kg·d)-1PF预处理缓解这一情况,提示PF预处理可减轻大鼠I/R的机制可能与保护线粒体有关[36]。同时,灌胃PF[100 mg·(kg·d)-1]显著抑制I/R组血清ALT、AST活性(分别为40.3%和53.8%),显著抑制肝脏病理损伤和肝细胞凋亡(P<0.01),抑制中性粒细胞向肝脏浸润。对肝脏I/R损伤具有保护作用与抑制I/R激活的HMGB1-TLR4信号通路减轻肝脏炎症反应有关[37]。
综上所述,PF具有良好的保肝活性(见表1、图1),在临床应用中具有较好的成药前景。但由于PF脂溶性较差,口服生物利用度低,严重影响了临床疗效的发挥。目前,针对PF进行制剂新技术改进研究是重要的研究热点。
2 芍药苷新剂型
2.1 纳米粒 纳米粒可使药物的溶解度增大,提高药物的有效性和安全性。钱佳佳等[38]制备的玉米醇溶蛋白-芍药苷纳米粒显著提高PF的稳定性和口服生物利用度。对于中枢神经系统性疾病,血脑屏障是阻碍药物发挥治疗作用的重要原因之一,为了提高PF的脑靶向,Xiong等[39]制备了乳铁蛋白并负载PF的黑磷纳米片,这些纳米颗粒协同光热效应,能够穿透血脑屏障,有效地靶向治疗帕金森病。此外,脂质液晶纳米粒因其具有包封不同极性的药物、提高药物的稳定性和靶向给药等优点被广泛应用[40]。将PF载入脂质液晶纳米粒达到维持PF的稳定和缓释的目的[41]。为了进一步研究PF脂质液晶纳米粒在大鼠不同肠段的吸收特性,滕爽等[42]采用离体肠外翻模型进行肠吸收研究,结果也证实了脂质液晶纳米粒能显著改善PF的肠吸收,提高了PF的生物利用度。
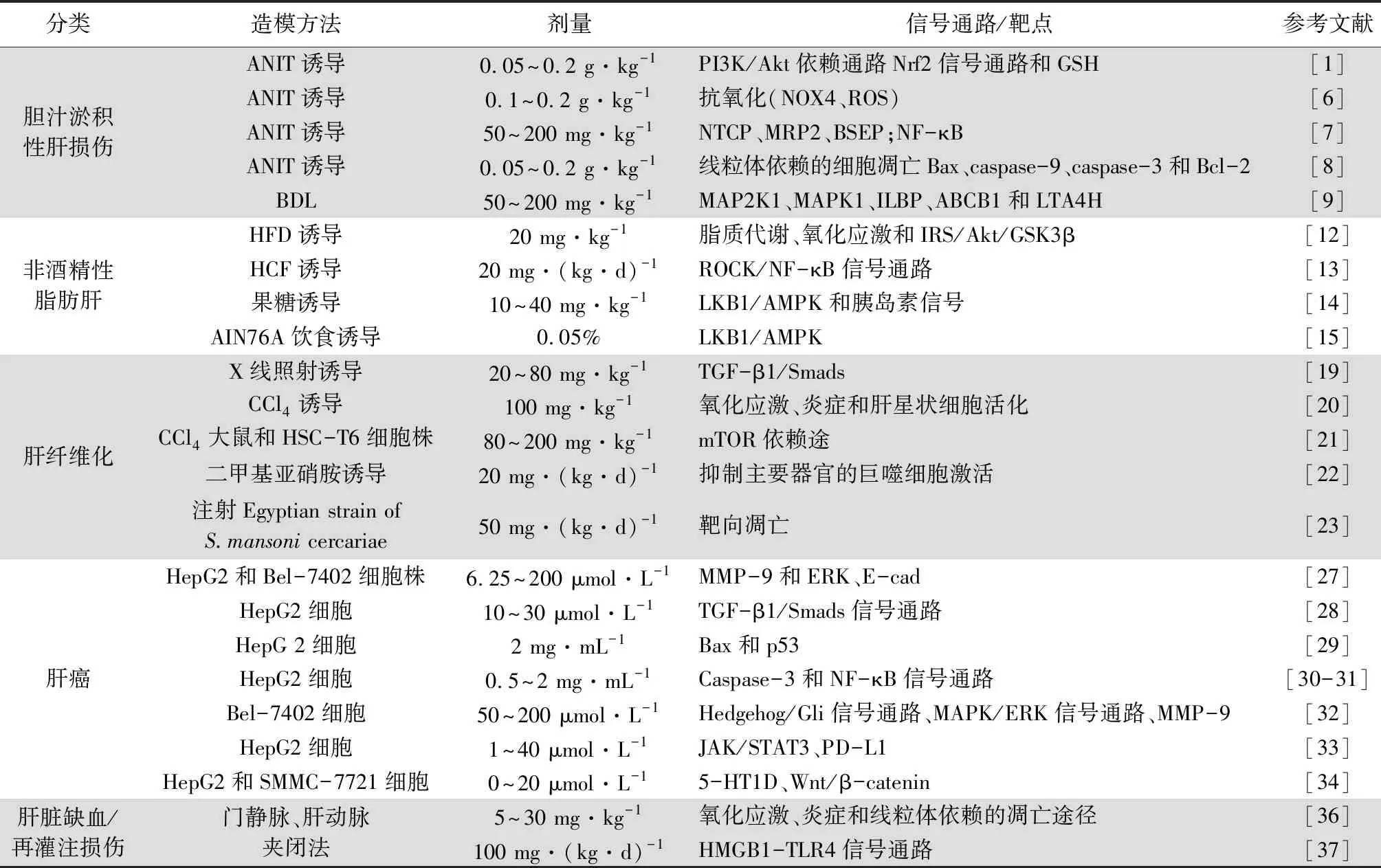
表1 PF在肝脏疾病中的药理活性
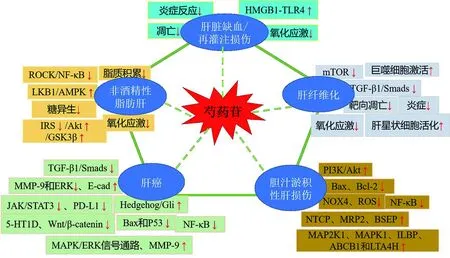
图1 芍药苷通过信号通路对肝脏疾病的调控作用 注:“↑”表示上调,“↓”表示抑制。
2.2 脂质体与醇质体 脂质体是将药物包封于类脂质双分子层内而形成的微型泡囊,类似于生物细胞膜,可使药物选择性的达到靶向部位[43]。洪璐峰等[44]利用脂质体的双亲性,将水溶性的PF和脂溶性的丹参酮IIA共同包载于脂质体中,实验证实其3个月内的稳定性较好且12 h的释放量达到90.0%±3.22%。脂质体的形成有效改善了丹参酮IIA的水溶性差、易氧化分解等缺点,为脂质体同时负载水溶性和脂溶性药物提供了一定的实验研究基础。
醇质体是药物经皮传递系统中最受关注的新型载体之一,广泛应用于医学、药学、美容和皮肤抗衰老等领域,具体制备方法见表2[45-50]。对于外用制剂,跨越皮肤屏障进入真皮是药物被毛细血管吸收进入体循环的前提,药物通过毛细血管扩散到真皮,从而发挥治疗效果[51]。PF被包裹在醇质体中,结果显著提高了包封率,还联合物理方法提高了透皮吸收速率,增加了PF完整的渗透深度[45-46,52]。以上研究为醇质体促进药物深部组织渗透的研究提供了实验依据,也为PF剂型和给药途径的研究提供了参考。

表2 醇质体的制备方法及特点
2.3 磷脂复合物 磷脂复合物是药物与磷脂分子通过电荷转移形成的相对稳定的化合物或复合物,其在水溶液中能通过自组装形成类似于脂质体结构的药物递送系统,具有良好的亲水亲油性[53]。药物与磷脂复合形成载体系统或前体药物后,能改善药物在胃肠道的溶出和吸收,提高血药浓度,延缓药物消除,进而提高生物利用度,同时磷脂复合物也能够改善药物的稳定性[54]。朱延焱等[55-56]以复合物的得率为指标,通过单因素考察或正交试验等优化制备工艺,并结合紫外、红外光谱等分析确认芍药苷磷脂复合物(PF-PLC)的形成。在Qian等[57]研究的PF-PLC中,正辛醇/水分配系数(lgP)结果显示,lgP值高的亲脂性较好,释放较慢,符合一级动力学,且初步药代动力学结果也证明PF-PLC可提高大鼠口服生物利用度。Yuan等[58]研究了具有双层球形的PF-PLC自组装纳米粒对胆汁淤积大鼠肝损伤的保护作用,结果证实PF-PLC自组装纳米粒的形成显著改善PF对胆汁淤积大鼠肝脏指标的影响,有效缓解肝脏损伤,为PF的应用提供了一种有前景的给药体系。
2.4 微囊与微乳 微囊化是一种提高难溶药物生物利用度的新型制剂,药物通过微囊化处理可以提高分散度,增大表面积,使药物的吸收效率提高,从而提高药物的生物利用度[59]。董自亮等[60]采用复凝聚法制备了PF微囊,结果发现微囊中PF 3 h后的释药速度缓慢且体外释放按照一级动力学模型释药。王昭[61]制备的PF微囊在pH为6.8的溶液中,释放速度较缓慢,由此可以看出PF微囊在人体生理环境下药效是缓释的。
微乳液是一种黏度低、具有良好的各向同性和热力学稳定性的透明或半透明制剂,制备简单,保存方便,对亲脂亲水药物有良好的增溶作用,药物分散性好[62]。魏伟课题组对PF微乳剂进行了深入的研究,体外经皮渗透性研究发现PF微乳提高了离体小鼠的透皮吸收能力[63];对大鼠肠道的吸收动力学的研究中发现(油包水型)PF微乳通过大鼠在体肠吸收模型,的吸收速率常数Ka明显高于PF水溶液,说明将PF制备成微乳可以显著提高其生物利用度[64];与PF组(100 mg·kg-1)的药代动力学参数相比,PF微乳(100 mg·kg-1)的最大浓度(Cmax)、血药浓度-时间曲线下面积(AUC0~t)、平均保留时间(MRT0~∞)明显增加,而分布体积(Vd)和清除率(Cl/F)下降;同时,在对大鼠佐剂性关节炎(AA)的研究中还发现,PF微乳对AA大鼠多发性关节炎和免疫功能的抑制作用明显优于PF原料药[65]。上述研究结果表明,微乳能显著提高AA大鼠对PF的吸收和药效[66]。
2.5 凝胶剂 凝胶是由一定浓度的高分子溶液或溶胶增大黏度后失去流动性而形成[67],具有可观的稳定性和生物相容性[68]。目前针对PF所制备的凝胶剂主要包括PF醇质体凝胶剂、PF固体脂质纳米粒凝胶剂、载PF水凝胶等[69]。对于皮肤疾病的治疗研究中发现,无论是哪种PF凝胶剂在透皮渗透性能的研究中都表现出与皮肤的高融合性,显著提高PF的累积透皮量和在皮肤中的滞留量,凝胶剂增强了透过效率,提高了PF生物利用度并使疗效提高,为皮肤疾病的治疗提供一个新的研究思路[70]。
2.6 其他剂型 为了提高PF的口服生物利用度,Shen等[69]以甘草酸(GL)为载体,采用超声分散法制备负载PF的GL胶束,单通道肠道灌注研究发现负载PF的GL胶束可明显增强PF的肠道通透性;体内药代动力学结果证明PF胶束的Cmax和AUC0~t值分别约为PF原料药的2.18倍和3.64倍。在对于中枢神经系统的疾病治疗中,朱智涛等[71]基于大鼠鼻腔灌流法筛选了PF经鼻给药制剂的吸收促进剂,以实现绕过血脑屏障直接进入中枢系统,增加PF的吸收从而有效发挥PF治疗中枢神经系统性疾病的药理作用。
3 总结与展望
PF作为芍药的有效活性成分,具有广泛的药理作用。特别是对于肝脏疾病的治疗作用,通常发挥多靶点的作用。本文全面综述了PF保肝药理作用及机制,可为PF的临床应用提供依据。为了提高PF的稳定性,改善其不易透过生物膜、生物利用度低等不足,本文整理了PF不同的剂型研究,并分析了对PF吸收和药效提高的改善情况,为PF递送系统的研究开发提供更多参考。

