细胞角蛋白18片段M65和表皮生长因子样结构域蛋白7在结直肠癌患者中的表达及临床价值*
范国红,杨鸿林,陆赵阳,沈昊,曹季军,凌伟,刘松良,李勇
(1.苏州市第九人民医院检验科,江苏苏州 215200;2.太仓市第一人民医院检验科,江苏太仓 215400)
结直肠癌(colorectal cancer,CRC)是原发于结肠黏膜上皮的恶性肿瘤,好发于直肠与乙状结肠交界处[1]。尽管近年来手术方式及药物辅助治疗方法不断改进,并且通过肠镜检查以及血清学筛查指标,可实现一定程度的早期诊断,但是效果并不显著,敏感性和特异性不高。
细胞角蛋白18(cytokeratin 18, CK18)是Ⅰ型细胞角蛋白的重要成员,其表达与肝癌、病毒性肝炎等肝病具有显著相关性,并且在细胞凋亡过程中具有重要的调控作用[2-3]。CK18包括多个片段,M65是其中之一,可作为反映细胞坏死后释放进入血液的CK18的总量指标,CK18及其片段产物的表达在CRC诊断以及药物动力学分析中具有重要的临床价值[4]。
表皮生长因子样结构域蛋白7(epidermal growth factor-like protein 7, EGFL7)属于EGFL家族成员,可以激活胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、核因子κB、促分裂活化的蛋白激酶、蛋白激酶B和Notch等重要信号转导通路,广泛参与多种肿瘤的发生、发展过程[5]。EGFL7在人类肿瘤组织中高表达,包括肾癌、恶性胶质瘤、肝细胞癌、乳腺癌、肺癌和CRC等,并与患者临床病理特征密切相关[6]。值得注意的是,肝癌、肺癌及卵巢癌等恶性肿瘤患者血清中的EGFL7水平明显升高,尤其以肝癌患者血清EGFL7水平升高最明显,较正常人群升高近4倍[7],但其在CRC患者血清中的表达尚无报道。本研究旨在观察M65和EGFL7在CRC血清中的表达,并探讨其在CRC发生发展中的诊断价值及预后判断价值。
1 材料与方法
1.1研究对象 收集2019年3月至2021年7月经苏州市第九人民医院病理科、太仓市第一人民医院病理科初诊确诊的CRC患者46例,年龄38~84岁,男28例,女18例。纳入标准:(1)病理确诊为CRC;(2)术前未进行过任何治疗,无其他肿瘤史,且临床病理及随访信息均齐全;(3)排除其他系统疾病。根据1997年国际抗癌联盟制定的TNM分期系统对CRC进行病理分期。以同期43例经肠镜检查获得病变组织的非肿瘤肠道疾病(包括肠道息肉、肠炎等)确诊患者(年龄30~84岁,男27名,女16名)的血清标本作为疾病对照。本研究经太仓市第一人民医院医学伦理委员会批准(批准文号:2021-KY-124),研究对象均知情同意。
1.2血清标本收集 采集所有研究对象清晨空腹静脉血2 mL,置于含促凝剂和分离胶的真空采集管中,室温下3 000×g离心15 min后吸取血清,置于-80 ℃冰箱冻存待测。
1.3ELISA检测 使用中国和锐公司试剂盒,采用ELISA方法检测M65的表达水平,按试剂盒说明书进行操作。使用Abcam公司试剂盒,采用ELISA方法检测EGFL7的表达水平,按试剂盒说明书进行操作。
1.4Ki67免疫组化检测 将包埋好的CRC组织切成4 μm切片,70 ℃烘烤1 h后经二甲苯和梯度乙醇脱水,置于柠檬酸缓冲液(pH 6.0)中进行抗原修复,然后将切片置于3% H2O2溶液中去除内源性辣根过氧化物酶(HRP),BSA封闭后加抗Ki67一抗(北京中杉金桥公司)37 ℃温育1 h,清洗后用HRP标记的二抗(北京中杉金桥公司),室温温育30 min,最后DAB显色后苏木素衬染,中性树胶封片后显微镜观察。Ki67染色结果经有经验的病理医生读片后判断阳性指数。

2 结果
2.1CRC患者及对照患者血清M65、EGFL7表达水平比较 CRC患者血清的M65表达水平为215.7(152.5,287.8)U/L,而对照组为125.7(111.0,142.1)U/L,Mann-WhitneyU检验显示两组间血清M65浓度差异有统计学意义(U=290.5,P<0.000 1)。CRC患者血清EGFL7的浓度为1.814(1.209,2.537)pg/mL,而对照组为1.193(1.025,1.464)pg/mL,Mann-WhitneyU检验分析显示两组间血清EGFL7浓度差异有统计学意义(U=599,P=0.001 2)。
2.2血清中M65、EGFL7联合检测在CRC中的诊断价值分析 通过ROC曲线分析,得到当M65作为区分CRC患者和对照患者的诊断指标时,曲线下面积(area under curve,AUC)为0.853 1(95%CI:0.771 4~0.934 9),cut off值为146.8 U/L时,敏感性为78.26%,特异性为83.72%。EGFL7作为区分CRC患者和对照患者的诊断指标时,AUC为0.697 2(95%CI:0.585 8~0.808 5),cut off值为1.480 pg/mL时,敏感性为67.39%,特异性为76.74%。二者联合诊断时AUC为0.909 0(95%CI:0.845 6~0.972 4),敏感性和特异性分别为86.96%、81.84%。见图1。

图1 血清中M65、EGFL7联合检测在CRC中的诊断价值
2.3不同临床病理参数CRC患者间血清M65、EGFL7表达水平比较 将M65的表达水平与CRC患者的各临床病理参数通过Mann-WhitneyU检验进行不同分类的比较分析,结果显示,瘤体大小≥5 cm患者M65浓度高于瘤体大小<5 cm患者,差异有统计学意义(P=0.038);而不同肿瘤大小、TNM分期以及淋巴结转移情况的患者间EGFL7水平差异均有统计学意义(P=0.009、0.005、0.021)。见表1。

表1 CRC患者各病理特征分类下的M65、EGFL7检测结果
2.4CRC患者血清M65、EGFL7表达水平与肿瘤细胞增殖能力的相关性 46例CRC患者的肿瘤组织Ki67表达百分比为10%的1例,20%的2例,30%的5例,40%的2例,50%的2例,60%的7例,70%的5例,80%的12例,90%的10例。见图2。将M65的表达水平与肿瘤细胞的增殖能力进行Pearson相关性分析,结果显示相关性无统计学意义(r=0.277 7,P=0.061 6),EGFL7与Ki67的表达相关性无统计学意义(r=0.185 2,P=0.218 7)。
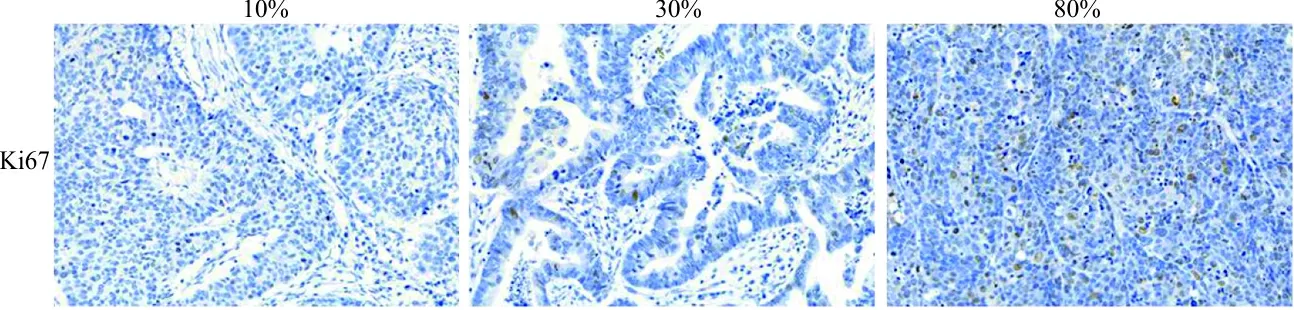
图2 肠癌组织Ki67不同程度表达(100×)
3 讨论
本研究结果显示,M65在疾病对照组中表达稳定,而在CRC组的表达明显增高,考虑CRC组与疾病对照组之间的差异有统计学意义,这可能提示CRC进展过程中出现的大量细胞死亡导致细胞角蛋白释放至血液,同时在肿瘤进展过程中还有一些其他因素导致角蛋白片段释放增加、降解减少,这些因素共同导致M65血清浓度的升高。这些可能是M65作为CRC诊断潜在标志物的分子基础。M65与EGFL7的联合检测AUC值可达0.909 0,这与陈文萍在2020年的一项多指标联合检测在大肠癌中的诊断价值研究结果类似[8],同时这两个标志联合检测的敏感性和特异性也与朱珊玲等的一项4个肿瘤标志物的联合研究结果接近[9],这些结果都提示M65与EGFL7的联合检测具有很强的潜在CRC诊断价值。
M65表达与肿瘤细胞增殖的相关性虽然未见统计学意义,但r值为0.277 7,P值为0.061 6,提示M65的产生与肿瘤细胞的快速增殖之间可能有一定的正相关性。由于M65是细胞坏死之后释放的,而细胞的快速增殖进而缺氧是导致细胞坏死的主要原因,因此M65的临床价值更多是建立在其与肿瘤细胞增殖、坏死相关,与临床相关的分析显示M65浓度与肿瘤大小显著相关(P=0.038),与其他因素相关性不显,也进一步证实了这一点。进一步增加样本量可能会得到M65与肿瘤细胞增殖之间更为准确的关系。而EGFL7作为一种血管内皮细胞源性分泌性因子,主要作用在于调节各类细胞(包括内皮细胞、肿瘤细胞等)的黏附、迁徙[10]。本研究结果显示,EGFL7与肿瘤大小、TNM分期以及淋巴结转移都具有显著相关性,而与肿瘤细胞的增殖无显著相关性,提示EGFL7与M65不同,不是通过肿瘤细胞增殖、坏死相关的途径,而可能是通过调控肿瘤细胞迁移、侵袭、转移等途径发挥促肿瘤功能。因此,M65可作为CRC疾病的筛查标志以及肿瘤增殖坏死的标志,而EGFL7的临床价值更偏向作为CRC肿瘤转移与不良预后的预测标志物。
综上所述,血清中M65、EGFL7的浓度在CRC患者中显著升高,二者联合检测可有效诊断CRC。而血清EGFL7水平与患者的临床病理特征的相关性更强,且与患者淋巴结转移与否具有相关性,未来或可用于患者的预后判断及转移评估。本课题的研究病例数量较少,相关推论还需要扩大样本量以及追踪患者的长期随访数据,以进行深入研究。

