益生菌协同蒲公英发酵对其抗氧化功能的促进作用
Seyitmammedov Eziz,张智*,蒋士龙,解庆刚
(1.东北林业大学林学院,哈尔滨150000;2.黑龙江飞鹤乳业有限公司,黑龙江齐齐哈尔161000)
蒲公英(TaraxacummongolicumHand.-Mazz.)是菊科(Asteraceae)多年生草本植物,是我国常见的药食两用植物,在世界范围内广泛分布[1-3]。据统计,中国有70种蒲公英,其中药用蒲公英27种,最常见的是生长在内蒙古、东北等地的6种蒲公英[4]。蒲公英含有黄酮类、酚类、生物碱、萜类等多种生物活性成分,具有保护肝脏、利尿、抗癌、抗炎和抗氧化等特性[5-6]。蒲公英及其提取物,天然安全有效,广泛用于治疗肝脏疾病、胃肠道疾病、骨关节炎、癌症、眼病等疾病[7]。
研究表明,微生物发酵可以提高植物中生物活性物质提取率[8-10]。微生物可以分解植物细胞中的纤维素、木质素等大分子物质,破坏植物细胞壁结构,从而更有效地提取植物中的活性物质,提高生物利用度[11]。固体发酵是蒲公英的增值和利用的一种独特工艺方法,与液态发酵相比固态发酵具有成本低、产后续处理简单和产率高等优势。目前,微生物发酵技术已被广泛应用于植物中活性物质的提取,而利用固态发酵法提取蒲公英中黄酮类化合物研究报道较少。
黄酮类化合物是一大类植物次生代谢产物,具有清除自由基和参与抗氧化反应的能力,具有较强的抗氧化活性[12-13],可用于治疗人体免受慢性疾病[14]和炎症性疾病[15]。研究蒲公英经固态发酵处理后,黄酮类化合物的含量及抗氧化活性的变化,为固态发酵蒲公英的开发利用提供了理论依据。
1 材料与方法
1.1 材料与仪器
蒲公英,市售;益生菌制剂,东北林业大学食品发酵实验室保藏;1,2-二苯基代苦味肼基自由基(DPPH)Sigma公司;硫酸、苯酚、95% 乙醇、琼脂、MRS 液体培养基成分等试剂,均为分析纯。
立式压力蒸汽灭菌锅,上海申安医疗器械厂;超净工作台,苏净集团安泰公司;GL-20B型全自动高速冷冻离心机,湘西仪器仪表总厂机械仪器厂;上海精密科学仪器厂;PHS-3C型精密pH计 上海恒磁电子科技有限公司;UV-5500PC紫外可见分光光度计 上海精密仪器仪表有限公司。
1.2 试验方法
1.2.1 菌种活化与培养
1.2.1.1 菌种活化:将斜面保存的益生菌制剂接种到种子培养基(MRS液体培养基)中,120 r/min,37 ℃恒温培养24 h,重复活化 2 次,备用。
1.2.1.2 菌悬液的制备:将活化的益生菌制剂,以1%的量再次接种入灭菌后 MRS 液体培养基中,使益生菌制剂处于对数生长期后期,然后分装于50 mL无菌离心管中,4 ℃离心(10000 r/min,10 min),弃去上清液。将益生菌制剂细胞称重后按照1∶1的比例加入灭菌生理盐水(0.9%的浓度),振荡混匀后,制成益生菌制剂的菌悬液。
1.2.1.3 发酵培养:将益生菌制剂菌悬液按10%接种量接种至蒲公英粉末中,含水比为1∶3,35 ℃,发酵培养24 h。
1.2.2 单因素试验
1.2.2.1 碳源种类对固态发酵蒲公英的影响:将益生菌制剂菌悬液按10%接种量接种至蒲公英粉末中,含水比为1∶3,分别加入2.5%的蔗糖、葡萄糖、乳糖,在35 ℃条件下,发酵培养24 h。分别测定发酵液中活菌数。
1.2.2.2 蔗糖添加量对固态发酵蒲公英的影响:将益生菌制剂菌悬液按10%接种量接种至蒲公英粉末中,在含水比为1∶3,发酵温度35 ℃的条件下,分别加入0、2.5%、5%、7.5%、10%的蔗糖,发酵培养24 h。分别测定发酵液中活菌数。
1.2.2.3 含水比对固态发酵蒲公英的影响:将益生菌制剂菌悬液按10%接种量接种至蒲公英粉末中,加入2.5%的蔗糖,在含水比分别为1∶2、1∶2.5、1∶3、1∶3.5、1:4的条件下,在35 ℃条件下,发酵培养24 h。分别测定发酵液中活菌数。
1.2.2.4 接菌量对固态发酵蒲公英的影响:将益生菌制剂菌悬液分别按10%、15%、20%、25%、30%接种量接种至蒲公英粉末中,加入2.5%的蔗糖,在含水比为1∶2.5条件下,在35 ℃条件下,发酵培养24 h。分别测定发酵液中活菌数。
1.2.2.5 发酵温度对固态发酵蒲公英的影响:将益生菌制剂菌悬液按25%接种量接种至蒲公英粉末中,加入2.5%的蔗糖,在含水比分别1∶2.5,发酵温度分别为32、35、37、40、43℃的条件下,发酵培养24 h。分别测定发酵液中活菌数。
1.2.2.6 发酵时间对固态发酵蒲公英的影响:将益生菌制剂菌悬液按25%接种量接种至蒲公英粉末中,加入2.5%的蔗糖,在含水比分别1∶2.5,在35 ℃条件下,分别发酵培养12、18、24、30、36 h的条件下。分别测定发酵液中活菌数。
1.2.3 响应面优化试验
在单因素试验的基础上,采用 Box-Behnken(BBD)中心组合设计原理,选择接菌量(A)、发酵时间(B)、发酵温度(C)、含水比(D)为自变量,以活菌数为响应值,设计四三因素三水平响应面优化试验。因素水平设计表 1。

表1 响应面因素水平表
1.2.4 DPPH 自由基清除率[16]
采用95%的乙醇溶液DPPH粉末,配制成0.2 mmol/L的溶液。取样液2 mL与2 mL的DPPH溶液混合摇匀,室温下避光放置30 min后,于517 nm下测吸光值,记为A样品;用95%的乙醇代替DPPH溶液,同样条件下室温避光放置30 min后,于517 nm下测吸光值,记为A空白;管以95%的乙醇代替样品,于517nm下测吸光值,记为A对照。
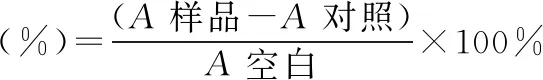
式中:A样品为样液加DPPH的吸光度值;A对照为样液加乙醇溶液的吸光度值;A空白为DPPH加乙醇溶液的吸光度值。
2 结果与分析
2.1 碳源种类对固态发酵蒲公英的影响
碳源是微生物发酵过程中重要的营养成分之一,蔗糖、葡萄糖、乳糖是微生物发酵培养基中常用的碳源[17]。乳酸菌代谢的糖类的种类和数量不同,其产酸量也不同,蒲公英中低聚糖含量较少,不利于益生菌制剂生长与产酸,所以需要补充一定的碳源。如图1所示。在蒲公英固态发酵过程中添加2.5%蔗糖,更有利益于益生菌制剂的生长。

图1 碳源对固态发酵过程中益生菌制剂活菌数的影响
2.2 蔗糖添加量对固态发酵蒲公英的影响
蔗糖作为乳酸菌发酵的有效碳源,可以促进益生菌。由图2可知,发酵液中的活菌数,呈先增加后下降的趋势。在蔗糖添加量在2.5%时,发酵液中活菌数含量最高。因此选取2.5%为单因素中蔗糖最佳添加量。

图2 蔗糖添加量对固态发酵过程中益生菌制剂活菌数的影响
2.3 料水比对固态发酵蒲公英的影响
由图3可知,发酵液中的活菌数呈现先增加后下降的趋势,在培养基含水比例为1∶2.5时活菌数含量最高,此后有所降低。原因可能是在固体发酵过程中,培养基含水量过低,不能满足其生长繁殖的需要,而含水量高导致培养基中溶解氧不足,影响新陈代谢[18]。因此选取1∶2.5为单因素中最佳培养基最佳水料比。

图3 料水比对固态发酵过程中益生菌制剂活菌数的影响
2.4 接菌量对固态发酵蒲公英的影响
由图4可知,当蒲公英固态发酵的接菌量在10%~25%,发酵液活菌数随着接菌量的增加而增加,接种量为25%时活菌数最高,接种量大于25%时活菌数开始下降。接菌量浓度低时,活菌数少,发酵缓慢。当接菌量过大,抑制了菌体生长,导致活菌数降低。因此选取接菌量为25%,为单因素中最佳培养基最佳接菌量。

图4 接菌量对固态发酵过程中益生菌制剂活菌数的影响
2.5 发酵时间对固态发酵蒲公英的影响
由图5可知,随着蒲公英固态发酵的进行,在12~24 h时发酵液中的活菌数不断增加,在24 h增长达到了最高点,活菌数为3.25×108cfu/mL,发酵时间超过24 h后,活菌数显著下降。随着发酵时间的延长,发酵底物中碳源等营养物质的减少影响了益生菌制剂的生长。因此选取发酵时间24 h,为单因素中最佳培养基最佳发酵时间。

图5 发酵时间对固态发酵过程中益生菌制剂活菌数的影响
2.6 发酵温度对固态发酵蒲公英的影响
由图5可知,当发酵温度在32~37 ℃时,发酵液中的活菌数随着温度的增加不断增加,在37 ℃时,增长达到了最高点,活菌数为3.2×108cfu/mL,发酵温度超过37 ℃后,随着发酵温度的上升,活菌数显著下降。因此选取发酵温度为37 ℃,为单因素中最佳培养基最佳发酵温度。

图6 发酵温度对固态发酵过程中益生菌制剂活菌数的影响
2.7 蒲公英固态发酵响应面实验及其优化
采用响应面法优化提高蒲公英固态发酵活菌数,按照表1的设计方案利用Design-Expert 8.0.5设计Box-Behnken实验及其测定结果如表2所示。
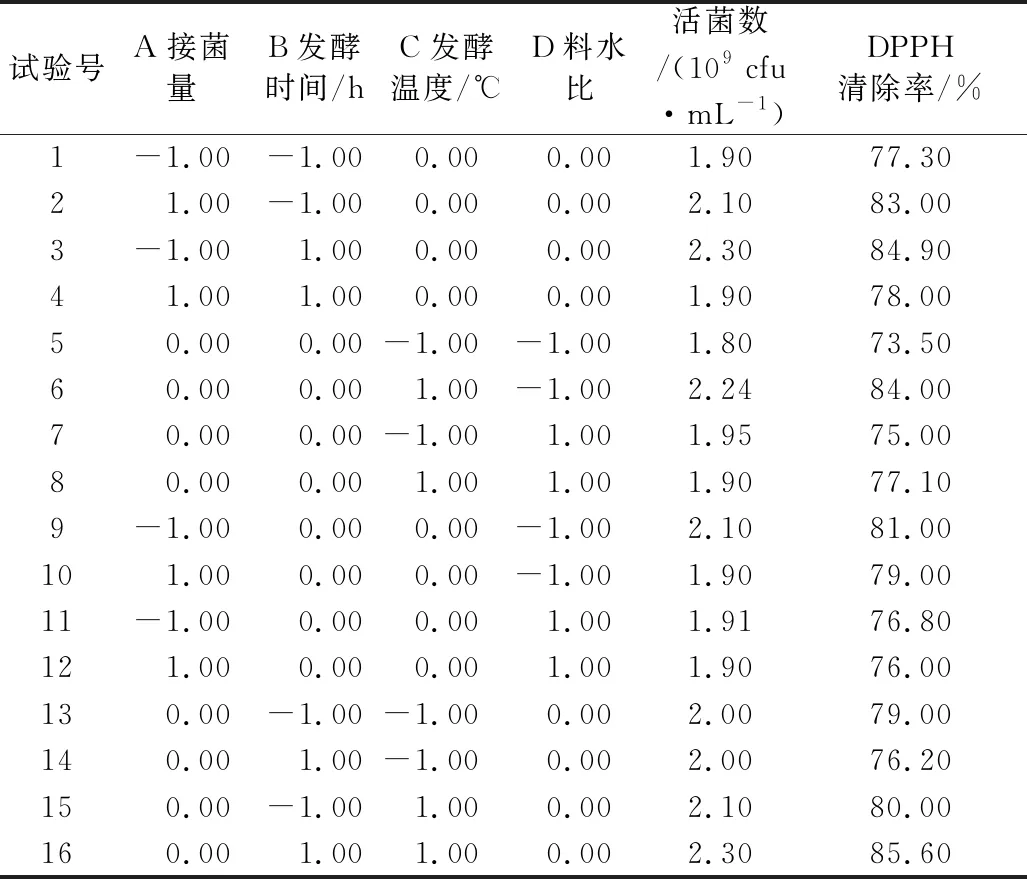
表2 Box-Behnken响应面优化试验设计及结果

续表2
对表2中的发酵蒲公英活菌数试验数据进行多元回归拟合,获得发酵温度、发酵时间、接菌量、含水量对蒲公英固态发酵DPPH清除率的二次回归方程模型为:
Y=+3.5-0.055A+0.049B+0.10C-0.041D-0.15AB-0.19AC+0.048AD+0.050BC+0.098BD-0.12CD-0.63A2-0.46B2-0.59CC-0.57D2


表3 回归模型方差分析结果

续表3
根据回归方程,做出响应面图形,分析各因素间的交互作用。图7为接菌量、发酵时间、发酵温度、料水比对蒲公英固态发酵产物DPPH清除率影响的3D曲面图和等高线图。3D曲面开口向下,倾斜程度大,等高线为椭圆形,表明两个因素之间交互作用显著,表明四个因素的交互作用影响显著,并且存在一个最优值。响应面优化模型预测结果:接菌量为24.48%,发酵时间为24.61 h,发酵温度为37.95 ℃,含水1∶2.56,为操作方便将最优条件修正为接菌量24%,发酵时间25 h,发酵温度38 ℃,料水比1∶2.6。

图7 各因素间交互作用的响应曲面图
2.8 验证性试验
蒲公英固态发酵产物活菌数的理论值为3.16×109cfu/mL,DPPH清除率理论值为91.59%。在响应面优化获得的最佳发酵条件下,进行三次验证试验,活菌数的实际结果为2.98×109cfu/mL,此时DPPH为清除率90.7%,与理论值分别相差6%、0.9%,说明此模型可靠。
2.9 蒲公英固态发酵前后生物活性物质含量变化
微生物发酵能够破坏植物细胞壁结构,有效促进黄酮类化合物的释放[19-20]。如图8所示,益生菌制剂发酵对蒲公英黄酮含量有显著提高(P<0.05),发酵后蒲公英黄酮含量达98.70 mg/g,是发酵前蒲公英黄酮含量(35.96 mg/g)的2.74倍,说明经过益生菌制剂发酵可以显著提高蒲公英黄酮含量。
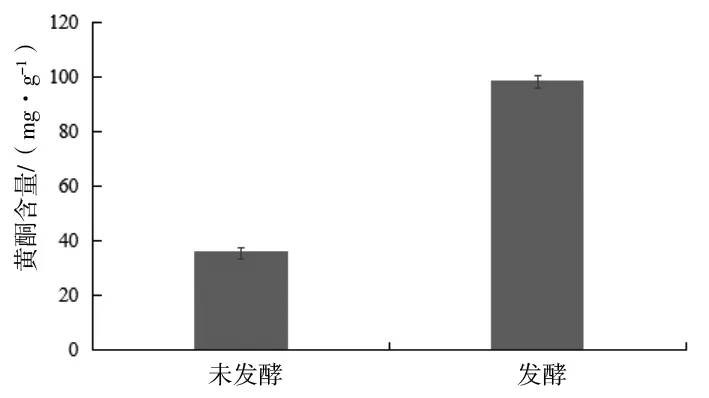
图8 蒲公英固态发酵前后中黄酮含量变化
3 讨论
近年来,微生物发酵被广泛应用于提高植物中生物活性物质产量,通过发酵过程中产生的各种酶,包括脂肪酶、葡萄糖淀粉酶、蛋白酶和淀粉酶,促进从底物中释放或合成生物活性化合物[21-22]。目前,大多数益生菌产品都是液态发酵,发酵过程中会产生大量废水,需要收集细菌,且操作复杂。相对于液态发酵,固态发酵发酵环境中水活度低,微生物易于生长,酶活度高,酶系统丰富。微生物的固态发酵受多种因素的影响,如接种量、温度、时间、含水量等[23]。因此,本文采用益生菌制剂对蒲公英进行固态发酵,通过响应面法优化发酵条件,最大限度地提高蒲公英中黄酮类化合物的含量和抗氧化活性。
微生物在生长代谢过程中氮源用于菌体蛋白及核酸的合成,碳源用于为微生物生长提供能源物质[24-25]。在固态发酵过程中,添加适宜的氮、碳源的能促进菌体快速生长并提高产物的合成速度。本文通过单因素试验对微生物发酵常用碳源进行筛选,发现添加2.5%的葡萄糖,更有利于益生菌制剂的生长,此条件下发酵产物中的活菌数含量最高。通过响应面试验,确定最优发酵条件为:接种量24%、接种量24%,发酵时间25 h,发酵温度38 ℃,料水比1∶2.6。在此条件下活菌数为2.98×109cfu/mL,此时DPPH为清除率90.7%,比优化前提高1.28倍。
黄酮类化合物是一大类植物次生代谢产物[26],是人类和动物饮食中不可或缺的一部分,具有清除自由基和参与抗氧化反应的能力[27-29]。试验发现,蒲公英经过固态发酵后,具有更强的抗氧化活性,DPPH自由基清除率较未发酵蒲公英,提高了2.74倍。研究表明,微生物发酵会提高黄酮产量及抗氧化活性。郝红梅等[30]采用酵母菌发酵黄芪药材,黄酮产率与未发酵组比较提高了18%。阎欲晓等[31]利用米曲霉和黑曲霉进行混合菌种固态发酵甘蔗叶,测定发酵甘蔗叶中黄酮和多酚质量分数比未发酵甘蔗叶提高了50.72%和50.62%,并且抗氧化活性得到提高。
4 结论
通过单因素试验、响应面优化,确定最优发酵条件为:蔗糖添加量2.5%、接种量24%、接种量24%,发酵时间25 h,发酵温度38 ℃,料水比1∶2.6。在此条件下活菌数为2.98×109cfu/mL,此时DPPH为清除率90.7%,比优化前提高1.28倍。经过益生菌制剂发酵后,蒲公英黄酮含量较未发酵蒲公英提高了2.74倍,试验为固态发酵工艺对蒲公英开发利用提供了一定理论依据。

