纳米药物在儿童癌症治疗中的研究进展
廖述霞
(成都市新都区中医医院,四川 成都 610500)
癌症是人类最常见的一种恶性肿瘤,也是威胁儿童健康的主要疾病之一[1].目前,治疗儿童癌症的主要策略是通过手术、化疗及放疗等传统方式.在过去的近二十年里,虽然手术,放疗和化疗在一定程度上能缩小肿瘤的体积,使得儿童癌症的治疗取得了一定的成效,但是,据世界卫生组织统计,除意外伤害外,恶性肿瘤仍然是儿童和青少年死亡的主要原因,导致儿童癌症的治疗面临极大的挑战[2-3].最常见的儿童恶性肿瘤是神经母细胞瘤和白血病.其中,神经母细胞瘤(NB)被称作“儿童肿瘤之王”,是婴幼儿中最常见的一种颅外实体肿瘤.根据2014 年美国对儿童癌症的统计,神经母细胞瘤新发病例占全部儿童恶性肿瘤的8%~10%[4].白血病是另一种最常见的儿童恶性肿瘤,根据2021 年底中国发布的《中国儿童血液病2020 白皮书》数据显示,我国儿童急性淋巴细胞白血病占儿童白血病的72.6%,0~14 岁儿童的白血病发病率为3.43/10 万[5].
虽然癌细胞具有共同的特征,并且一些传统的细胞抑制药物如蒽环类或烷基化剂的抗肿瘤药物已经被广泛应用于治疗恶性肿瘤[6],但是它们在儿童患者中存在毒性风险,造成了临床局限性.例如:细胞周期蛋白依赖性激酶(CDK12)抑制Dinaciclib,由于其存在短的半衰期短和高的毒性,迫使临床应用受到限制[7].此外,一些口服的聚(ADP 核糖) 聚合酶(PARP)抑制剂,如他唑帕尼,必须通过静脉注入等方式,因此部分抑制剂分子在进入主要血流之前已经被降解,导致生物利用度降低[8].此外,儿童癌症的临床剂量通常是针对成人患者,儿童的给药通常是根据成人剂量进行推算,据统计大约70%开给儿童患者的药物的药代动力学和药效学特性尚未在儿童中得到适当的研究.然而,由于儿童癌症在患病率、突变量和药物反应方面与成人癌症不同,导致儿童癌症的治疗面临着巨大的挑战,因此迫切需要开发新型的专门针对癌症儿童设计的治疗策略,以提高药物在儿童肿瘤临床治疗中的疗效和安全性.
为此,纳米技术与纳米肿瘤学的发展为儿童癌症治疗提供了新的契机,是因为纳米药物能够在肿瘤部位实现有效的蓄积,使其在儿童癌症的诊断和治疗中具有广阔的应用潜能(图1)[9].一方面,纳米药物本身可以利用自身独特的电学结构和物理化学性能,作为优异的化疗药物实现药物功效.另一方面,纳米药物还可以利用高的比表面积作为药物载体,通过静电吸附或者化学键合等表面修饰方式将小分子化疗药物负载在表面,随后靶向进入肿瘤组织,实现化疗药物的高效递送和有效聚集.与此同时,纳米药物可以通过选材以进一步增强它们的负载能力和表面功能化性能,从而提高疏水性化疗药物的溶解度,延长药物血液循环时间,实现较低剂量的有效治疗,因此副作用更少.更重要的是,纳米药物还可以利用自身特殊理化性能从内部氧化还原作用、酸性响应和外界刺激(光、电、磁、热等)等途径与肿瘤细胞产生相互作用,实现药物的高效利用和有效治疗.因此,将纳米药物引入儿童肿瘤治疗,有可能克服目前阻碍儿童癌症治疗的诸多瓶颈问题,推动儿童癌症治疗的进一步发展.目前纳米药物在儿童癌症治疗的研究主要集中在神经母细胞瘤和白血病的治疗.
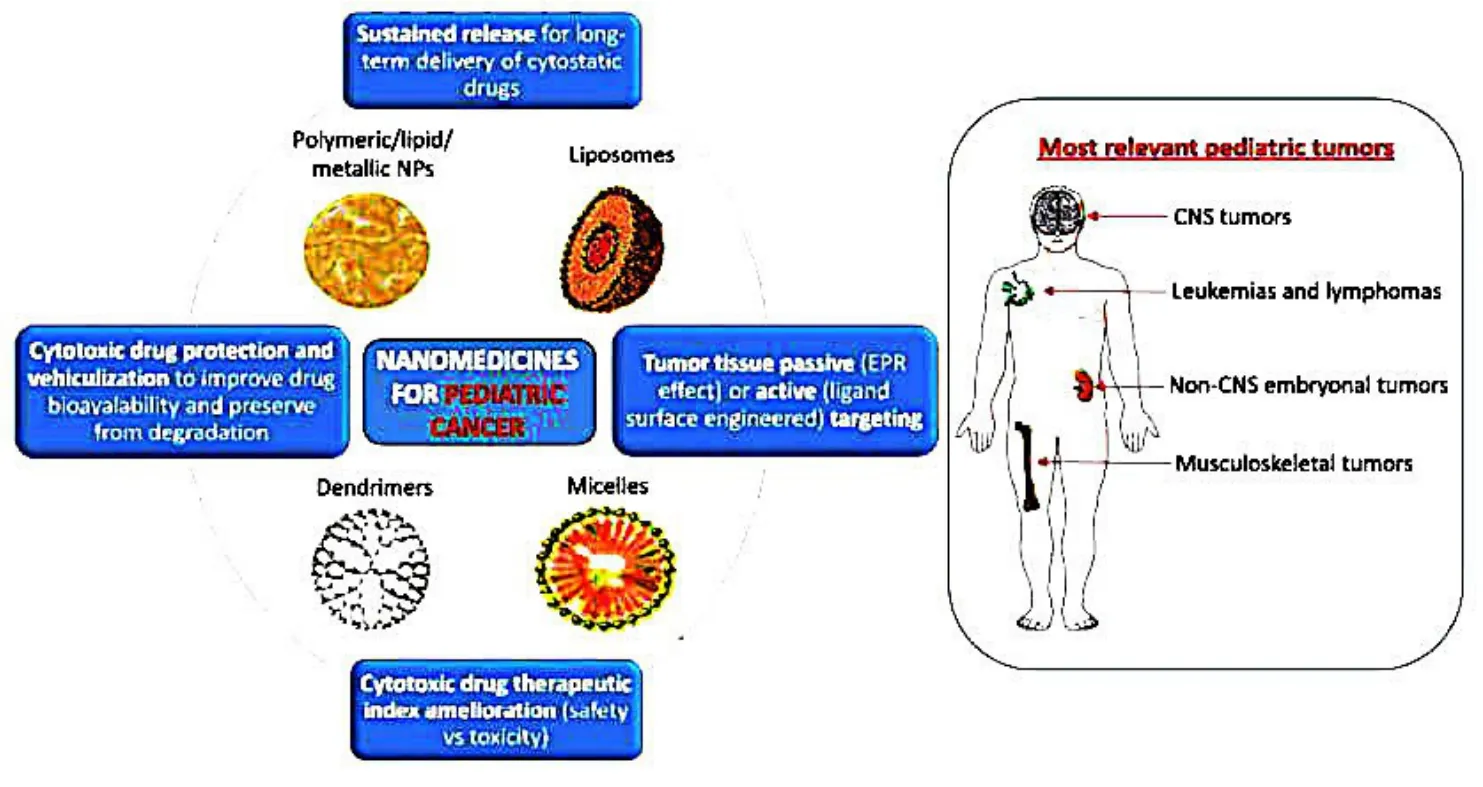
图1 纳米药物在儿科癌症治疗中的应用Fig.1 Application of nanomedicine in pediatric cancer treatment
1 神经母细胞瘤
1.1 基于纳米药物的化学治疗
神经母细胞瘤是交感神经的胚胎性肿瘤,是儿童颅外最常见的恶性实体肿瘤,也是婴幼儿最常见的实体肿瘤[10-11].根据2014 年美国对儿童癌症的统计,神经母细胞瘤新发病例占全部儿童恶性肿瘤的8%~10%.在我国0~14 岁儿童中的发病率约为1.01/10万,每年新发患儿人数约为3 000 例[4],约50%的神经母细胞瘤发生在2 岁以内的婴幼儿.标准治疗儿童神经母细胞瘤主要包括化疗,免疫疗法,放疗和手术等,这取决于神经母细胞瘤的发展阶段[12].其中,大多数患癌儿童的化疗都是采用顺铂等烷基化抗癌药物,然而这些药物严重的毒副作用大大地限制了其临床应用.为此,越来越多的科学家们开始转变思路,逐渐将关注点放在迅猛发展的纳米科学与技术上.Zhen等人制备了酪蛋白纳米颗粒来负载顺铂等烷基化药物,使其在神经母细胞瘤中具有更好的抗癌效果和更低的细胞毒性[13].结果证实:烷基化药物被纳米药物包覆之后,确实能够延长自身的血液半衰期,提高药物的安全性和有效性.尽管如此,这些纳米药物的性能只在体外进行了测试,体内研究主要来自于异种移植瘤模型.其实验结果不能简单地应用在儿童神经母细胞瘤中,因此,为了有效提高纳米药物在儿童神经母细胞瘤中的治疗效果,必须采用标准化的动物模型以及对临床转化前的试验进行系统化评估,同时需要考虑到儿童与成人之间存在的年龄差异、肿瘤环境、免疫反应和晚期后遗症等因素.
1.2 基于纳米药物的免疫治疗
研究发现,在儿童神经母细胞瘤细胞表面存在丰富的GD2 抗原,而在正常组织中该抗原仅存在于神经元和周围神经[14-16].通常血脑屏障会保护神经元不受GD2 靶向治疗的影响,因此,越来越多的科学家将患有高危神经母细胞瘤的儿童中的GD2 分子作为治疗靶点,通过采用免疫治疗方法或者开发免疫靶向策略,使细胞抑制药物在神经母细胞瘤中实现特异性传递,从而提高癌症儿童的治疗效果.例如:通过在介孔二氧化硅纳米颗粒表面涂有抗双钙神经节苷2 mAb抗体,以促进microRNA-34a 在神经母细胞瘤中的靶向传递,激活肿瘤特异性过表达microRNA-34a 诱导caspase 介导的凋亡通路,导致肿瘤生长受到抑制,提高免疫治疗效果[17].此外,贾娜娜·加斯里尼儿童医院的学者们将c-Myb,阿霉素或anti-ALK siRNA 和抗GD2 抗体同时包被在脂质体中[18],所有的结果显示:与非靶向治疗相比,靶向治疗均显示出良好的治疗效果.而且,一些课题组还将贵金属纳米颗粒,碳材料,荧光上转换纳米材料等表面接枝上GD2 受体的抗体[19],体外和体内试验证实,与未接枝的纳米材料相比,这些抗体结合的纳米材料具有更强的抗抑制率、更好的肿瘤组织积累和特异性.
虽然纳米药物在儿童神经母细胞瘤中的免疫治疗和靶向免疫中取得了一定的成效,但是针对具有异质特性的周围神经母细胞肿瘤的治疗仍然面临巨大的挑战性.是因为癌症复发会促使基因突变的风险加大,因此,如果个性化治疗为高风险的成神经细胞瘤儿童提供了机会,那么使用如上所述的靶向纳米药物可能需要改进治疗方法.这种方法在复发的成神经细胞瘤中可能是最佳的,即使与其他胚胎肿瘤一样,极端的变异性和对疾病的不了解仍然限制了新的治疗尝试.
2 白血病
白血病是源于造血干细胞的恶性疾病,表现为贫血、感染、出血等症状.白血病有许多不同的类型,按发展速度主要分为急性白血病和慢性白血病.根据细胞类型,白血病主要分为淋巴细胞白血病和急性髓系白血病[20].其中,急性淋巴细胞白血病(Acute lymphoblastic leukemia,ALL)源于骨髓中淋巴细胞的异常增殖,急性髓系白血病(Acute myeloid leukemia,AML)主要由于髓系干细胞克隆群的异常增殖和分化.在临床病例中,90%以上的儿童患者属于急性发病,ALL比例最高,其癌细胞分化程度低,恶性程度高,且发病急骤,以发热、进行性贫血、出血等症状为主要表现.白血病发病的确切原因目前尚未确定,病毒、遗传、辐射和化学毒物等因素被认为与其发生密切相关.与实体瘤不同,白血病不能通过手术切除.目前,白血病尚无明确的防治措施,大多数治疗白血病药物特异性和稳定性差,容易引起耐药性.因此,治愈白血病的关键是寻求和开发能够高效递送治疗药物、增强靶向能力、实现控释的智能递送系统.随着纳米技术的发展,已经开发出用于递送药物的纳米技术.纳米粒子可以通过智能设计克服传统医学的局限性,实现集诊断、治疗等功能于一体的个性化给药平台的构建(图2)[21].

图2 纳米药物治疗白血病Fig.2 Nano-drug treatment for leukemia
2.1 小分子纳米药物
由于化学药物的药代动力学特性较差,常规治疗通常具有较低的治疗窗口.此外,传统的化疗药物不能特异性作用于病变细胞,它们可能会对正常细胞产生负面影响,并导致严重的副作用[22].相反,纳米颗粒可改变化学药物的溶解度,提高药物在体内的稳定性.与游离药物相比,设计纳米载体将所需药物运送到特定的细胞或组织中,可有效减少药物的副作用,克服多重耐药机制.Sun 等人[23]开发了一种新型透明质酸修饰的姜黄素脂质体(HA-curl-Lps),利用HA 特异性结合AML 细胞表面过表达的CD44 受体,使姜黄素药物特异性递送到白血病细胞,与游离姜黄素和非靶向脂质体相比,HA-curl-Lps 稳定性好,对AML 细胞亲和力高,能有效抑制AML 细胞增殖.此外,抗肿瘤药物吉西他滨(Gemcitabine)可在核内体的酸性环境中刺激响应释放,从而抑制髓系白血病干细胞的增殖和诱导细胞凋亡.Fan 等人[24]构建了一种新型的双寡肽偶联纳米体系,可靶向骨髓中的成骨细胞龛和血管龛,从而有效提高As2O3在纳米颗粒中的负载效率和稳定性,有效治疗白血病.
2.2 抗体递送纳米药物
抗体药物可以特异性地与靶抗原结合,因此负载抗体药物的纳米药物比传统的抗体药物具有更高的特异性[22].具体表现主要包括:可与相关抗原的特异性结合,选择性杀伤白血病细胞,具有更高的疗效等.上海交大基础医学院方超教授团队[25]构建了具有白血病细胞膜伪装和缺氧反应的介孔二氧化硅纳米粒子仿生纳米药物.该纳米药物可高效、准确靶向骨髓微环境中耐药的白血病细胞,并实现治疗性中和抗体(aTGFβRII)与化疗药物(柔红霉素)的“序贯式”分级递送,克服了骨髓微环境(BMM)介导的白血病细胞耐药,增强了化疗疗效.免疫组织化学染色表明,该纳米药物可有效降低小鼠的白血病细胞和改善小鼠脾肿大症状;浙江大学顾臻课题组[26]开发了一种新型联合细胞递送技术,将造血干细胞和血小板结合在一起,以递送免疫抗癌药物PD-1 抗体.动物模型证实,纳米颗粒可以将抗体药物输送到骨髓中,增强对白血病细胞的杀伤效果,显著抑制AML 的复发.在WEHI-3 白血病小鼠模型中,S-P-aPD-1 组小鼠表现出更好的治疗效果,62.5%的小鼠在第50 d 仍然存活.
2.3 基因治疗纳米药物
对于蛋白质和基因药物,其特性容易降解,难以进入细胞.因此,合理的纳米颗粒载体对于提高药物靶向性、减少副作用、保护药物免受核酸酶降解等都非常重要.目前,白血病的基因治疗处于实验和临床前阶段.RNA 基因药物可分为四大类[27]:微RNA(miRNA)、干扰RNA(siRNA)、反义寡核苷酸(ASO)和核酸适体,可用于在RNA 水平上治疗疾病.然而,RNA 基因药物由于带负电荷,不容易穿透疏水性细胞膜.如果不加保护或未经修饰,将在血清中迅速降解与病毒载体相比,非病毒载体毒性低,免疫反应低,是更好的RNA 给药选择.慢性淋巴细胞白血病主要由两种形式:侵袭性和惰性.在侵袭性CLL 中,低miR-29b 表达与不良预后相关.在小鼠B 细胞系中过表达miR-29b 可引发异常,因此,选择性的将miR-29b引入B-CLL 细胞中,可提高治疗效果.近期,研究人员[28]构建了一种装载有2A2 抗体的miR-29b 脂质体,实验发现,该纳米药物可向ROR1 +CLL 细胞中靶向递送miR-29b,下调DNMT1 和DNMT3A 进行细胞重编程、从而控制DNA 甲基化,降低SP1 表达,提高P21 表达.与此同时,研究人员通过构建Eμ-TCL-1 小鼠模型,在活体层次上验证了这一结论.近来有研究发现,细胞外微囊泡(MV)对癌症的发展和复发起到了重要作用,微囊泡中的miRNA 会推动造血细胞的白血病转化[29].对于miRNA 的传递,外泌体(一种由细胞分泌的天然囊泡)可以作为载体,外泌体表面的蛋白质可特异性地与靶细胞上的受体结合,从而加速miRNA 在靶组织中的积累.Huang 等人[30]发现使用伊马替尼耐药的CML 细胞的外泌体来传递miR-365,可有效内吞到CML 细胞中,并赋予药物耐药性特征.
目前,脂质体、聚合物纳米粒子、无机纳米粒子等体系被大量报道,可应用于儿童白血病治疗[31-32].纳米药物递送系统不仅可以提高药物的溶解度,延长血液循环时间,还可以通过靶向修饰选择性地在理想部位释放药物,能够增强治疗效果和降低全身毒性;通过聚合物改性,纳米粒子可以延长药物的血液循环时间,提高病灶内的药物浓度;通过在病灶微环境中引入反应释放基团可以实现药物的敏感释放.多个药物分子的共载可以克服药物难以同时给药的限制,降低单一药物的耐药性.然而,大多数纳米递送系统仍处于实验阶段,存在安全性、靶向性、药物释放反应不足等诸多问题,距离具体的临床应用还有很长的路.在临床应用之前,需要对纳米药物的长期毒性、生物相容性、药代动力学和生物分布进行全方面评估.
3 总结与未来展望
随着新型抗癌疗法的成熟,越来越多的纳米药物也被FDA 批准,从而改善了儿科癌症患者的预后.尽管如此,治疗耐药儿童癌症的有效策略仍然是一大难点,只有少数纳米药物获准用于儿童患者.由于儿童和成人不同的代谢率,药物耐受剂量也不同,因此确定最佳剂量更具挑战性.只有充分认识儿童与成年人之间的生理差异,才能有针对性的进行临床试验.临床试验所面临的伦理问题和体外实验的不足使得研究儿科癌症注定将是一个道阻且长的过程.纳米技术在针对儿科肿瘤的特异性上具有特殊优势,通过对肿瘤组织的特殊靶向作用,可以极大地增强对肿瘤组织的显像和治疗效果.我们相信,在不久的将来,基于纳米技术策略在儿科癌症的诊疗领域能够取得飞跃性的进步!

