液相色谱–串联质谱法测定生活污水中8种芬太尼类化合物
周洁丹,孟辰颖
(广东粤港澳大湾区国家纳米科技创新研究院,广州 510535)
20 世纪60 年代,比利时化学家Paul Janseen 采用N-苯乙基-4-哌啶酮为原料人工合成芬太尼,其镇痛效果相当于吗啡的50~100 倍,后被广泛用于手术室或重症监护室的麻醉与镇痛[1-2]。芬太尼类物质具有药效强、制作成本低、易合成且易获得新型衍生物等特点,近年来作为新精神活性物质的第三代毒品代表之一在全球特别是欧美发达国家中泛滥[3-4]。芬太尼类物质会产生较强的呼吸抑制作用,致死率高,例如美国自2013 年以来,涉及合成阿片类药物的致死率明显上升,2018 年死亡人数超过31 000人,且主要为芬太尼类物质[5]。鉴于当前的芬太尼类物质滥用问题越来越突出,各国纷纷采取不同措施对芬太尼进行管控,我国从2019 年5 月1 日起将芬太尼类物质列入《非药用类麻醉药品和精神药品管制品种增补目录》,进行整类列管。因此,建立一种芬太尼类物质的有效监测方法,真实客观反映芬太尼类物质的实际消费现状,将有助于相关部门及时制定有效的预防及管控措施。
2005 年Zuccato 等[6]首次将污水流行病学方法应用于监测可卡因的使用及当地非法药物使用趋势。相较于传统的调查方法,污水流行病学具有实时性、适用范围广、成本低等特点,现该项技术已在全球推广[7]。污水流行病学主要基于测定特定区域内污水中的特定物质及代谢物浓度,进而估计特定滥用药物消费情况,并提供有关滥用药物消费水平、时间趋势和空间分布的信息[8]。目前已报道采用污水流行病学方法监控毒品的滥用情况主要集中在甲基苯丙胺、氯胺酮、海洛因、摇头丸等常规毒品[9-11],较少涉及新精神活性物质特别是芬太尼类物质[12]。采用污水流行病学方法监控污水中药物滥用情况,其核心部分是建立污水样品前处理及分析方法。污水中目标物浓度较低,通常在ng/L 级别,需要先对目标物进行富集再进行仪器分析。目前文献报道用于芬太尼类物质的仪器分析检测技术主要有气相色谱-质谱法[13]、液相色谱-串联质谱法等[14],样本类型大部分为血液、尿液等生物样品,缺乏针对污水样品中芬太尼类物质的系统性方法探讨。
笔者利用固相萃取-液相色谱-串联质谱技术,对样品处理条件和检测方法进行探讨验证,建立一种适用于生活污水中8种芬太尼类物质的定量分析方法,结合污水流行病学方法,可用于监测评估该类药物的实际滥用情况。
1 实验部分
1.1 主要仪器与试剂
液相色谱-串联质谱联用仪:TripleQuad 4500型,美国AB Sciex公司。
全自动固相萃取仪:Fotector plus 型,睿科集团(厦门)股份有限公司。
涡旋振荡器:CubicD 型,广州四亿科学仪器有限公司。
全自动氮吹仪:AutoEVA-60 型,睿科集团(厦门)股份有限公司。
纯水机:Elix Essential 3 & Milli-Q IQ 7000 型,美国Millipore公司。
固相萃取柱:Oasis PRiME HLB 型,60 mg,3 mL。
芬太尼标准溶液:芬太尼(1 000 mg/L),丙烯酰芬太尼(100 mg/L),戊酰芬太尼(100 mg/L),异丁酰芬太尼(100 mg/L),呋喃芬太尼(100 mg/L),乙酰芬太尼(50 mg/L),奥芬太尼(100 mg/L),对4-氟丁酰芬太尼(100 mg/L),芬太尼-D5(100 mg/L),美国Cerilliant公司。
甲醇、乙腈:色谱纯,美国Fisher Scientific公司。
甲酸:色谱纯,阿拉丁试剂(上海)有限公司。
其它试剂均为分析纯。
实验用水为超纯水,由Millipore纯水机制备。
1.2 样品预处理
污水样品过滤后,移取50 mL 污水样品,加入25 μL 的200 ng/mL 芬太尼-D5 标准溶液作为内标,分别使用4 mL 甲醇和4 mL 纯水对HLB 固相萃取小柱依次进行活化,将加入内标的污水样品通过HLB 固相萃取小柱,上样流量控制为2 mL/min,然后用4 mL水淋洗HLB柱,再用4 mL甲酸-甲醇混合溶液(体积比2∶98)洗脱目标物,收集洗脱液,于50 ℃氮吹至近干,加入200 μL 甲醇溶解,涡旋混匀,滤膜过滤后上机分析。
1.3 色谱条件
色谱柱:Kinetex Biphenyl 柱(100 mm×3.0 mm,2.6 μm,美国Phenomenex 公司);流动相:A 为0.1%甲酸-水溶液,B为0.1%甲酸-乙腈,梯度洗脱,梯度洗脱程序:0~1.0 min 为5%B 相,1.0~8.0 min 为5%~95% B 相,8.0~10.0 min 为95% B 相,10.0~13.0 min为5%B相;流动相流量:0.4 mL/min;柱温:40 ℃;进样体积:5 μL。
1.4 质谱条件
离子源:ESI 源,正离子模式;离子源温度:550 ℃;气帘气:206.8 kPa;离子化电压:3 000 V;雾化气压力:275.8 kPa;辅助气压力:379.2 kPa;监测模式:多反应监测(MRM);目标物的MRM参数见表1。
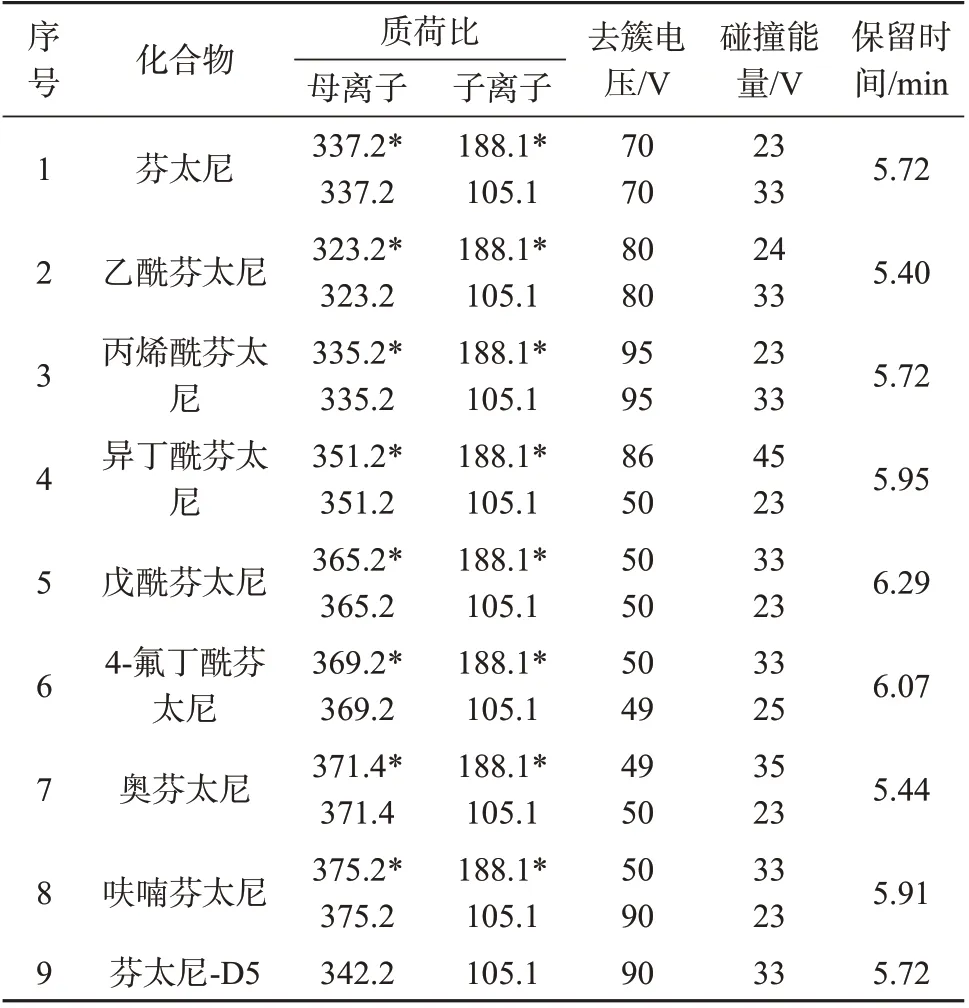
表1 8种芬太尼类物质和芬太尼-D5的MRM质谱参数与色谱保留时间
2 结果与讨论
2.1 质谱参数分析
在一级全扫描质谱中8种芬太尼类物质及芬太尼-D5主要生成[M+H]+准分子离子,目标物均含有叔胺结构,其在溶液中易获得质子形成[M+H]+准分子离子峰。进一步对准分子离子[M+H]+进行产物离子扫描,8种芬太尼类物质的主要碎片离子为m/z188 和m/z105。其中m/z 188 的碎片离子为准分子离子β-键断裂后所形成;哌啶环进一步裂解形成m/z105碎片离子[15];m/z188的碎片离子响应较强,故选取其作为多反应监测(MRM)的定量离子,m/z105 碎片离子为定性离子;选取芬太尼-D5 的m/z105的碎片离子作为定量分析时的监测离子。芬太尼的一级全扫描质谱图和二级质谱图见图1。
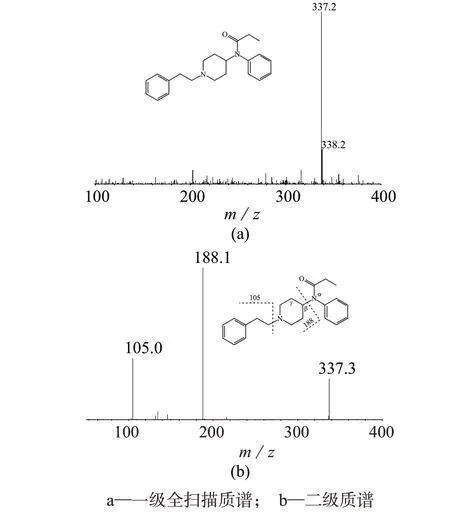
图1 芬太尼的质谱图
2.2 样品处理条件
2.2.1 固相萃取小柱选择及样品pH的影响
由于污水中目标物浓度较低,故采用固相萃取方法对样品作进一步富集。目前常用于污水中滥用药物前处理的固相萃取小柱有MCX、HLB、C18、MAX 柱等。结合芬太尼的性质,选取Oasis PRiME MCX 和HLB 两种固相萃取柱对8 种芬太尼类物质进行考察。
取50 mL 空白样品,加入25 μL 100 ng/mL 含8种目标物的混合标准溶液和25 μL 200 ng/mL 的芬太尼-D5 内标,以获得50 ng/L 的加标样品(含100 ng/L 的芬太尼-D5 内标),分别采用HLB 和MCX 进行固相萃取,通过回收率考察富集效率,同时考察样品在不同pH条件下,HLB柱对8种芬太尼类化合物的富集效果。使用MCX 柱进行固相萃取时,提前调节样品pH值至小于2,淋洗液改为用2 mL水和2 mL甲醇依次淋洗SPE柱,选用4 mL 5%氨-甲醇溶液作为洗脱液,其它步骤与HLB 柱相同。表2 为不同固相萃取柱及样品pH 值条件下化合物的富集效率。从表2可知,两种固相萃取小柱均能富集到8种芬太尼,当样品pH 2 和pH 7 时,8 种芬太尼类物质在HLB 柱上的富集效果与MCX 柱无明显区别,用HLB柱富集pH 11样品时,8种芬太尼的回收率明显下降(21.6%~60.7%)。考虑HLB 固相萃取柱填料是亲脂性二乙烯苯和亲水性N-乙烯基吡咯烷酮单体按一定比例组成的大孔共聚物,可吸附酸性、中性、碱性化合物,通用性更强,便于后续目标物拓展的特点,因此选择HLB固相萃取柱对样品进行净化富集,过柱前确认样品pH 值为7(大部分污水样品pH接近7,通常情况下无需专门调节pH值)。
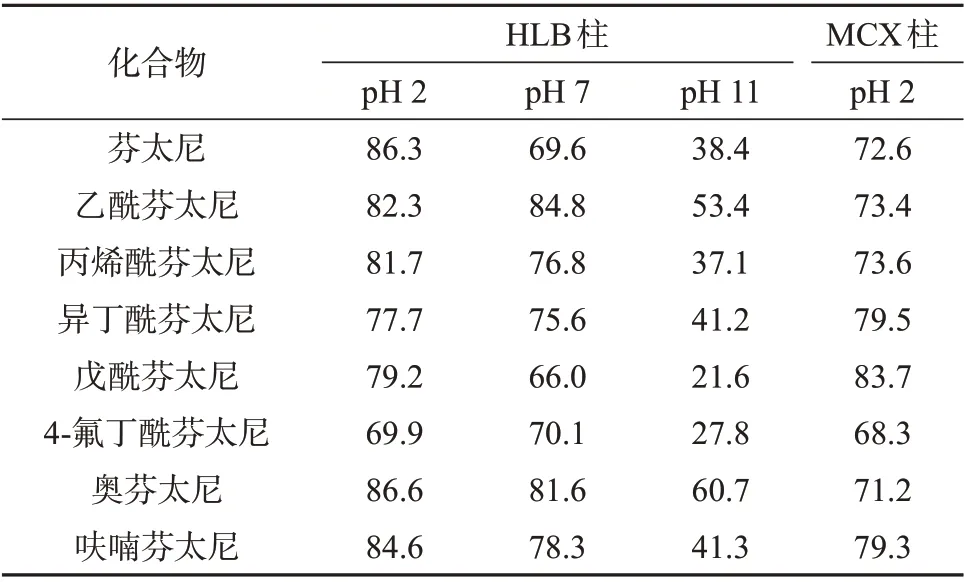
表2 不同固相萃取柱及样品pH值条件下化合物的富集效率%
2.2.2 进样流量的选择
采用HLB柱作为固相萃取柱,分别选择进样流量为1、2 mL/min,考察8种目标物的萃取效率,结果如图2 所示。由图2 可见,两种进样流量条件下,8种芬太尼类物质的提取回收率无显著性差异,考虑较高的进样速度能节省分析时间,提高工作效率,故选择进样流量为2 mL/min。
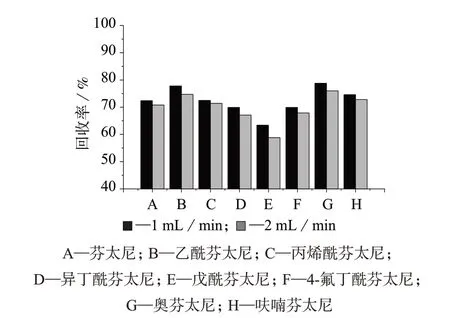
图2 不同进样速度时8种芬太尼类物质的回收率
2.2.3 洗脱液的选择
分别选取4 mL甲醇、6 mL甲醇、4 mL甲酸-甲醇混合液(2∶98)为洗脱液进行对比试验,考察不同洗脱条件下8种分析物的回收率,结果见图3。由图3 可知,当甲醇体积增加为6 mL 后,回收率并没有提高反而下降,原因可能是氮吹时间延长导致目标物损失。当加入4 mL甲酸-甲醇混合液(2∶98)时,回收率有所提高,故选择4 mL 甲酸-甲醇混合液(2∶98)作为洗脱液。
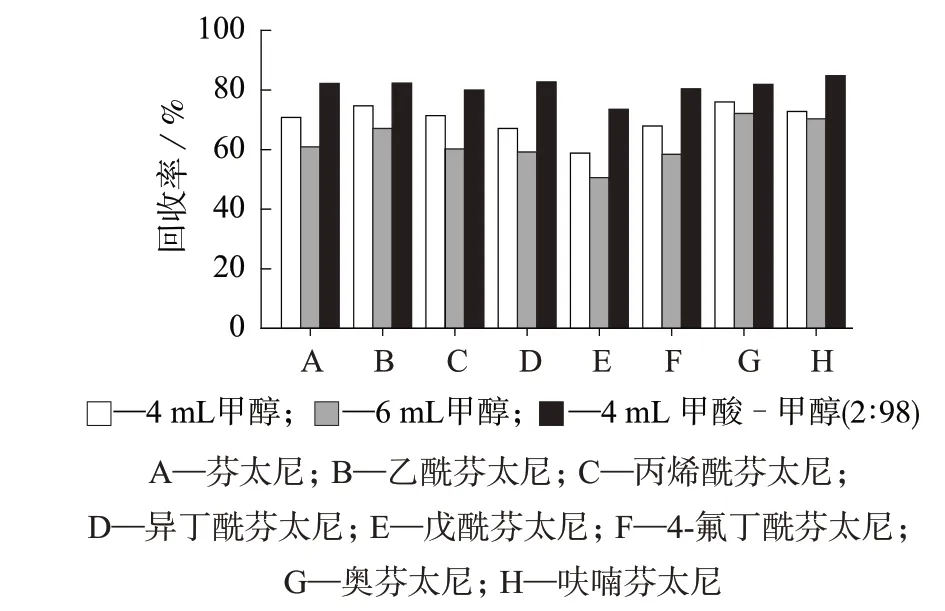
图3 不同洗脱液条件下8种芬太尼类物质的回收率
2.2.4 复溶液的选择
分别选用200 μL 甲醇-水溶液(1∶1)、甲醇-水溶液(7∶3)、甲醇作为复溶液,考察不同复溶液对目标物复溶能力,结果见图4。由图4 可知,采用甲醇进行复溶时,8 种目标化合物整体回收率水平较其它两种溶剂高,故选取200 μL甲醇作为样品浓缩后的复溶溶剂。
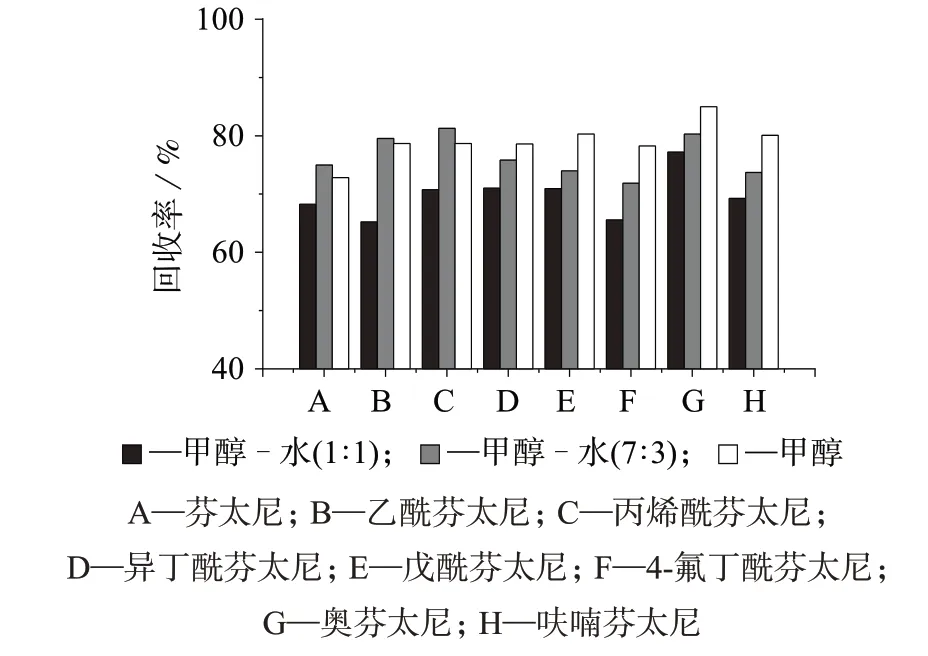
图4 不同复溶液下8种芬太尼类物质的回收率
2.3 基质效应
分别在2 ng/L和50 ng/L两个添加浓度水平下,进行以下两组实验:以甲醇为溶剂的标准物质溶液(含内标)(组1);样品基质中添加对应浓度标准溶液(含内标)(组2);绝对基质效应=A2/A1×100%,内标校正后的基质效应=R2/R1×100%,其中A为目标物的峰面积,R为目标物与内标的峰面积比。表3为8种芬太尼类物质的基质效应。由表3 可见,绝对基质效应为39.8%~59.2%,说明存在明显的基质抑制效应。采用芬太尼-D5 进行校正后,基质效应为70.8%~107.4%,说明芬太尼-D5可有效补偿基质效应,因此选用芬太尼-D5作为内标,用于后续定量分析以提高准确性。
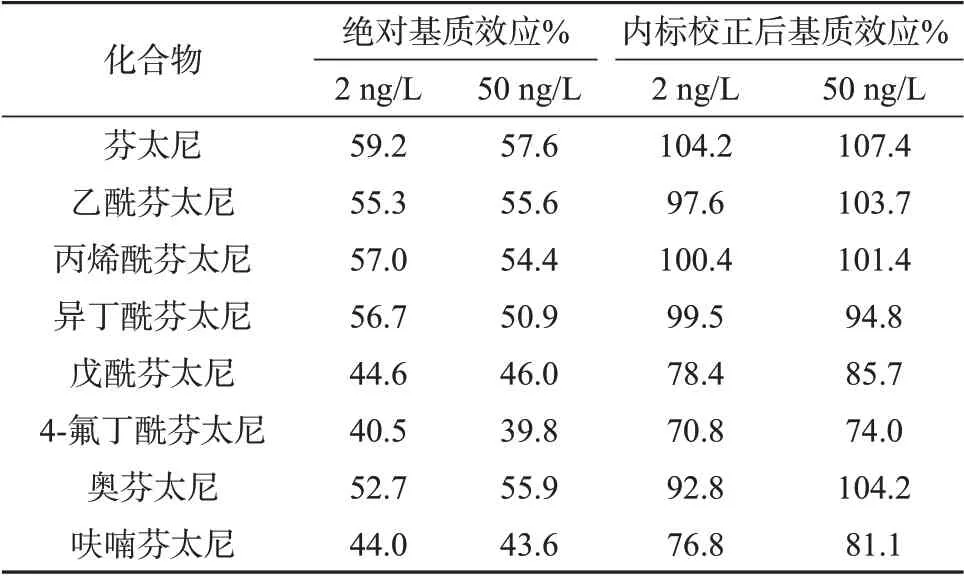
表3 8种芬太尼类物质的基质效应
2.4 线性范围与检出限
采用甲醇配制质量浓度为1~200 ng/L 的系列混合标准工作溶液,以目标物定量离子与内标物(芬太尼-D5)的色谱峰面积比(y)为纵坐标、目标物质量浓度(x)为横坐标进行线性回归,建立标准工作曲线。分别以信噪比不小于3和10确定方法的检出限和定量限。表4为8种芬太尼类物质的线性方程、相关系数、检出限与定量限。由表4 可知,8 种目标化合物在1~200 ng/L 线性范围内的相关系数为0.999 4~0.999 8,均大于0.995,表明目标物与芬太尼-D5的色谱峰面积比与目标物质量浓度线性关系良好,8 种芬太尼类物质的检出限均能达到0.3 ng/L。
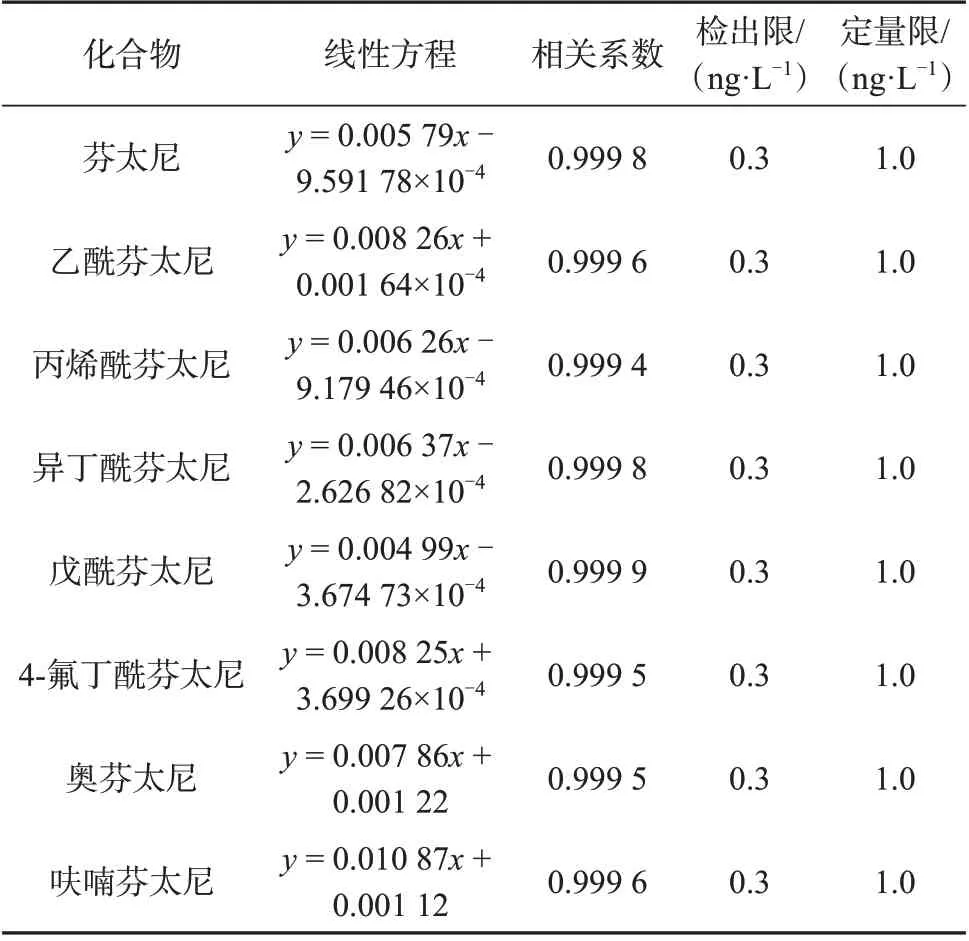
表4 8种芬太尼类物质的线性方程、相关系数、检出限与定量限
2.5 加标回收试验
取空白水样,添加含8 种目标物的混合标准溶液,添加质量浓度水平分别为5、50、200 ng/L,按照1.2 方法使用HLB 柱进行样品预处理后上机分析,以内标法定量,平行测定6次,计算测定值的相对标准偏差以评估精密度,计算回收率以评估方法的准确度,试验数据见表5。由表5可知,8种目标物测定结果的相对标准偏差为2.7%~12.6%,3个加标水平下平均回收率为73.8%~109.7%,满足分析要求。

表5 加标回收与精密度试验结果
3 结语
使用HLB柱作为固相萃取柱对生活污水中8种芬太尼类物质进行富集净化,采用甲酸-甲醇混合液(体积比2∶98)对目标物进行洗脱,氮吹复溶后采用液相色谱-串联质谱,内标法进行定量分析,并在优化后的条件下对基质效应、线性范围、准确度及精密度等方法技术参数进行系统验证,结果表明所建立的方法具有较低的检出限、较高的回收率及良好的精密度,适用于生活污水中芬太尼类物质的定量检测。

