2017年夏季长江口浮游植物暖水种增多现象分析
孙振皓,盛留洋,江新琴,马 晓,王 斌,曾江宁,江志兵*
(1.自然资源部海洋生态系统动力学重点实验室,浙江 杭州 310012; 2.自然资源部第二海洋研究所,浙江 杭州 310012; 3.自然资源部长三角海洋生态环境科学野外观测研究站,浙江 舟山 316021;4.卫星海洋环境动力学国家重点实验室,浙江 杭州310012; 5.浙江大学海洋学院,浙江 舟山316021;6.浙江海洋大学水产学院,浙江 舟山 316022)
0 引言
浮游植物为海洋生态系统中初级生产力的主要贡献者,是浮游动物和鱼虾幼体的重要食物来源,还可以指示海洋环境变化[1]。浮游植物群落的异常波动与其生活的环境密切相关[2]。近年来,气候变化导致全球海表温度上升[3],中国近海也有显著的增温[4]。在长江冲淡水、台湾暖流和黑潮水等水团的共同影响下,长江口水文情况复杂、生态环境多变[5-6]。关于长江口浮游植物的生态类群构成已有报道:何青等[7]研究表明,长江口浮游植物物种多为温带近岸种,少数为暖水种;李俊龙 等[8]指出,广温种中肋骨条藻(Skeletonemacostatum)在长江口浮游植物中占绝对优势;江志兵 等[9]调查发现,广温种尖刺伪菱形藻(Pseudo-nitzschiapungens)在长江口浮游植物中优势度最高。但随着全球变暖加剧和暖流水势力增强[4,10-12],长江口浮游植物暖水种可能随之增加。本研究在2017年夏季对长江口浮游植物进行拖网调查,分析其优势种组成与分布特征,结合环境因子探讨浮游植物暖水种增多的原因。研究结果有助于进一步理解气候变暖和环流变化背景下近海浮游植物群落的演变格局。
1 材料与方法
1.1 调查海域
于2017年夏季(8月)对长江口海域浮游植物群落和温度、盐度等环境因子进行调查,调查共设38个站位,具体分布见图1。

图1 长江口海域采样站位Fig.1 Sampling stations in the Changjiang Estuary
1.2 样品采集与方法
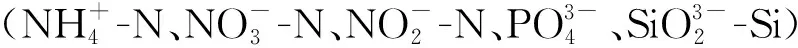
1.3 数据处理
每个站位物种总个体数除以滤水量得到浮游植物丰度,计算每个物种的平均丰度占浮游植物总丰度的比例,将百分比>1%的物种定为优势种。站位图采用Surfer 18.1绘制,浮游植物丰度、温度、盐度的平面分布图用ODV 5.4绘制,暖水种丰度与环境因子的斯皮尔曼相关性分析通过SPSS 26.0进行。
2 结果与分析
2.1 环境因子
2017年夏季长江口表层水温高值区在长江口门处和调查区域东南部,最高温度均约29 ℃(图2a)。长江口底层温度的高值区沿岸分布,温度为27~29 ℃,受黑潮次表层水入侵和北部的黄海冷水团影响,在长江口南部和东北部各有一个低温区,温度为18~20 ℃(图2b)。
长江口表层盐度的高值区分布在东南部,盐度大于31,盐度的低值区位于长江口门及北部冲淡水延伸处,盐度低于20(图2c)。底层低盐区仍主要在长江口门,但是没有明显的向北部延伸,盐度小于20;因黑潮次表层水入侵,东南部底层盐度大于34,且高盐水已越过长江口、覆盖了绝大部分的调查海域,表明外海暖流水已明显影响长江口及其邻近海域(图2d)。

图2 2017年夏季长江口表、底层温度及盐度分布Fig.2 Distribution of temperature and salinity of surface and bottom water in the Changjiang Estuary during summer of 2017
2.2 浮游植物群落优势种
本次调查共鉴定出浮游植物7门86属205种(含变种、变型和未定种),总细胞丰度为1.47×105个/L。其中,硅藻种类最多(45属127种),细胞丰度为1.41×105个/L,占浮游植物细胞总丰度的 95.82%;甲藻种类数次之(21属54种),细胞丰度为1.75×103个/L,占浮游植物细胞总丰度的1.19%;其余门类(蓝藻、绿藻、金藻、定鞭藻和隐藻)种类数较少(20属24种),细胞丰度为4.25×103个/L,占浮游植物细胞总丰度的3.00%。
本区域优势种共有10种,其中暖水种有6种,分别为柔弱伪菱形藻(Pseudo-nitzschiadelicatissima)、铁氏束毛藻(Trichodesmiumthiebautii)、距端假管藻(Pseudosoleniacalcar-avis)、劳氏角毛藻(Chaetoceroslorenzianus)、翼鼻状藻(Probosciaalata)和巨圆筛藻(Coscinodiscusgigas),细胞丰度合计为68.94×103个/L,占浮游植物总丰度的47.00%;广温种有4种,分别为骨条藻(Skeletonemaspp.)、尖刺伪菱形藻、窄隙角毛藻(Chaetocerosaffinis)和笔尖形根管藻(Rhizosoleniastyliformis),细胞丰度合计为 52.12×103个/L,占浮游植物总丰度的 35.52%。柔弱伪菱形藻是该海域的主要优势种,平均丰度为 56.35×103个/L,其丰度占比为38.41%。此外,铁氏束毛藻、距端假管藻、劳氏角毛藻、翼鼻状藻和巨圆筛藻等暖水种在长江口浮游植物群落中的百分比和出现频率均较高(表1)。

表1 长江口浮游植物优势种的平均丰度、丰度占比和出现频率Tab.1 Average abundance, percentage and frequency of dominant phytoplankton species in the Changjiang Estuary
2.3 暖水种浮游植物的细胞丰度分布
暖水种细胞丰度总体分布基本一致(图3),大多在长江口北部较高、长江口门处较低。其中柔弱伪菱形藻和巨圆筛藻在长江口及研究区南部细胞丰度也较高,但两者的极高值分布稍有不同。柔弱伪菱形藻细胞丰度最高的是B7站位(达703.29×103个/L),铁氏束毛藻细胞丰度最高的是N1站位(达66.67×103个/L),距端假管藻细胞丰度最高的是N6站位(达29.49×103个/L),劳氏角毛藻细胞丰度最高的是J3站位(达29.81×103个/L),翼鼻状藻细胞丰度最高的是J3站位(达34.61×103个/L),巨圆筛藻细胞丰度最高的是E1站位(达13.54×103个/L),基本都位于长江冲淡水与台湾暖流形成的锋面(参考图2c中27.5~30等盐线)。
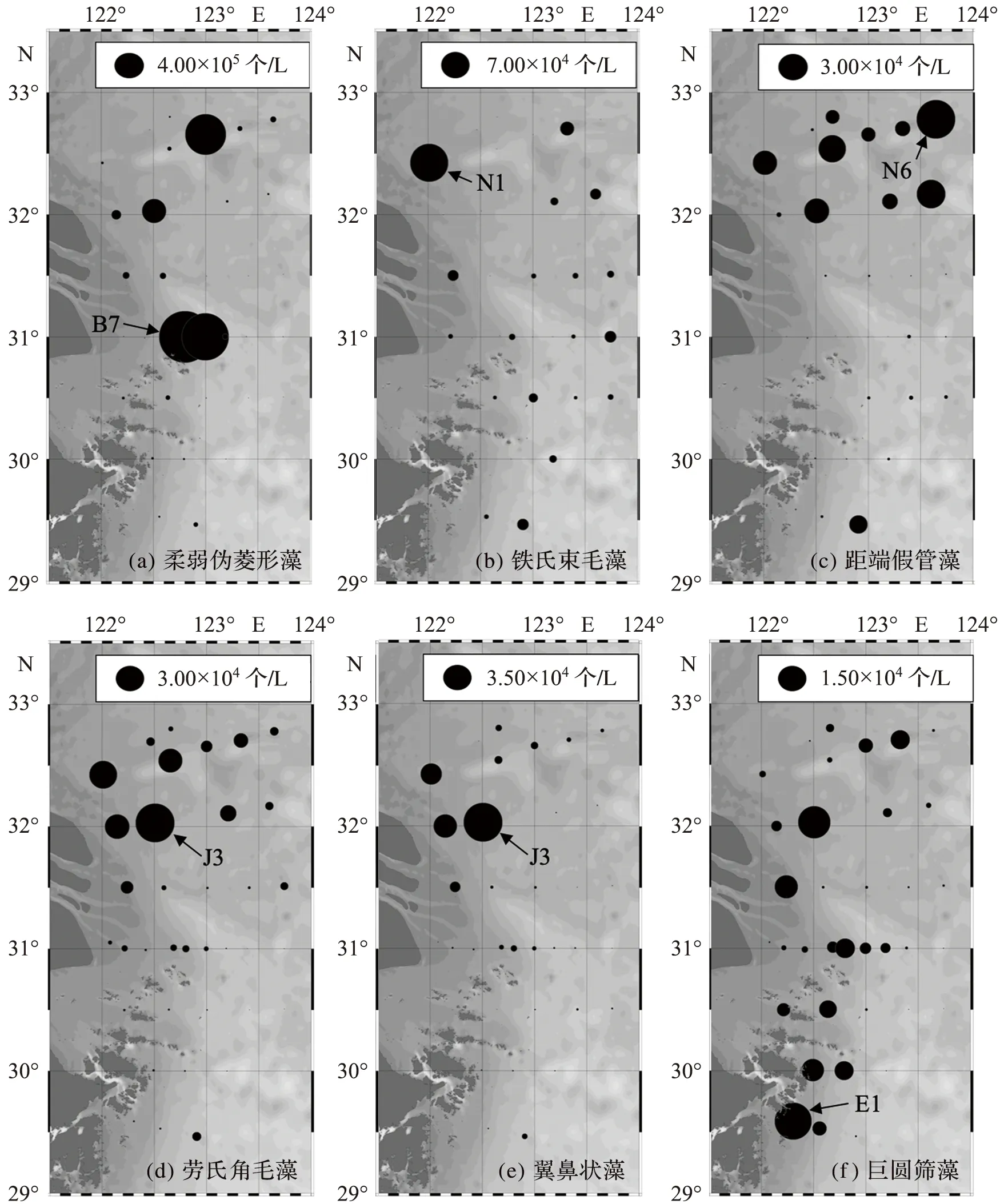
图3 2017年夏季长江口浮游植物暖水种丰度分布Fig.3 Distribution of warm-water species abundance of phytoplankton in the Changjiang Estuary during summer of 2017
2.4 相关性分析
相关性分析表明:柔弱伪菱形藻丰度与表层盐度呈显著负相关,表明其在低盐度的环境中丰度较高;铁氏束毛藻丰度与表层盐度呈显著正相关,表明其在高盐度的环境丰度较高;劳氏角毛藻丰度与底层盐度、磷酸盐质量浓度呈极显著负相关,与DIN、硅酸盐质量浓度和底层温度呈正相关,表明其在低盐、低P以及高温、高N和高Si的环境中丰度较高;翼鼻状藻丰度与磷酸盐质量浓度呈显著负相关,表明其在低P的环境丰度较高;距端假管藻丰度与表层盐度呈极显著正相关,与磷酸盐质量浓度呈极显著负相关,表明其在高盐、低磷酸盐的环境丰度较高;巨圆筛藻丰度与表层温度、盐度和底层盐度呈负相关,与DIN质量浓度呈正相关,表明其在低温、低盐、高N的环境丰度较高。浮游植物暖水种丰度与浊度均无显著相关性,表明浊度不是影响浮游植物暖水种分布的限制因子(表2)。

表2 浮游植物暖水种丰度与海水环境因子间的相关系数Tab.2 Correlation coefficient between warm-water species abundance of phytoplankton and physicochemical factors
3 讨论
3.1 浮游植物群落与环境因子的关系
受长江冲淡水、台湾暖流水和黄海冷水团等水团影响,长江口浮游植物群落组成复杂、物种丰富度高。本次调查共检出浮游植物7门86属205种,包括暖水种、广温种和温带种。在长江冲淡水与台湾暖流交汇形成的锋面透明度较高、营养盐丰富,使得锋面附近有较高的浮游植物细胞丰度(图3)。本次调查中硅藻占浮游植物细胞总丰度的95.82%,是长江口海域主要的浮游植物,这与以往结果一致[8-9]。本次调查发现柔弱伪菱形藻是该海域丰度(5.63×104个/L)最高的物种,而不是以往的骨条藻或尖刺伪菱形藻等(表3)。长江口门附近海域营养盐丰富,浊度也较高,浮游植物细胞丰度很低,表明浮游植物的生长受到光限制影响,这与其他河口的研究结果类似[17]。GONG et al[18]指出,在受台湾暖流影响的高透明度、寡营养海域,由于水体层化加剧,营养盐是限制浮游植物生长的主要因素。综上所述,浮游植物丰度和群落组成会随着河口区环境因子(盐度、浊度和营养盐等)的改变表现出明显变化。
3.2 温度升高对浮游植物群落的影响
自20世纪80年代以来,东海温度逐渐升高[10],其中2017年是1958—2017年间东海平均海表温度的历史最高年(18.21 ℃)[11],并且也是黑潮强势年[4]。黑潮次表层水向北入侵加剧,叠加表层高温、富营养的长江冲淡水,为浮游植物暖水种向北扩张提供了适宜的生长温度和丰富的营养盐[19-21]。8月西南季风盛行,台湾暖流和黑潮次表层水向北、向岸入侵加剧,带来了丰富的暖水种[12]。本次调查的优势种中暖水种较多,与以往的研究结果有较大不同(表3),说明海水温度变化对长江口浮游植物优势种组成有重要影响,JIANG et al[22]的研究结果也佐证了这一观点。
气候变暖以及水体富营养化等环境变化深刻影响长江口海域的浮游植物群落结构[23-24]。在以往的观测中,长江口浮游植物优势种大都为骨条藻和尖刺伪菱形藻等广温种,暖水种的丰度和出现频率相对较低(表3),但在本次调查中,柔弱伪菱形藻、距端假管藻、劳氏角毛藻、翼鼻状藻和巨圆筛藻等暖水种在长江口海域占据绝对优势,且分布广泛,出现频率分别达到0.86、0.75、0.92、0.89和0.97。表3列出了近30年来夏季长江口及其邻近海域网采浮游植物主要优势种的组成情况,其中圆筛藻属成为优势种的年份很少,暖水种中仅有劳氏角毛藻等。综上所述,由于海温升高导致暖水种在长江口浮游植物中的比例明显上升,表明在气候变化背景下夏季长江口海域浮游植物群落已发生了较大改变。

表3 夏季长江口及其邻近海域网采浮游植物主要优势种Tab.3 Dominant net-collected phytoplankton species in the Changjiang Estuary and adjacent area during summer
3.3 暖水种增多的原因分析
《2018年中国气候变化海洋蓝皮书》显示,2017年是有完整气象观测记录以来最暖的非厄尔尼诺年,中国沿海海表温度较常年同期高1.5 ℃。在气候持续变暖的影响下,长江口海域水温逐渐升高,为浮游植物暖水种提供了适宜的生长环境[30]。而且,长江冲淡水与台湾暖流交汇形成的锋面处营养盐丰富、浊度低、光照条件良好,有利于暖水种的生长繁殖。图2 和图3表明,暖水种分布密集区位于锋面处,表层温度为26~27.5 ℃,较以往数据升高约1 ℃[9]。其中,柔弱伪菱形藻在长江口门外丰度较高,高值中心的表层温度在26 ℃左右;巨圆筛藻在舟山群岛有丰度高值区,高值中心的表层温度在27 ℃左右。随着海水温度的持续升高,暖水种在长江口及其邻近海域分布密集,这与JIANG et al[22]指出的长江口及其邻近海域产生了浮游植物优势种从温带-亚热带类群转变为亚热带-热带类群的趋势一致。
除柔弱伪菱形藻和巨圆筛藻外,其余暖水种丰度低值区均位于长江口门及外海。长江口门的高浊度、低盐度以及外海的低营养盐均限制了暖水种的生长,从而形成暖水种丰度的低值区。相关性分析表明:柔弱伪菱形藻丰度与表层盐度呈负相关,表明在长江冲淡水影响下,长江冲淡水外缘盐度较低,有利于柔弱伪菱形藻生长繁殖;巨圆筛藻与DIN质量浓度和底层温度呈正相关,表明锋面处丰富的营养盐以及下层入侵的暖流水为巨圆筛藻的生长繁殖和分布区域扩展提供了有利条件。
海水温度升高导致热带、亚热带浮游生物物种分布向北扩展的现象已有报道。ZHANG et al[31]调查表明,因全球变暖导致海水温度升高,一种亚热带浮游动物锥形宽水蚤(Temoraturbinata)在长江口海域首次成为优势种。JIANG et al[32]对一种高温、高盐的束毛藻在东海和南黄海分布变化的研究发现,2011年平均丰度均明显高于上世纪70年代,2011年以前该种丰度、出现频率在长江口北部和南黄海南部均较低,但在2011年秋季长江口海域和南黄海南部出现高值。
4 结论
受长江冲淡水、台湾暖流水和黄海冷水团等水团影响,长江口浮游植物群落组成复杂、物种丰富度高。2017年夏季调查发现浮游植物优势种中暖水种有柔弱伪菱形藻、铁氏束毛藻、距端假管藻、劳氏角毛藻、翼鼻状藻和巨圆筛藻,丰度高值区位于长江冲淡水与台湾暖流交汇形成的锋面处。气候变暖与台湾暖流的入侵深刻影响长江口浮游植物群落组成,在海水温度升高和暖流水势力增强的共同作用下,长江口浮游植物暖水种增多、丰度升高且分布范围向北扩展。尽管由于物理、化学和生物学背景数据限制,对长江口浮游植物暖水种增多的原因还未完全了解,但对该现象的分析有助于进一步理解气候变暖和环流变化背景下近海生态环境的演变格局。

