子宫颈锥切术后全子宫切除时机选择*
杨 冰,范江涛
(1.广西医科大学,南宁 530022;2.广西医科大学第一附属医院妇产科,南宁 530022)
宫颈上皮内瘤变(cervical intraepithelial neoplasias,CIN)是宫颈癌的癌前病变,早发现、早诊断且规范治疗CIN是预防宫颈癌发病的关键,未经治疗的HSIL显著增加了宫颈浸润癌的风险,可在10~20年仍旧有持续存在的自然病史或进展为宫颈癌[1-2]。目前LEEP(loop electrical excision procedure)和CKC(cold knife conization)是CIN2+最常用的两种治疗方法[3],子宫颈锥切术是宫颈癌诊治过程的一个重要环节。对于经子宫锥切确诊、年龄较大、无生育要求、合并有其他妇科良性疾病如子宫平滑肌瘤等手术指征的HSIL、宫颈浸润癌、随访情况差的患者,术后通常会进行子宫切除术或广泛性全子宫切除术的后续治疗。然而,对于宫颈锥切术后再行全子宫切除术的手术时机目前尚无明确结论。本研究旨在评估宫颈锥切术后再次行子宫切除术的时间间隔对术后恢复和患者预后的影响。
1 材料与方法
1.1 资料来源 收集2012年1月至2020年6月广西医科大学第一附属医院收治的CIN2、3患者216例及宫颈浸润癌47例,共263例。所有病例均行阴道镜活检、宫颈锥切术(LEEP)并再次接受子宫切除术(包括全子宫切除术、筋膜外子宫切除术、改良根治性子宫切除术)。根据患者行宫颈锥切术后行子宫切除治疗手术的间隔时间分为4组:T1<1周(48例)、1周≤T2<2周(30例)、2周≤T3<6周(49例)、T4≥6周(136例)。纳入标准:宫颈锥切术后,再次接受子宫切除治疗,无内外科严重并发症。排除标准:无法耐受全身麻醉及开腹、腹腔镜手术,术前检查合并内外科严重并发症。
1.2 全子宫切除的适应证 经子宫锥切确诊、年龄较大、无生育要求、合并有其他妇科良性疾病手术指征的HSIL、宫颈浸润癌、随访情况差等[4]。
1.3 观察指标 (1)一般资料:年龄、孕产次、绝经状态、HPV感染、锥切术后病理结果、子宫大小(长、宽、高)。(2)手术时资料:术中出血量、Hb改变情况、手术用时。(3)近期疗效指标:住院天数、术后使用抗生素、术后并发症发生率、术后发热手术时间、术中出血量。(4)远期疗效指标:术后远期并发症发生率、死亡率、复发率、5年总生存率(overall survival,OS)和5年无病生存率(disease free survival,DFS)。对术后并发症发生的危险因素,抗生素使用、术中出血量、手术路径(开腹手术或腹腔镜手术)、手术时间间隔、手术用时、Hb改变情况等指标进行单因素方差分析,筛选出危险因素后再进一步采用logistic回归进行多因素分析。

2 结 果
2.1 研究对象的基本情况 患者的平均年龄为(48.6±6.4)岁。四组患者的年龄、孕次、产次、绝经情况、病理结果及子宫大小(长度、宽度、高度)比较,差异均无统计学意义(P>0.05),见表1。
2.2 手术结果和术后并发症比较 四组患者的术中出血量、住院天数、术后并发症(术后发热)、术后抗生素使用比较,差异均有统计学意义(P<0.05)。四组未出现肠损伤、膀胱损伤、输尿管损伤、血管损伤等术中并发症。术后并发症发生(包括T1组术后并发症有25例,其中术后发热20例,尿潴留1例,术后感染2例,胃肠道并发症(肠梗阻)1例,切口裂开1例;T2组21例,术后发热16例,尿潴留1例,术后感染2例,切口并发症(切口裂开和切口化脓感染)2例;T3组15例,术后发热13例,胃肠道并发症(急性胃肠炎)1例,切口并发症(阴道残端切口血肿)1例;T4组20例,术后发热17例,尿潴留1例,术后感染2例。再次手术患者为切口裂开的2例。见表2。
2.3 术后并发症影响因素分析 为研究术后并发症的相关危险因素,对“抗生素使用、术中出血量、手术路径(开腹手术或腹腔镜手术)、手术时间间隔、手术用时、Hb改变情况”等指标进行单因素分析(表3)。手术时间间隔(P=0.001)、HPV感染(P=0.002)是术后并发症的可疑危险因素。进一步行logistic多因素回归分析,发现时间间隔T1组(OR=3.778,95%CI为1.748~8.166,P=0.001)、T2组(OR=5.218,95%CI为2.106~12.925,P<0.001)是术后并发症发生的独立危险因素(表4)。

表2 手术结果和术后并发症比较
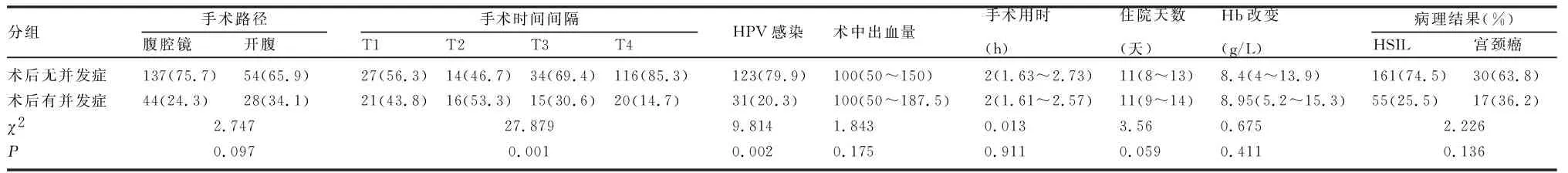
表3 术后并发症影响因素单因素分析
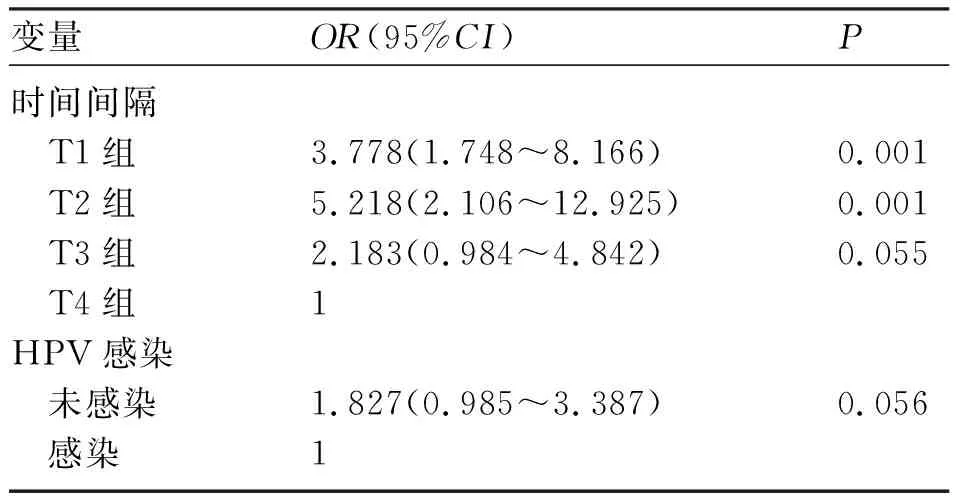
表4 术后发热影响因素多因素logistic回归分析
2.4 亚组分析 宫颈锥切术后病理提示为宫颈浸润癌患者病例中进行亚组分析,其中临床分期为Ia1期15例,Ia2期8例,Ib1期13例,纳入病例数36例。4组的住院天数(χ2=12.94,P=0.005)与术中Hb改变情况(χ2=9.927,P=0.019)差异有统计学意义;余各项术前HPV感染、术后抗生素的使用、绝经情况、术后发热情况、年龄、孕次、产次、手术用时差异均无统计学意义(P>0.05)。见表5~7。

表5 宫颈浸润癌患者基本信息
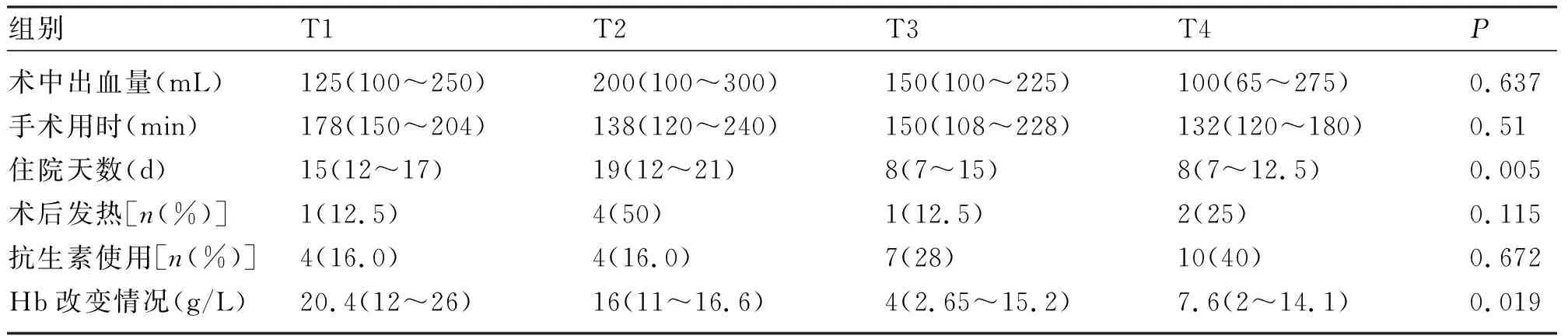
表6 宫颈浸润癌患者手术结果比较

表7 宫颈浸润癌患者术后复发单因素分析[n(%)]
2.5 宫颈浸润癌患者复发情况比较 患者均通过电话或门诊随访,随访截止2021年4月24日,中位随访时间92(12~106)个月,T1、T2、T3、T4组的中位随访时间分别为98(88~105)个月,102.5(99~104)个月,87(19.75~92.5)个月,81(18~94.5)个月。T3组复发1例(1例阴道残端鳞状细胞癌),T4组复发1例(阴道壁局部鳞状细胞癌)。4组均无死亡病例。T3、T4组的复发率[2.04%(1/49) vs 0.74%(1/136),P=0.691]比较,时间间隔对复发的影响不存在显著差异,差异无统计学意义。用Kaplan-Meier方法分析四组未复发曲线图(图1)。4组5年总体生存率为100%;T3组5年无病生存率为97.95%,T4组5年无病生存率为99.26%,差异无统计学意义(P=0.691)。

图1 四组病例复发率比较
3 讨 论
经子宫锥切确诊、年龄较大、无生育要求、合并有其他妇科良性疾病手术指征的HSIL、宫颈浸润癌、随访情况差等必须接受后续的全子宫切除术或广泛全子宫切除术。子宫颈锥切术后行全子宫切除手术的时间间隔,从20世纪50年代至今,国内外相关研究尚未定论。Williams等[5]研究认为,时间间隔选取在锥切术后48h内或者术后4周以上较好。Yin等[6]研究认为,宫颈锥切术后阴道填塞碘仿纱条是有益的,并认为全子宫切除术应在宫颈锥切术后至少4周后进行。Tae等[7]及Melnikoff等[8]研究发现,不同的手术时间间隔,术后并发症发生率、住院天数差异无统计学意义,认为任何时候都可接受行全子宫全切除术。
宫颈锥切术后行全子宫切除术,术后发热、术中出血量多、抗生素的使用较多出现在1~2周,均高于其他时间段。众所周知,宫颈锥切术后需约90天的愈合时间,这可能是时间间隔长术中出血量减少的原因。患者行宫颈锥切术后宫颈局部组织有炎症反应,在1~2周达到高峰,若此时再次行手术治疗,在分离组织和清扫淋巴过程中,对盆腔组织的损伤增加,出血可能会增加,术后需要更长的恢复时间,从而延长住院时间。本研究中多元logistic回归分析结果表明,手术时间间隔T1(OR=3.778,95%CI为1.748~8.166,P=0.001),T2(OR=5.218,95%CI为2.106~12.925,P=0.001)为术后并发症发生的独立危险因素。亚组分析中,宫颈浸润癌患者的不同手术方式的比较,差异无统计学意义。本研究发现,手术时间间隔≥6周组患者的术后发热发生率、住院天数、术中出血量、术后发热率均比T1、T2、T3组少,差异有统计学意义,提示延迟手术可能减少相关并发症的发生。手术路径不影响术后并发症发生率(P=0.097)。多因素logistics回归分析证实,手术路径不是术后并发症发生的危险因素(OR=0.92,95%CI为0.498~1.731,P=0.796),与Sullivan等[9]研究结果一致。Ni等[10]研究认为,时间间隔与手术路径相互交互影响宫颈锥切术后行全子宫切除术术后并发症的发生率。不可否认的是,不同术者的手术技巧、对手术的娴熟程度存在一定的客观因素。
本研究中发现,手术时间间隔对肿瘤预后无显著影响,但应考虑患者在等待手术过程中的焦虑心理以及这种焦虑状态对生活质量的影响。对复发的影响因素进行分析,年龄、HPV感染、肿瘤直径(>2cm)、临床分期、分化程度、淋巴结转移、浸润深度差异无统计学意义。本研究中宫颈癌晚期病例2例,余均为早期病例。定期进行宫颈防癌筛查,早发现、早诊断、早治疗对于宫颈癌的治疗至关重要。但本研究样本量较少,可能影响试验结果的准确性,有待前瞻性的多中心大样本随机对照研究。
综上所述,子宫颈锥切术后全子宫切除时间间隔应考虑在子宫颈锥切术后6周进行,延迟至6周后进行手术有助于缩短住院时间及降低并发症的发生;时间间隔对宫颈癌复发的影响不存在显著差异。延迟手术对恶性疾病结局的影响尚未有相关研究,考虑到宫颈癌的自然病史,延迟6周手术不太可能对疾病进展构成巨大的威胁。对于宫颈浸润癌患者,需考虑等待期间患者产生对癌症的恐惧和焦虑心理以及这种焦虑状态对生活质量的影响,确切的手术治疗时间需结合患者自身因素以及经过术者的综合评估后进行个体化选择。

