生物滴滤池的微生物多样性分析及VOC降解菌的筛选
李理 陈才 金泽坤 王友本
(1.华南理工大学 食品科学与工程学院,广东 广州 510640;2.中新国际联合研究院,广东 广州 510700;3. 广州雅创环保科技有限公司,广东 广州 511458)
随着社会工业化和城市化进程的不断推进,基于挥发性有机物(VOCs)出现的环境问题也日益严重。控制挥发性有机物的排放及挥发性有机物的治理已经成为近年来研究的热点。相对于传统处理方法,生物治理法因其运行成本低、建设简单、无二次污染等优点而备受国内外关注,逐渐成为当前挥发性有机物治理的主流。目前,生物治理法已被广泛应用到恶臭废气和VOCs的治理中[1- 2]。
活性污泥是一种由原核生物、真菌、微型动物、病毒等多种类型微生物,与它们所依附的有机物质和无机物质在一起所形成的复杂人工生态系统。活性污泥作为生物滴滤池中污染物转化的主体,其生物活性从根本上决定着一个生物处理厂对有机废气的处理能力,而生物活性又与活性污泥中的微生物息息相关。近年来,很多研究者借助高通量测序技术等生物学手段研究了许多类型活性污泥的微生物群落结构、多样性和丰度的动态变化,全面揭示了活性污泥微生态系统与有机废气处理效率之间的相关性[3- 5]。因此,探明生物滴滤池活性污泥微生态中的微生物群落结构、多样性及丰度,对理解污染物去除的微生物机制、提高生物处理厂污染物处理效率具有十分重要的意义。
本文选取广东某VOC处理系统生物滴滤池中的填料固形物进行实验研究,采用 Illumina Miseq 高通量测序技术对样品进行微生物群落与多样性分析,并对相关降解基因进行预测和注释,同时为解决该工厂甲苯、二甲苯以及乙酸丁酯降解不充分的问题,利用唯一碳源培养基,从污泥中分离、驯化筛选了一批有降解潜力的菌株,有望通过生物强化手段改变生物滴滤池中的微生物群落结构,提高甲苯和二甲苯等苯系污染物的降解效率。
1 材料与方法
1.1 样品与培养基
样品采自广州市某油漆公司VOC处理系统中生物滴滤池的填料固形物。用干净无菌袋在生物滴滤池中取少量污泥样品,取样后24 h内带回实验室,进行实验测定分析或样品处理。剩余样品于-80 ℃冰箱中保存。
驯化培养基:KH2PO4338.8 mg,Na2HPO4·12H2O 890.7 mg,(NH4)2SO4234.0 mg,Na2CO3100.0 mg,MgSO4·7H2O 59.3 mg,CaCl2·2H2O 5.16 mg,FeSO4·7H2O 0.37 mg,1 mL微量元素母液,蒸馏水1 000 mL,固体培养基加1.5%的琼脂。
筛选培养基:K2HPO4·3H2O 1 g,KH2PO41 g,(NH4)2SO40.5 g,MgSO4·7H2O 0.36 g,KNO30.5 g,CaCl20.001 g,1 mL微量元素母液,蒸馏水1 000 mL,固体培养基加1.5%的琼脂。
微量元素母液:FeCl2·4H2O 1 500 mg,Na2MoO4·2H2O 24 mg,CoCl2·6H2O 190 mg,ZnCl270 mg,MnSO4·7H2O 100 mg,MnCl2·4H2O 6 mg,CuCl2·2H2O 2 mg,NiCl2·6H2O 24 mg,蒸馏水1 000 mL。
LB培养基:蛋白胨 10 g,酵母提取物5 g,NaCl 10 g,蒸馏水1 000 mL,固体培养基加1.5%的琼脂。
1.2 试剂与仪器
主要试剂:细菌DNA提取试剂盒,北京博迈德基因技术有限公司生产;50×TBE(Tris硼酸)缓冲液、超纯水、PCR Mix、DNA分子质量标准Marker12、Gold view核酸染料、PCR产物纯化试剂盒,均购自广州东盛生物科技有限公司;引物27F、引物1492R,购自上海生工生物工程技术有限公司。
主要仪器:XSP-BM- 3CA生物显微镜,上海雷韵试验仪器制造有限公司生产,TC- 96/G/H(b)C PCR扩增仪,杭州博日科技有限公司生产;BG-gdsAUTO(130)凝胶成像系统,北京百晶生物技术有限公司生产;JW- 2010H高速离心机,安徽嘉文仪器设备有限公司生产;Agilent Technologies 767A气相色谱仪,安捷伦科技有限公司生产。
1.3 活性污泥宏基因组PCR扩增与测序
本实验基于Illumina Miseq高通量测序平台,采用全基因组鸟枪法(WGS)策略,将提取获得的菌群宏基因组总DNA随机打断为短片段,并构建合适长度的插入片段文库,然后对文库进行双端(PE)测序。
1.4 测序数据分析
采用FastQC对测序产生的原始数据进行质量控制,包括碱基质量分布、序列平均质量分布、碱基含量分布等,然后按照筛查标准进行有效序列的筛查过滤[6]。
序列的组装拼接:以K-mer~的参数设置,调用megahit(https:∥hku-bal.github.io/megabox/)[7],对每个样本的双端序列分别进行从头组装拼接,通过De Bruijn图构建Contigs和Scaffolds序列,并对生成的Contigs和Scaffolds序列进行组装拼接效果评价。
非冗余序列集的构建:将拼接组装的宏基因组Scaffolds序列以2个连续的模糊碱基“N”为界,拆分为Scaftigs。随后采用CD-HIT(高容错性的集群数据库)对样本组装拼接得到的所有Scaffolds,以0.95的相似度且覆盖范围大于0.9进行归并取冗余,并以最长的序列作为该Scaftig的代表序列。
将生物滴滤池样本(lcyp)的Scaffolds/Scafftigs序列与NCBI-NT数据库(ftp:/ftp.ncbi.nih.gov/blast/db,v2016- 6- 19)中的细菌、古菌、真菌和病毒序列进行序列比对(E值[8]设定为0.001)。结合Scaffolds/Scaftigs序列在各样本中的丰度(深度)数据,获得样本在各个分类等级(界、门、纲、目、科、属、种)上的相对丰度分布。
1.5 功能基因的预测和注释
对于上述拼接和分装得到的高质量基因组,根据基因在Scaffolds/Scaftigs 上的起始和终止位点,使用soap.coverage(http:∥soap.genomics.org.cn/)可以得到各蛋白代表序列在各样本中所对应的丰度(深度)数值,构建对应的样本×蛋白丰度矩阵。将非冗余蛋白序列集与常用蛋白数据库比对,从而对各样本中的基因功能进行注释分析。对于蛋白质编码序列,将其与已知的注释信息数据库KEGG和EggNOG比对,得到功能注释,并检测注释的准确性,设定阈值为E<10-5。
1.6 降解菌的筛选与鉴定
准确称取5 g生物滴滤池样品接种于装有100 mL驯化培养基的250 mL锥形瓶中,通过0.22 μm滤膜添加一定浓度的甲苯、二甲苯或乙酸丁酯为唯一碳源,添加0.1%(体积分数)吐温80助溶且抑制底物的挥发,将锥形瓶置于30 ℃下,150 r/min恒温震荡培养2 d后吸取5 mL培养液,转接于更高浓度底物的新鲜培养基上。如此反复驯化2周,甲苯、二甲苯和乙酸丁酯驯化浓度梯度为:10、30、50、80、120 mg/L。分别取最后一次驯化培养物,稀释10、102、103、104、105、106倍,吸取100 μL涂布于含有100 mg/L的甲苯、二甲苯或乙酸丁酯的筛选培养基上,以封口膜密封,置于30 ℃恒温培养箱中倒置培养1 d,再将培养皿正置,培养数天。挑选平板上不同形态的优势菌落以平板划线法在筛选培养基上划线分离,重复3次后获得纯培养菌株,然后通过液体筛选培养基筛选出具有较高降解潜能的菌株,-80 ℃保藏。
使用硅胶膜离心柱法,用细菌基因组提取试剂盒提取分离菌株DNA,通过16S rDNA通用引物(27F:5′-AGAGTTTGATCCTGCTCAG-3′;1492R:5′-GGTTACCTTGTTACGACTT- 3′)进行PCR扩增,PCR扩增体系如下:DNA 1 μL,上游引物2 μL,下游引物2 μL,2×PCR Mix 20 μL,超纯水25 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,46 ℃退火30 s,72 ℃延伸1 min,循环30次;72 ℃末端延伸10 min。然后使用0.5×TBE缓冲液制备1%(质量分数)琼脂糖凝胶并加入Gold view核酸染料,之后取适量PCR产物点样并进行琼脂糖凝胶电泳,然后照胶观察。确认目标条带清晰明亮且在正确的分子质量范围后,使用PCR产物纯化试剂盒从PCR反应液中回收DNA片段。将回收得到的DNA片段送到生工生物工程(广州)公司进行DNA测序,并将拼接成功的DNA序列复制到NCBI上进行BLAST比对。
1.7 VOCs降解率的测定
将处于对数生长期的分离菌株按5%的接种量接种到含单一底物(分别为苯、甲苯、邻二甲苯、间二甲苯、对二甲苯、乙酸丁酯)的100 mg/L的无机盐培养基中,用25 mL顶空瓶培养、铝盖密封,再用封口膜密封3层以防止挥发,设置3个平行样,加等量无菌水作为空白参照,计算环境损失量。控制初始pH值为7.0,在30 ℃、140 r/min摇床上培养48 h,利用顶空气相色谱测定培养液中的苯、甲苯、二甲苯、乙酸丁酯的残余量。
顶空气相色谱条件:气相色谱仪,Agilent Technologies 767A型;色谱柱,Agilent Technologies HP- 5(30 m×0.32 mm×0.32 mm);加热箱50 ℃,定量环70 ℃,传输线80 ℃,平衡时间5 min,GC循环时间15 min,柱温40 ℃,保持3 min,之后以15 ℃/min升温到108 ℃保持3.5 min,进样口温度250 ℃,FID检测器温度250 ℃,载气(N2)流量30 mL/min,H2流量40 mL/min,空气流量450 mL/min,分流比10:1。
式中,A为降解率,ρo、ρf分别为有机物添加量和残余量。
2 结果与分析
2.1 测序质量分析
宏基因组的数据已提交给NCBI数据库(登录号:PRJNA731021)。通过高通量测序平台整理原始数据,并进行统计优化。样本测定碱基总数为11 123 195 kbp,经过拼接后,按照原始序列数据的筛查过滤标准对测序下机的原始数据进行筛选和过滤,测得有效序列总数为1 598 214条,平均长度范围为200~116 666 bp,高质量序列数占原始序列数的百分比和高质量序列的碱基总数占原始序列碱基总数的百分比分别为99.91%和99.34%。在97%相似水平下,对测序样品的有效序列进行操作分类单元(OTU)划分,并进行生物信息统计,样品得到了1 847 976个OTUs。
生物滴滤池样品的稀疏曲线和香农指数(Shannon)曲线如图1所示。在IIIumina Miseq测序结果分析中,当样品序列数量超过30 000条时,样品的稀疏曲线(见图1(a))逐步趋于平整,表明测序结果已经足够反映当前样本所包含的物种组成,再增加测序数量也不太可能检测出大量尚未发现的新物种,从而影响结果分析。同时,香农指数曲线(见图1(b))也逐渐趋于饱和,即当前测定可反映大多数微生物的信息。上述结果表明,此次测序样品中微生物分析方法较为合理,可获得有效的测序结果。
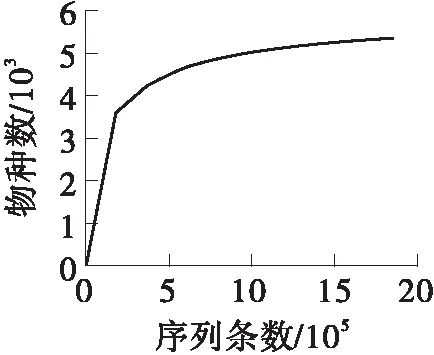
(a)稀疏曲线
考察样品内的微生物群落多样性是研究一个群落样品和解决生物学问题的重要手段[9]。通常研究微生物群落多样性的主要指标包括物种丰富度估计、群落多样性指数以及稀释曲线[10]。Ace、Chao1指数用于表征样品的物种丰富度,本样品中Ace、Chao1指数分别为5 508.18、5 357.86,与先前的报道相比,本样品中Ace、Chao1指数都明显高于一般活性污泥[11- 12],这表明本样品中拥有更高的OTU丰度。Shannon指数表征微生物群落多样性的丰富度和均匀度,Shannon值越大则说明群落多样性越高。本样品的Shannon指数为8.11,表明本样品的菌群丰富度、物种多样性很高,并形成了十分稳定的微生态系统。
2.2 微生物群落结构分析
生物滴滤池活性污泥的微生物群落结构如图2所示,活性污泥中细菌、真核生物、古菌、病毒的相对丰度分别为89.34%、1.99%、1.06%、0.03%,无法分类或未知门类相对丰度占比7.57%。样品中共检测出了微生物75门、195纲、395目、752科、1 798属。
在门水平上(见图2(a)),生物滴滤池活性污泥中占优势地位的前5个门分别为变形菌门(Proteobacteria,73.6%)、放线菌门(Actinobacteria,4.03%)、拟杆菌门(Bacteroidetes,2.1%)、厚壁菌门(Firmicutes,1.42%)和绿弯菌门(Chloroflexi,1.23%)。与先前的报道相比,本研究中的样品拥有更高比例的变形菌[11,13- 15]。大多数在生物脱氮、生物除磷及诸多污染物降解过程中起重要作用的微生物均归属于变形菌门[16],表明此活性污泥可能具有更高的有机污染物降解潜力。此外,放线菌门在降解聚乳酸、低密度聚乙烯等生物基塑料和石油基塑料领域有诸多应用[17- 18],同时对于乙酰氨基酚及其转化产物(对氨基酚、邻苯二酚和对苯二酚)等具有一定的降解能力[19],后者为芳香烃降解的常见中间产物,表明放线菌在芳香烃的降解过程中具有承接作用,为芳香烃的完全降解起到了一定的作用。拟杆菌常见于各种厌氧降解反应器中,具备促产甲烷活性[20],通过与其他碳氢降解细菌对底物的共养利用,从而大量降解芳香烃化合物[21]。研究表明,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是对石油污染土壤的生物降解影响最大的3类微生物[22],对于芳香烃类化合物的生物降解具有重要意义。
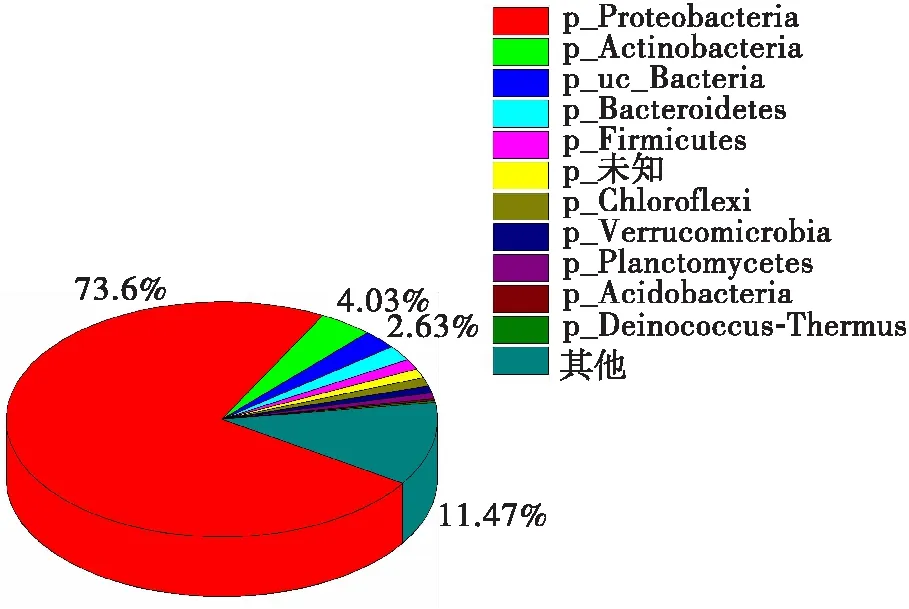
(a)门水平
细菌群落结构在属水平上的组成和丰度如 图2(b) 所示,样品中相对丰度前20的属主要是Dechloromonas(脱氯单胞菌属)、Rubrivivax(红长命菌属)、Xanthobacter(黄色杆菌属)、Pseudomonas(假单胞菌属)、Burkholderia(伯克氏菌属)、Rhodobacter(红杆菌属)、Thauera(陶厄氏菌属)、Variovorax(贪噬菌属)、Bradyrhizobium(根瘤菌属)、Leptothrix、Paracoccus、Pelobacter(居泥杆菌属)、Clostridium(梭菌属)、Azoarcus(固氮弧菌属)、Geobacter(地杆菌属)、Cupriavidus(贪铜菌属)、Methanothrix(甲烷丝菌属)、Methylibium(甲基养菌属)、Starkeya、Hydrogenophaga(噬氢菌属)。该活性污泥微生物群落结构复杂、种类繁多,并未形成绝对优势种属,相对丰度占比最高的Dechloromonas的相对丰度为5.46%,Rubrivivax、Xanthobacter、Pseudomonas的相对丰度分别为2.0%、1.9%、1.87%。Dechloromonas能在细胞内积累多磷酸盐,在去除有机碳、氮以及磷等方面起关键作用[23];此外,该菌属还具有较高的高氯酸盐和硝酸盐的还原能力[24- 25]。Burkholderia可以降解常见烃类物质,是芳烃污染的废水中的优势属[26],还可降解焦化废水中的苯酚和PAHs(芘)类物质[27]。Xanthobacter可降解卤代化合物和修复氯酸盐污染[28- 29],同时也可降解甲苯等芳香烃[30]。Pseudomonas是常见的芳香烃降解菌,可参与降解多种卤代烃以及甲苯、二甲苯等单环芳香烃化合物[31- 33]。此外,Rhodobacter、Thauera、Paracoccus和Geobacter等也常见于各种废水处理生物反应器中[34- 35]。
样品中检测出的相对丰度为前20的种水平分类如图2(c)所示,相对丰度占比前3位的为Dechloromonasaromatica(5.46%)、Rubrivivaxgelatinosus(2.0%)和Xanthobacterautotrophicus(1.89%),与属水平的分析结果一致,表明样品中脱氯单胞菌属、红长命菌属和黄色杆菌属以这3个种为主。其中Dechloromonasaromatica是还原高氯酸盐和氧化氯苯酸盐、甲苯和二甲苯的典型菌种[36- 37]。Rubrivivaxgelatinosus是一种常见于水体沉积物的菌种,其可利用各种碳水化合物及有机酸[38],但鲜有报道可用于VOC的降解。Xanthobacterautotrophicus因具有降解卤代化合物的能力而被广泛研究,具有重要的工业应用价值[28,39]。此外,样品中还检测出了Leptothrixcholodnii、Pelobacterpropionicus、Clostridiumbotulinum、Starkeyanovella、Rhodobactersphaeroides、Methylibiumpetroleiphilum、Methanothrixsoehngenii、Azospiraoryzae、Thauerasp.K11、Ramlibactertataouinensis、Caldilineaaerophila、Sorangiumcellulosum、CandidatusAccumulibacterphosphatis、CaulobacteraceaebacteriumOTSz_A_272、Sulfuritaleahydrogenivorans、Variovoraxsp.HW608、Variovoraxparadoxus等多个种,并已有Pelobacterpropionicus在异常有机物的发酵降解和共营养代谢中发挥重要作用的报道[40],其有可能对生物滴滤池中VOC的降解起促进作用。Rhodobactersphaeroides是一种重要的微生物功能菌,在生物除磷、重金属污染土壤修复等领域具有重要意义[41- 42]。此外,也有Clostridiumbotulinum、Methylibiumpetroleiphilum、CandidatusAccumulibacterphosphatis、Sulfuritaleahydrogenivorans和Variovoraxparadoxus等可降解有机磷、酯类、芳香烃等有机物的报道[43- 48],它们是重要的生物修复功能菌种。
总的来说,本研究中的活性污泥具备较高的微生物多样性及稳定性,同时具备降解卤代、烃类、酚类、芳香烃和有机塑料等多种有机污染物的功能基因。活性污泥中的主要菌属都具有降解各类有机化合物的潜力,是潜在的生物降解菌种资源库,蕴含丰富的降解菌种资源。
2.3 功能基因的预测和注释
将非冗余基因集与KEGG数据库进行比对,共870 163个Unigene注释到KEGG的代谢通路中,分属于6个大类、45个第2等级代谢通路子功能,其中代谢、遗传信息处理、环境信息处理、细胞进程4大类代谢通路占比较大,如图3所示。第2等级代谢通路子功能中占比前5位的为碳水化合物代谢、氨基酸代谢、能量代谢、辅助因子和维生素的代谢、核苷酸代谢,代谢途径占比分别为14.37%、10.76%、7.01%、4.86%、4.53%。碳水化合物代谢通路主要包括三羧酸循环、丙酮酸代谢、磷酸戊糖和糖酵解等途径,这些途径一般为微生物生长的正常代谢途径,也作为各种污染物彻底分解的最终途径。此外,在外源性生物降解与代谢子通路途径的基因注释数为26 166个,包括各种酯类、烷烃类、芳香烃类、醛类、固醇类及细胞色素等的复杂有机物的降解通路途径。以二甲苯降解通路为例,样品基因组中检测到了完整的二甲苯降解途径,包括todc1、todc2、xylE和catE等多个关键酶基因。todc1和todc2是甲苯双加氧酶的两个亚基,xylE和catE是邻苯二酚- 2,3双加氧酶,这两个酶是甲苯降解过程中的关键酶和限速酶。这些酶蛋白对应的注释基因的数量和种类众多,表明活性污泥样本中可能存在多个菌种能以此途径对二甲苯进行降解,也说明降解二甲苯的潜在菌种资源丰富。此活性污泥具有强大的降解VOC能力,可通过培养组学分离具备降解特定有机污染物的菌株,用于生物处理厂处理相应的废水、废气,具有广阔的应用前景。
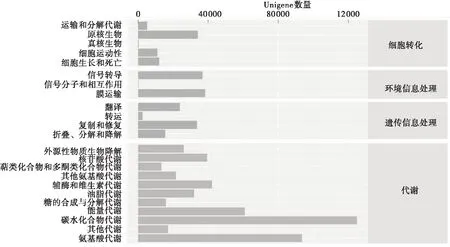
图3 KEGG第2等级代谢通路的注释结果统计图
2.4 优势降解菌株的筛选和鉴定分析
利用驯化培养基,通过3种底物(甲苯、二甲苯和乙酸丁酯)对生物滴滤池的活性污泥样品进行2周的驯化,然后用筛选培养基从活性污泥样品中分离出了54株有潜在降解能力的菌株(见表1),包括18株甲苯降解菌、21株二甲苯降解菌和 15株 乙酸丁酯降解菌。54株菌株在驯化培养基和初筛培养基上均能较好生长,如图4所示,菌株菌落呈圆形、浅黄色不透明,表面光滑湿润且有光泽,边缘光滑、中央凸起,油镜下为短杆状或球状。革兰氏染色结果显示,所筛菌种均为革兰氏阴性菌,以短杆状、球状和梭状形态为主。
(a)假单胞菌宏观菌落图
对于不同底物筛选培养基筛选出的54株有潜在降解能力的菌株,采用16S rRNA通用引物扩增菌种的保守序列,核酸凝胶电泳结果如图5所示,扩增出来的所有条带分子质量均在1 500 bp左右,每个泳道中的条带单一、清晰明亮。
图5 部分菌株基于16S rDNA序列PCR扩增产物的琼脂糖凝胶电泳图Fig.5 Electrophoretogram of 16S rDNA PCR amplification products of some isolated strains
经过PCR产物纯化并送由测序公司测序后,将拼接成功的基因序列在NCBI库进行序列比对之后选取同源性最高的菌种作为初步鉴定结果(见表1),相似度均在99%以上。16S rRNA鉴定结果显示,18株甲苯降解菌均为不动杆菌属,其中CT3、CT5、CT6与贝氏不动杆菌(Acinetobacterbereziniaestrain)的相似度为100%,CT9与鲍曼不动杆菌(Acinetobacterbaumanniistrain)的相似度为100%。21株二甲苯降解菌中有3株被鉴定为假单胞菌,分别是CX18被鉴定为假单胞菌属(Pseudomonassp.strain)、CX20被鉴定为香鱼假单胞菌(Pseudomonasplecoglossicidastrain)以及CX21被鉴定为摩氏假单胞菌(Pseudomonasmosseliistrain),其余18株均为不动杆菌,包括1株醋酸钙不动杆菌(Acinetobactercalcoaceticusstrain)、3株鲍曼不动杆菌(Acinetobacterbaumanniistrain)以及14株鉴定到属的不动杆菌。15株乙酸丁酯降解菌中有 3株 假单胞菌以及12株不动杆菌,包括4株贝氏不动杆菌(Acinetobacterbereziniaestrain)、4株皮特不动杆菌(Acinetobacterpittiistrain)以及1株醋酸钙不动杆菌(Acinetobactercalcoaceticusstrain)。

表1 54株降解菌的16S rDNA鉴定结果Table 1 Identification results of 16S rDNA of 54 strains of degrading bacteria
通过表1可以发现,从活性污泥中分离得到的以甲苯、二甲苯和乙酸丁酯为目标降解物的菌株主要是假单胞菌属和不动杆菌属两个属,说明假单胞菌属和不动杆菌属对甲苯、二甲苯和乙酸丁酯有很强的适应能力,同时极有可能具备降解多种VOC的能力。假单胞菌属是常见报道的苯系物降解菌[49- 51]。刘虹等[52]从石油污染土壤中筛选、分离出一株假单胞菌,其在35 ℃、pH值为8时对石油烃降解率达到75.4%;Feng等[53]利用恶臭假单胞菌(Pseudomonasputidasw- 3)和橡胶红球菌(RhodococcusruberSS- 4)进行生物强化,对苯、甲苯以及苯乙烯的混合废气去除效率稳定在82.5%~89.8%之间,同时有研究表明这两种菌在处理苯系物过程中具有协同作用。Chen等[54]研究发现一株Pseudomonassp.XM- 01与Acinetobactersp.XM- 02协同培养后10 d内对石油的降解率达到87.29%,比Acinetobactersp.XM- 02单独降解的降解率提升了12.97%。虽有不动杆菌可用于降解吲哚以及各种油脂的报道[55- 57],但关于其对于乙酸丁酯的降解目前还没有报道过。
2.5 优势降解菌株对VOCs的降解率分析
从54株菌中优选出两株(1株PseudomonasplecoglossicidaCX20、1株AcinetobacterpittiiCBA12)在单一底物培养基上生长状况良好的菌株,分别对苯、甲苯、邻二甲苯、间二甲苯、对二甲苯、乙酸丁酯降解率进行测定(见图6)。在以相应单一VOC为唯一碳源的培养基中两株菌都能良好生长,其中二甲苯降解菌PseudomonasplecoglossicidaCX20对不同底物的降解能力存在显著性差异(见 图6(a))。菌株CX20对甲苯、间二甲苯和对二甲苯的降解率最高,反应48 h后降解率分别达到了99.98%、88.34%和99.89%,说明PseudomonasplecoglossicidaCX20具有很好的降解甲苯、间二甲苯和对二甲苯的能力。相比较下,菌株利用苯和邻二甲苯的能力一般,降解率仅为7.25%和3.76%。PseudomonasplecoglossicidaCX20对于同样具备苯环结构的苯和邻二甲苯的降解能力如此之低,说明对于结构类似的苯系物,其降解途径也未必一样,同一菌种对其降解能力也会出现显著差异。例如,Khodaei等[58]从石油污染的地下水中分离到一株能够降解BTEX化合物的假单胞菌(Pseudomonaszhaodongensis),其能完全降解苯、甲苯和乙苯,却不能降解二甲苯。其他许多研究同样发现不同BTEX的降解难易程度存在很大差异[59- 61]。此外,邻二甲苯虽然是二甲苯的一种同分异构体,但与另外两种同分异构体相比,其对微生物的生长有更严重的生物毒性,是BTEX生物降解最有效的抑制剂[62],因此往往也难以被菌种利用。
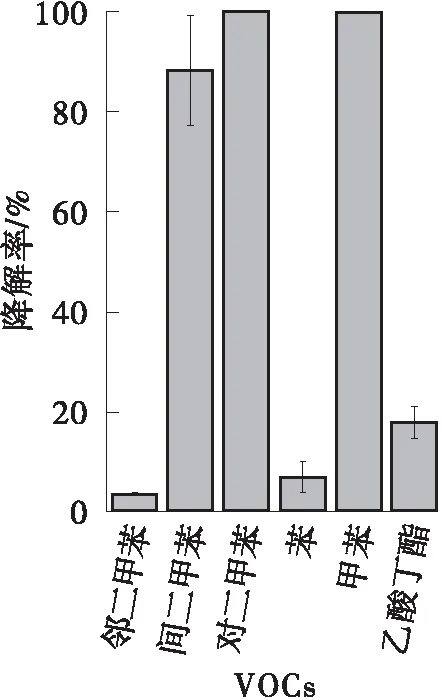
(a)CX20的降解率
乙酸丁酯降解菌CBA12(见图6(b))的情况则相反,在48 h内能把100 mg/L乙酸丁酯完全降解,但对于苯系物的降解效果却不明显,对邻二甲苯和间二甲苯稍有降解,降解率分别为7.59%和14.12%,而对苯、甲苯和对二甲苯几乎不降解,显然菌株CBA12对于乙酸丁酯具有很强的降解能力。关于乙酸丁酯降解菌种的报道比较少,Cheng等[63]利用两种真菌(AspergillusfumigatesHD- 2和OphiostomastenocerasLLC)和一种细菌(ZoogloearesiniphilaHJ)构建了一种复合固体微生物剂,对120 mg/L到180 mg/L的乙酸丁酯的降解效率均在90%以上;Mathur等[64]报道了一株Shewanellaputrefaciens在70 h内可降解500 mg/L以下的乙酸丁酯。可以看出,虽然乙酸丁酯属于较易降解VOC物质,但本研究筛选出的菌株CBA12仍不失为一种优良的乙酸丁酯降解菌,具有重要的工业应用前景。
3 结论
通过宏基因组技术,对VOC处理系统生物滴滤池中的填料固形物进行微生物群落与多样性分析显示,活性污泥的微生物以细菌为主,占总量的89.34%,主要分布为变形菌门、放线菌门、拟杆菌门、厚壁菌门和绿弯菌门等,其中变形菌门占绝对优势,远高于一般活性污泥。在属水平上主要有Dechloromonas(脱氯单胞菌属)、Rubrivivax(红长命菌属)、Xanthobacter(黄色杆菌属)、Pseudomonas(假单胞菌属)、Burkholderia(伯克氏菌属)、Rhodobacter(红杆菌属)、Thauera(陶厄氏菌属)、Variovorax(贪噬菌属)、Bradyrhizobium(根瘤菌属)、Leptothrix、Paracoccus、Pelobacter(居泥杆菌属)、Clostridium(梭菌属)、Azoarcus(固氮弧菌属)、Geobacter(地杆菌属)、Cupriavidus(贪铜菌属)、Methanothrix(甲烷丝菌属)、Methylibium(甲基养菌属)、Starkeya、Hydrogenophaga(噬氢菌属)等,活性污泥菌种资源丰富,具有酯类、烃类、芳香烃类、醛类、固醇类及细胞色素等多个降解通路基因,具备除磷除氮,降解农药、塑料、卤代烃、苯系物等多种有机物的能力。
利用驯化培养基和筛选培养基从活性污泥中共筛选出54株具有降解潜力的降解菌株,经鉴定,所筛菌株主要为不动杆菌和假单胞菌两种。对VOC的降解性能进行测定,PseudomonasplecoglossicidaCX20对甲苯、间二甲苯和对二甲苯降解效果良好,48 h内降解率分别达到了99.98%、88.34%和99.89%;而AcinetobacterpittiiCBA12能够在48 h内完全降解100 mg/L的乙酸丁酯,两株菌存在明显的底物降解特异性差异,说明通过单一底物培养基筛选不同VOC组分的降解菌是可行的。然而本实验仅使用一种唯一碳源培养基分离特异降解BTEX的菌株,培养基营养成分过于简单,绝大多数细菌无法正常生长,筛选出的降解菌种过于单一,宏基因组学研究显示,此活性污泥是优秀的菌种资源库,有望通过其他手段进一步从中筛选出更多优良的降解菌种。

