AMF接菌量对米槁幼苗抗旱性的影响
刘 欢,刘济明,管睿婷,梁格林,唐子燕
(贵州大学 林学院,贵州大学森林生态研究中心,贵州 贵阳 550025)
米槁(CinnamomummigaoH.W.Li)系樟科(Lauraceae)樟属的一种高大常绿乔木,成年株高可达25 m,是中国西南地区特有的药用植物,仅分布于云南、贵州、广西三省交界的玉江、盘江、红水河形成的干热河谷[1].米槁的果实是香料、食品、精油等的原料[2-3].然而,由于人们对米槁资源的不合理利用及其生境的不断恶化,使其已处于野生资源分布稀缺的状态[4].要解决野生中药材濒危问题,需要发展人工种植.但西南地区土层浅薄、土壤的高渗透性使水分流失加快,干旱胁迫成为限制该地区植物生长与分布的主要因素之一[5],因此,研究如何提高米槁幼苗的抗旱性对西南地区的人工栽培具有重要意义.
以往研究表明,丛枝菌根真菌(Arbuscular mycorrhizal fungi,简称AMF)能在土壤干旱条件下改善植物水分状况,提高植物水分利用效率,减少根系水分丧失[6-7].菌根真菌与植物共生后通过提高宿主植物活性氧清除系统酶活性、渗透调节物质含量和磷元素吸收能力等间接地提高宿主植物的水分吸收能力,延迟干旱胁迫的致死时间[8].许平辉等[9]研究发现接种AMF可以提高水分胁迫下茶树的渗透调节能力和抗氧化能力,有效清除活性氧,缓解干旱胁迫对茶树的伤害,这一结论与贺学礼等对民勤绢蒿[10]和紫穗槐[11]的研究一致.
前人对米槁的抗旱性能研究多集中于其在自然干旱胁迫下的生长特性,还未有人对米槁的菌根化苗抗旱性进行过研究.因此,在该研究中,作者选择了能在香樟根部定殖的层状球囊霉(Glomuslamellosum,简称Gl)和幼套球囊霉(Glomusetunicatum,简称Ge)作为AMF接种菌剂,设置不同接菌量对米槁幼苗进行接种,旨在探讨AMF是否能提高米槁幼苗的抗旱性,为西南地区的造林技术研发提供理论支撑.
1 材料和方法
1.1 材 料
1.1.1 米槁的无菌苗
选取健康、成熟饱满、大小均匀的米槁种子,于贵州大学林学院生态学实验室内育苗.试验前,经200 mg·L-1的GA3溶液催芽处理48 h后用5% NaClO搅拌消毒10 min,无菌水冲洗4次后用灭菌河沙埋藏,置于25 ℃恒温气候箱萌发培育.出苗20 d后移至口径为24 cm×19 cm的灭菌花盆中培养.
1.1.2 丛枝菌根真菌
AMF层状球囊霉(Glomuslamellosum)和幼套球囊霉(Glomusetunicatum)由贵州大学森林生态研究中心和森林培育实验室提供.通过白三叶草(TrifoliumrepensL.)种子(75% C2H5OH表面消毒10 min后无菌水洗净4次)进行为期128 d的扩繁培养,将剪碎的三叶草根系与培养基质混匀即得含有孢子、菌丝、菌根的AMF菌剂,每20 g土壤中约含有60个孢子.
1.1.3 栽培基质
栽培基质为森林土(过10目筛)、河沙(粒径0.7~1 mm)与珍珠岩(粒径2~4 mm)的混合物(体积比为5∶1∶1),pH为6.4,在0.14 Mpa、125 ℃下连续灭菌2 h.每盆含栽培基质3.5 kg.
1.2 试验设计
1.2.1 试验方案
米槁幼苗移栽到花盆里种植3个月后进行接菌处理.通过拌基质接菌方式,将菌种扩繁所得AMF菌剂对米槁幼苗进行接种,每个接种菌剂设置5个接菌量梯度:0(对照),20,40,60,100 g,每个处理设置4个重复,如表1所示.
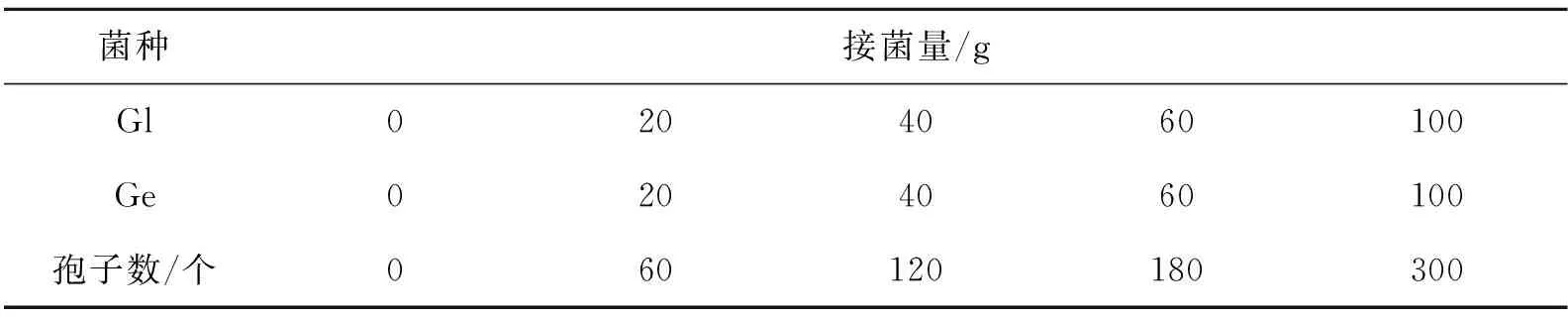
表1 AMF接种剂量梯度
接种AMF后,苗期管理期间不进行遮光处理.当水分蒸发强烈时,每天向每盆幼苗浇灌500 mL无菌蒸馏水.当水分蒸发较弱时,每3天浇灌1次500 mL的蒸馏水,直至接种120 d后菌根侵染成功.测定各处理组的菌根侵染率,随后对米槁幼苗进行为期15 d的自然干旱胁迫处理.
1.2.2 指标测定
每个处理随机选取4株米槁幼苗根样,每株选取0.2 g细根(直径小于1 mm),采用改进的酸性品红和台盼蓝染色法染色,然后参照Phillips等[12]的方法测定菌根侵染率,菌根依赖性的测定参照马放等[13]的方法.
干旱胁迫结束后,每个处理随机选取4株长势一致的健壮植物,对米槁幼苗叶片进行保护酶活性、渗透调节物质、相对含水量和丙二醛(MDA)含量的测定.超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、过氧化物酶(POD)活性分别采用氮蓝四唑(NBT)法、紫外吸收法和愈创木酚法测定[14],参照李琬婷、马蕾等[15-16]的方法测定可溶性糖、可溶性蛋白、脯氨酸(Pro)和丙二醛(MDA)含量,叶片相对含水量(RWC)采用烘干称重法测定[17],分别称取鲜重(fresh weight, 简称Wf)、饱和重(saturated weight, 简称Wt)和干重(dry weight, 简称Wd),RWC(%)=(Wf-Wd)/(Wt-Wd)×100.
参照王鑫、张爱玲等[18-19]的方法,利用各抗旱指标对不同接菌量处理下的米槁幼苗进行隶属函数平均值的计算,以便对其抗旱性进行评价.该平均值代表米槁的抗旱性,隶属函数均值越大抗旱性越强.具体计算方法如下:
1.3 数据处理
用Excel 2013和SPSS 22.0进行数据的统计分析,5%水平下LSD Duncan检验各处理平均值之间的差异显著性.采用单因素重测方差分析法进行差异显著性分析.
2 结果与分析
2.1 菌根侵染
接种120 d后,层状球囊霉和幼套球囊霉不同接菌剂量处理下的米槁幼苗根际均检测出菌根真菌的存在(图1),无菌对照组米槁根系压片中未发现内生菌的侵染.通常,增加接菌剂量能够提高内生真菌的侵染率,但接菌剂量高于40 g时,两种AMF在米槁幼苗根系的侵染率随着接菌量的增加逐渐降低(表2).以40 g剂量接种层状球囊霉和幼套球囊霉时菌根的侵染率最高,与米槁的共生力最强,在一定程度上提高了米槁幼苗的抗旱性.
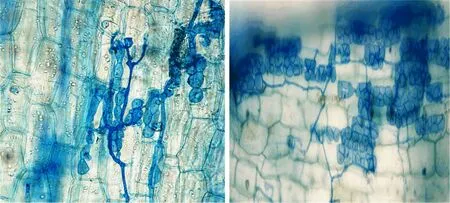
左图:层状球囊霉;右图:幼套球囊霉.
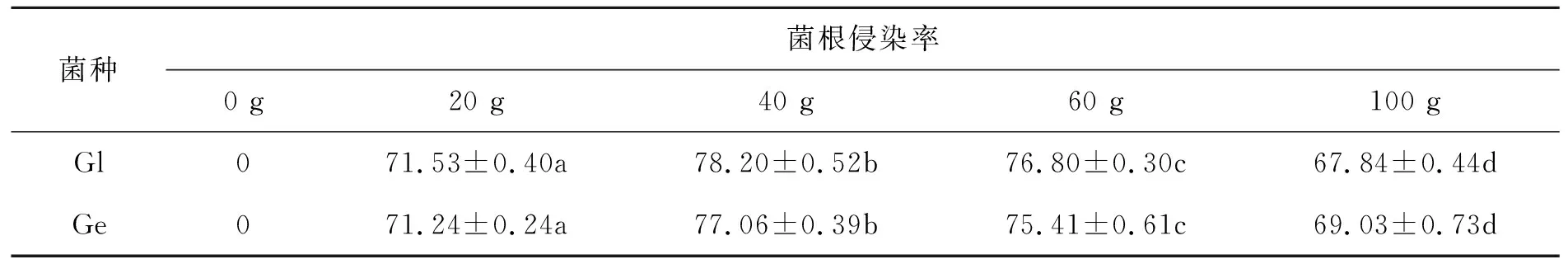
表2 AMF不同接菌量下的菌根侵染率 %
2.2 相对含水量的变化
接种不同剂量的AMF菌种后,干旱胁迫下的米槁幼苗叶片相对含水量都高于无菌对照组,如图2所示,在(73.77%±0.96%)~(89.51%±0.69%)之间波动,整体呈现出一个先上升后下降的规律.接种层状球囊霉时,低剂量(20 g)和高剂量(100 g)接菌组处理下的叶片相对含水量低于其他接菌组,且两个处理间无显著性差异;接种幼套球囊霉时,40 g接菌组的叶片相对含水量最高,随着接菌剂量的增加,米槁幼苗叶片相对含水量随之降低,60 g与100 g接菌量接种的米槁幼苗叶片相对含水量无显著性差异.
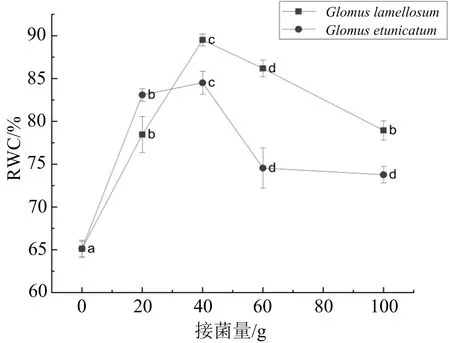
曲线上不同字母代表同一菌种的不同接菌量处理组之间具有差异显著性(p<0.05).
2.3 叶片保护酶活性的变化
2.3.1 SOD活性
接种AMF并持续干旱胁迫15 d后,不同接菌量处理下米槁幼苗叶片SOD活性均显著高于无菌对照组(p<0.05),在(153.89±1.05)~(198.06±1.36)U·g-1之间波动,如图3(a)所示.以20 g接菌量接种层状球囊霉的米槁幼苗叶片SOD活性最高,60 g接菌量与20g接菌量处理间差异不显著,40 g与100 g接菌量处理组的SOD活性则显著低于20 g接菌量处理组的;幼套球囊霉各接菌组叶片的SOD活性随着接菌剂量的增加逐渐下降.
2.3.2 CAT活性
米槁幼苗叶片的CAT活性受AMF接菌剂量的影响,在(54.24±3.08)~(277.98±8.58)U·g-1之间浮动,如图3(b)所示.以40 g剂量接种层状球囊霉的米槁幼苗叶片CAT活性显著高于其他接菌组,比对照组高了205.66 U·g-1,而用100 g的剂量接种层状球囊霉时,接种组的叶片CAT活性显著低于对照组;幼套球囊霉60 g剂量接菌组接种的米槁幼苗CAT活性显著高于其他剂量接菌组.总体来说,与无菌对照组相比,接种不同AMF菌剂后米槁幼苗的CAT活性有了显著性增高,随着接菌量的增加,CAT的活性又随之下降.
2.3.3 POD活性
干旱胁迫15 d后,AMF两个菌种不同接菌剂量处理下米槁幼苗叶片POD活性发生了显著的变化,总体上高于对照组,如图3(c)所示.接种Gl时,60 g接菌量处理下叶片的POD活性最高,100 g接菌量处理下的POD活性最低;以40 g剂量接种幼套球囊霉的米槁幼苗POD活性最高.总体而言,高接菌量处理的米槁幼苗POD活性不高,对米槁的抗旱性促进作用较弱甚至起到抑制作用.

图中不同字母代表同一菌种的不同接菌量处理组之间具有差异显著性(p<0.05).
2.4 渗透调节物质的响应
2.4.1 可溶性糖含量变化
如图4(a)所示,持续干旱胁迫15 d后,与对照组相比,AMF两种真菌不同剂量接种处理下可溶性糖(SS)含量有了不同程度的增加,以20 g剂量接种层状球囊霉的米槁幼苗可溶性糖含量最低,可溶性糖含量随接菌剂量的增加而增加,但各剂量接菌组间无显著性差异;接种不同剂量的幼套球囊霉时,40 g接种组的可溶性糖含量最高,20 g低剂量和100 g高剂量接种组的可溶性糖含量较低.
2.4.2 可溶性蛋白含量变化
不同剂量接种处理下的米槁幼苗叶片可溶性蛋白(SP)含量在(8.91±0.21)~(12.83±0.41)mg·g-1之间波动,如图4(b)所示.接种层状球囊霉和幼套球囊时,随着接菌剂量的增加米槁幼苗的SP含量逐渐增加,60 g剂量接种的米槁幼苗SP含量显著高于其他接菌组;层状球囊霉100 g高剂量接种下的米槁幼苗SP含量最低,幼套球囊霉20 g低剂量接菌处理下的SP含量与对照组的差异性不显著.由此可见接菌剂量过高或者过低都不利于提高米槁的抗旱性.
2.4.3 游离脯氨酸含量变化
接种AMF后的米槁幼苗游离脯氨酸(Pro)含量显著高于无菌对照组,如图4(c)所示.接种层状球囊霉和幼套球囊霉的叶片游离Pro变化趋势一致,Pro含量随接菌量的增加而上升,高于60 g则开始下降,以60 g剂量接种AMF时,米槁幼苗的Pro含量显著高于其他剂量接菌组.接菌量低于40 g时,接种层状球囊霉的叶片Pro含量高于接种幼套球囊霉的叶片,接菌量高于40 g时则反之.
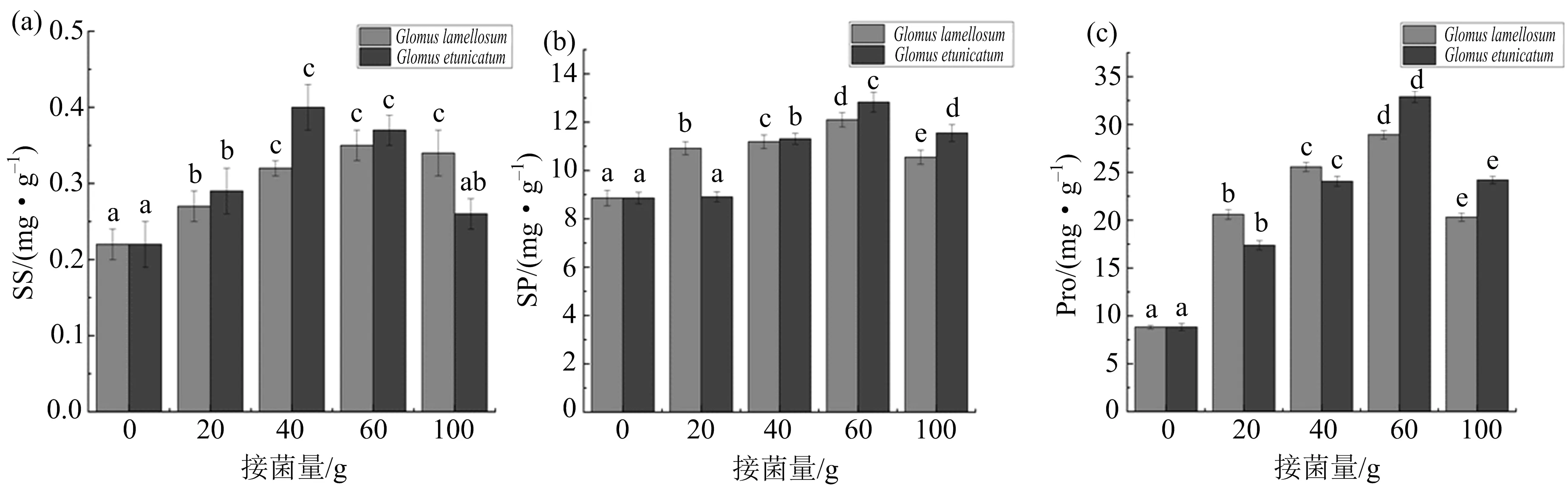
图中不同字母代表同一菌种的不同接菌量处理组之间具有差异显著性(p<0.05).
2.4.4 MDA含量变化
干旱胁迫15 d后,AMF两个菌种不同剂量接种处理下米槁幼苗叶片丙二醛(MDA)的含量在(25.95±0.73)~(46.16±1.19)nmol·g-1之间波动,并且明显低于无菌对照组(70.54 nmol/g),如图5所示.以不同接菌剂量接种Gl,Ge时,40 g接菌组的MDA含量最低,MDA含量最高的为100 g接种组.
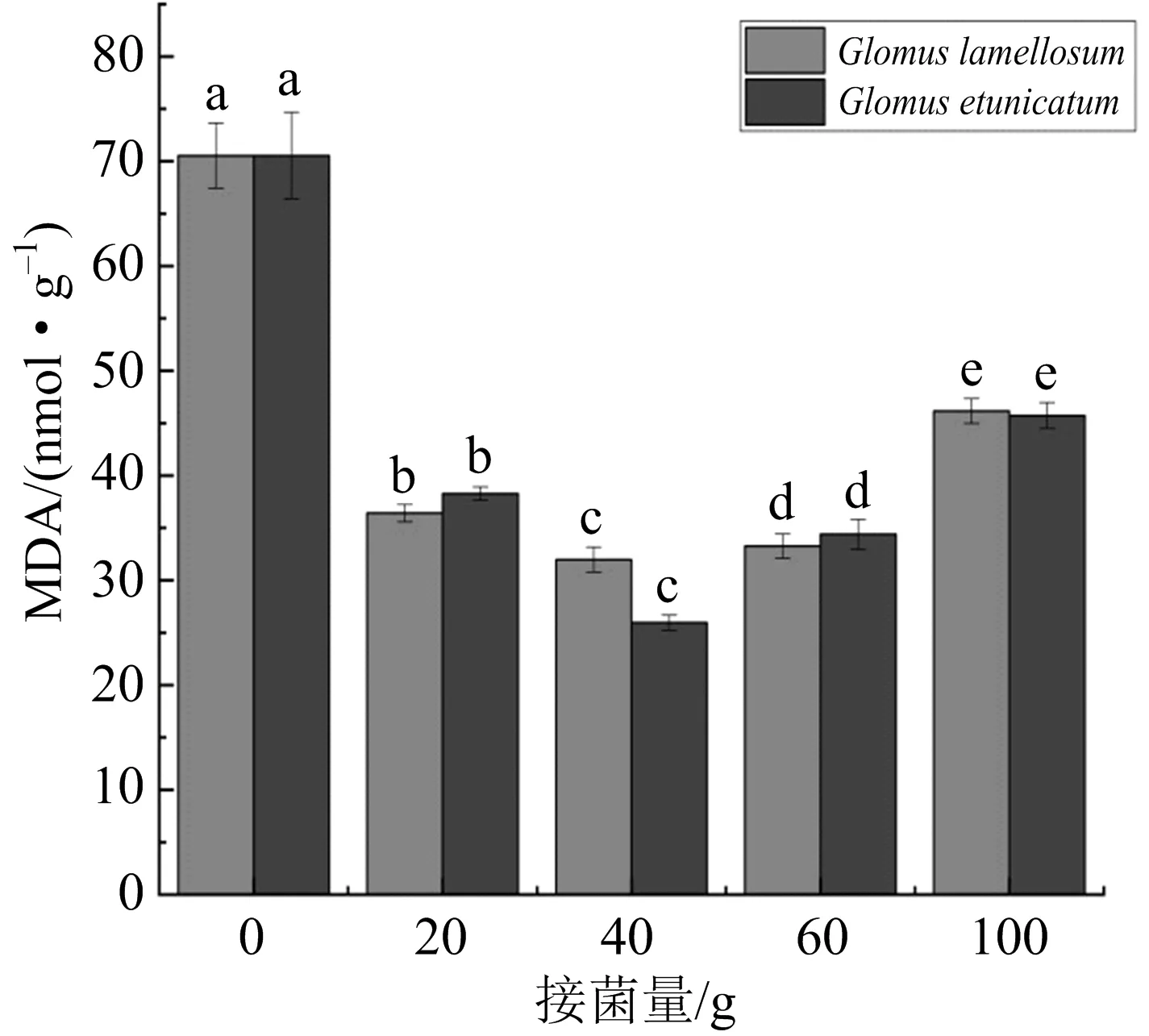
图中不同字母代表同一菌种的不同接菌量处理组之间具有差异显著性(p<0.05).
2.5 抗旱性综合评价
通过盆栽接种试验,研究了AMF不同接菌剂量下米槁叶片相对含水量、可溶性糖、游离脯氨酸等指标的差异.使用隶属函数法比较了AMF不同接菌剂量下米槁抗旱性的强弱,由表3可知,各接菌量下米槁抗旱性强弱由大到小依次为:40 g Gl>40 g Ge>60 g Ge>60 g Gl>20 g Ge>100 g Ge>20 g Gl>100 g Gl.
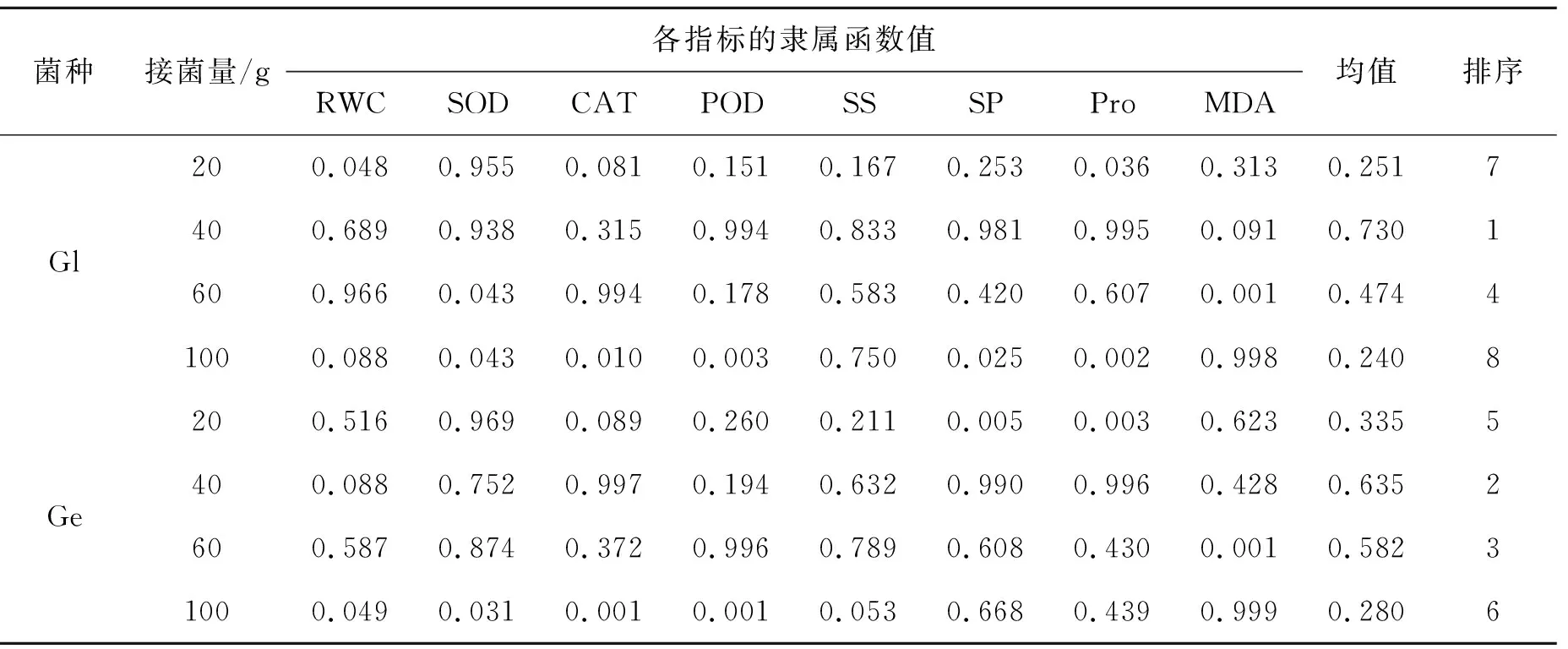
表3 抗旱性相关生理指标的隶属函数值及排序
3 讨论与结论
植物在干旱环境中用于保存水分的机制是其耐受干旱能力的关键.根外菌丝可扩大植株根系吸收范围, 促进植株对水分及土壤矿质元素的吸收和利用[11,20].该研究中,接种层状球囊霉和幼套球囊霉的米槁幼苗叶片相对含水量高于未接菌对照组,当接菌量为 40 g时,米槁幼苗的相对含水量最高.说明层状球囊霉和幼套球囊霉提高了干旱环境中米槁对土壤水分的利用率,增强了其抗旱性.
当植物遭遇长期干旱胁迫时,其代谢过程中产生活性氧的途径与活性氧清除系统失衡,导致活性氧数量增多,严重损坏细胞膜系统从而破坏植物的防御机制[21].然而,接种AMF有助于缓解过氧化对植物细胞造成的损害.笔者的研究结果表明,在干旱胁迫下,接种层状球囊霉和幼套球囊霉的米槁幼苗的SOD 和 POD活性增加,MDA积累减少,但以100 g高剂量接种AMF的两个菌种时米槁幼苗的CAT活性低于未接菌对照组,说明AMF高剂量接种对提高米槁幼苗抗旱性的促进作用较弱,这与以往得出的研究结果相似[22-24].此外,接种AMF还可以提高渗透调节的水平,减缓干旱胁迫对植物的伤害.在该研究中,接菌促进了米槁幼苗可溶性糖、游离脯氨酸和可溶性蛋白的合成,接菌后的米槁幼苗渗透调节物质高于未接菌对照组,这与贺学礼等[10]对菌根化民勤绢蒿的研究结果一致.
接菌剂量能调控植物的抗旱性早已被证实[25].在笔者的研究中,接菌量对米槁耐旱性最直接的影响是AMF在米槁幼苗根部的定殖率(表2).接种量的增加会提高层状球囊霉和幼套球囊霉的定殖率.由抗旱性综合评价可知,当层状球囊霉和幼套球囊霉以40 g剂量接种时,观察到最强的抗旱性(表3).然而,60 g 和100 g的层状球囊霉和幼套球囊霉的接种量对米槁幼苗抗旱生理指标的提升显著低于其他接菌组,即接种孢子的密度较高可能会降低或抑制植物抵御干旱的性能[26].这些发现对处于西南喀斯特地区干旱生长环境的早期幼苗具有重要意义[27].
以往相关研究对丛枝菌根真菌的接种量没有统一的定论,有的用接种势来表示,有的用单位面积孢子密度和菌剂质量来表示的,也有研究用单位体积孢子密度来表示[28-30],但是在实际规模化生产应用中,所用AMF菌种经富集培养,菌剂除含有孢子外还包含菌丝、泡囊、菌根段等多种繁殖体,而且孢子定量工作费时费力甚至难以准确测定菌剂孢子密度,给造林工作带来不便.因此,笔者选择传统的孢子含量作为接种质量的评价指标,在该研究中,40 g接菌量对提高层状球囊霉和幼套球囊霉的定殖率、米槁的抗旱性效果最佳.

