131I标记的NaGdF4:Eu3+纳米颗粒用于自发光/SPECT/MR三模态成像
2
(1.浙江工业大学 材料科学与工程学院,浙江 杭州 310014;2.中国药科大学,药物质量与安全预警教育部重点实验室,江苏 南京 211198;3.厦门大学附属中山医院,福建 厦门 361005)
稀土下转换纳米颗粒(DCNPs)在光学成像方面有许多优异的特性,例如发射带宽窄、斯托克斯位移较大和光化学稳定性良好[1-4]。常见的DCNPs可掺杂Eu3+,Dy3+,Tb3+等稀土离子,能在紫外光(UV)的激发下,通过斯托克斯位移发射出可见光[4],进而通过荧光显微镜进行体外光学成像[5-9]。然而,UV不但会损伤细胞,而且激发产生的生物体自发荧光会与发光信号混淆。因此,直接使用UV作为DCNPs的激发光在生物体内光学成像具有一定的局限性[4]。
切伦科夫辐射(CR)是一种在放射性核素衰变过程中发出的电磁辐射,发射的光谱主要位于UV或蓝光区域[10]。当辐射体与DCNPs以适当的方式连接时,辐射体发射的UV或蓝光能通过切伦科夫能量共振转移(CRET)激发DCNPs发光。作为一种内置“光源”,CR可直接激发DCNPs进行自发光,从而克服外部光源的不足[11-13]。这种基于CR的纳米颗粒自发光已经用于对量子点[14-15]、金纳米簇[16]、长余辉纳米颗粒[17-18]和有机纳米颗粒[19-20]等激发光谱在200~500 nm处的纳米颗粒激发。目前,可产生切伦科夫辐射的放射性核素有18F,131I,90Y,64Cu,89Zr等[21]。其中,131I的半衰期为8.02 d,适用于精准的医学成像。此外,131I在β衰变过程中可以发射少量γ射线,在与DCNPs连接后不但能用于自发光成像,还可以用于单光子发射计算机断层扫描(SPECT)成像,通过两种成像模式的相互印证提高诊断的灵敏度和准确性[22]。为此,开发了一种以131I标记的NaGdF4:Eu3+纳米颗粒(131I-GENPs)用于多模态成像。131I不但可用作CR“光源”激发NaGdF4:Eu3+(GENPs)纳米颗粒发出荧光信号,而且能产生γ射线用于SPECT成像。131I-GENPs中的Gd3+是一种临床上常用的T1加权磁共振成像(T1-MR成像)造影剂,可用于增强T1-MR成像的对比度和灵敏性。因此,131I-GENPs可用于自发光、SPECT和MR三模态成像。
1 材料和方法
1.1 材 料
六水合氯化钆(GdCl3·6H2O)、六水合氯化铕(EuCl3·6H2O)、油酸、1-十八烯、氟化铵、氢氧化钠和羟苯基丙酸-N-羟基琥珀酰亚胺酯(SHPP),阿拉丁有限公司;二硬脂酰基磷脂酰乙醇胺-聚乙二醇-氨基(DSPE-PEG2000-NH2),上海拓旸生物科技有限公司;Na131I和Na99mTcO4从厦门大学附属中山医院获得。
1.2 材料表征
透射电子显微镜(TEM)和X射线能谱分析(EDS)通过FEI Tecnai F20 TEM在200 kV下测量。材料的晶相通过配备有CuKα(λ=1.540 5 Å)辐射(Ultima IV)的X射线粉末衍射仪(XRD)确认。用荧光分光光度计(Hitachi F-7000)测量材料的荧光激发和发射光谱。
1.3 GENPs的制备
GENPs的合成方法基于文献[23]稍作修改。将0.95 mmol GdCl3·6H2O,0.05 mmol EuCl3·6H2O,8 mL油酸和15 mL 1-十八烯添加到100 mL的四口烧瓶中。将混合溶液在磁力搅拌下加热至160 ℃并保温1 h,以形成稀土油酸络合物。冷却至室温后,滴入含有NH4F(2.64 mmol)和NaOH(4 mmol)的10 mL 甲醇溶液,再搅拌30 min。然后将溶液加热至110 ℃并保温15 min以除去甲醇,继续加热至300 ℃,保温1 h。用乙醇作为沉淀剂离心分离(8 000 r/min,5 min)纳米颗粒,将获得的颗粒分散在正己烷中备用。
1.4 SHPP修饰的GENPs的制备
将10 mg GENPs和30 mg DSPE-PEG2000-NH2溶于5 mL氯仿中,超声处理5 min,得到均匀溶液。将混合物密封后在通风橱中搅拌过夜,然后用氮气流除去氯仿。将获得的产物溶解在水中,加入5 mg SHPP后搅拌反应24 h。最后通过离心(3 000 r/min,3 min)除去未反应的SHPP,获得SHPP修饰的GENPs。
1.5 131I-GENPs的制备
使用标准的Iodogen碘化法[24]完成131I标记。将100 μL经SHPP修饰的GENPs(2 mg/mL)和100 μCi的Na131I添加到涂有Iodogen(20 μg)的2 mL 离心管中,混合10 min。通过离心(8 000 r/min,3 min)除去游离的Na131I。通过瞬时薄层色谱(ITLC)测试放射化学稳定性。
1.6 动物模型构建
选取6周龄的雌性BAlB/c鼠,体重约20 mg,在屏障环境中饲养。在老鼠右腿接种含4×106个4T1细胞的PBS溶液,等到肿瘤体积约80 mm3时进行活体实验。
1.7 自发光成像
体外的自发光成像在96孔板中测试。先将Na131I(100 μCi),131I-GENPs(100 μCi,0.2 mg GENPs)和SHPP修饰的GENPs(0.2 mg GENPs)分散在200 μL水中,再将其转移到黑色的96孔板中。利用GFP滤光片(515~575 nm),Dsred滤光片(575~650 nm),Cy5.5滤光片(695~770 nm),ICG滤光片(810~875 nm)和不加滤光片的IVIS Spectrum系统(Caliper life sciences)测量并记录荧光图像,曝光时间为2 min。在1.6节所述荷瘤小鼠上进行体内自发光成像。瘤内注射131I-GENPs(20 μCi,40 μg131I-GENPs)1 h后进行荧光成像,曝光时间为2 min。自发光成像使用1组老鼠,每组2只,以注射前后的信号作为对照。
1.8 SPECT成像
通过荷瘤小鼠评价SPECT成像效果。将131I-GENPs(20 μCi,40 μg131I-GENPs)以瘤内注射的方式注射到荷瘤小鼠中。注射1 h后,使用nanoScan SC系统(Medisomedical imaging system)进行SPECT成像。扫描时间为30 min,分辨率为0.4 mm。使用InVivoScope软件(Bioscan Inc.)分析SPECT图像。SPECT成像使用1组老鼠,每组2只,以注射前后的信号作为对照。
1.9 MR成像
在3.0 T的MR扫描仪(Achieva TX, Philips medical system, Netherlands)上进行体外MR成像测试。以0.03 mmol/L为Gd3+浓度梯度,将131I-GENP配制成0~0.3 mmol/L的水溶液。将不同Gd3+浓度的131I-GENPs水溶液置于排管中,使用快速自旋回波序列(Turbo spin echo,TSE)测定样品的T1弛豫时间,检测参数为TE=11.6 ms,TR=500 ms。利用T1弛豫时间的倒数与浓度进行线性拟合,计算出的斜率即为T1弛豫率(Relaxivity,R)。通过荷瘤小鼠评估体内MR成像。将131I-GENPs(20 μCi,40 μg131I-GENPs)以瘤内注射的方式注射到小鼠中,然后立即进行MR成像,1 h后再次进行MR成像。T1加权MRI的检测参数为Flip angle=10°,ETL=60,TR=7.8 ms,TE=7.3 ms,Field of view(FOV)=65×65 mm2,Slice thickness/gap=50 mm/0.5 mm,NEX=4。MR成像使用1组老鼠,每组2只,以注射前后以及注射后1 h的信号作为对照。
1.10 生物安全性评估
将PBS和131I-GENPs(20 μCi,40 μg)分别以瘤内注射的方式注射到上述荷瘤小鼠中。两天后主要器官(心、肝、脾、肺、肾)被分离出来,并浸泡在4%福尔马林溶液中固定,随后进行包埋、切片。通过倒置荧光显微镜观察比较苏木精-伊红(H&E)染色结果,评价131I-GENPs的生物安全性。该实验使用2组老鼠,每组1只老鼠,以PBS作为对照组。
2 结果与讨论
图1是制备的纳米颗粒的典型TEM图像,从图1中可以看出:合成的材料呈现单分散状态,颗粒的形貌为均匀的球形,其尺寸约为15 nm。利用Nano measure软件统计了颗粒的尺寸并使用高斯分布函数拟合数据,结果如图2所示,纳米颗粒的平均粒径为15.5 nm,且粒径分布较窄,为(15.5±3) nm,说明颗粒非常均匀。

图1 分散于正己烷的纳米颗粒的TEM图Fig.1 TEM image of nanoparticles dispersed in hexane
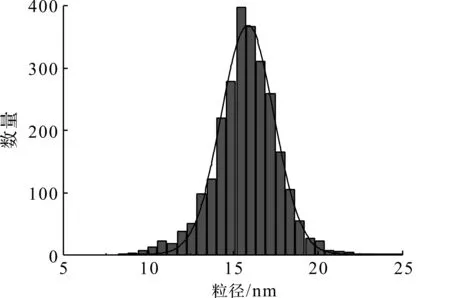
图2 纳米颗粒大小分布统计图Fig.2 Statistical graph of nanoparticle size distribution
图3是合成的材料在10°~80°处的X射线衍射(XRD)图谱,结果显示:合成材料在2θ为17.01°,30.17°,42.84°,52.97° 时出现明显的衍射峰,对应的晶面分别为(100),(101),(201)和(102),与NaGdF4的标准六方相(JCPDS 27-0699)结果基本一致,说明形成了以NaGdF4为主相的纳米材料。其中30.17°,42.84°,52.97° 处的衍射峰与标准卡片对比有0.5°~1° 的右移,可以推测与Eu3+的掺杂有关。在六方晶系NaGdaF4中,存在3种不同的晶体学格位,分别为被Gd3+占据的单一点阵(1a),被Na+和Gd3+随机占据的单一点阵(1f),以及被Na+占据的双点阵(2h)。Eu3+的离子半径为0.095 nm,Gd3+的离子半径为0.094 nm,故Eu3+会占据1a和1f点阵位,由于Eu3+的掺杂,晶格发生一定的改变,导致衍射峰位置发生偏移[25]。图4是GENPs的EDS映射图,其中左上方、右上方、左下方和右下方分别为Gd,Eu,Na,F元素的信号,分别显示了这4种元素在颗粒上的面分布情况,4种元素完全重叠,说明成功合成GENPs,并且这4种元素在颗粒上均匀分布,说明Eu3+被均匀掺进了纳米颗粒中。
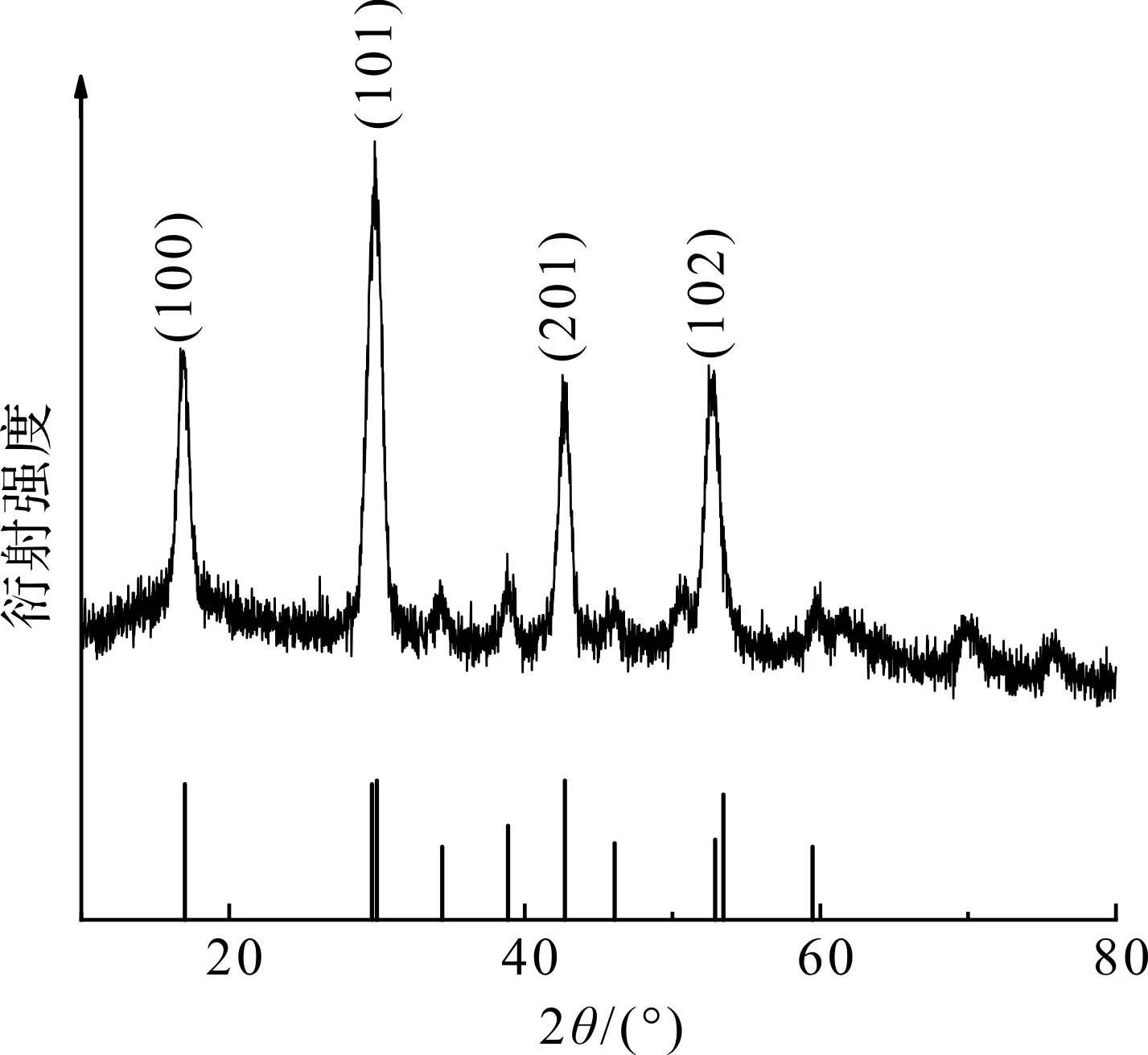
图3 纳米颗粒的X射线衍射图谱Fig.3 XRD pattern of nanoparticles
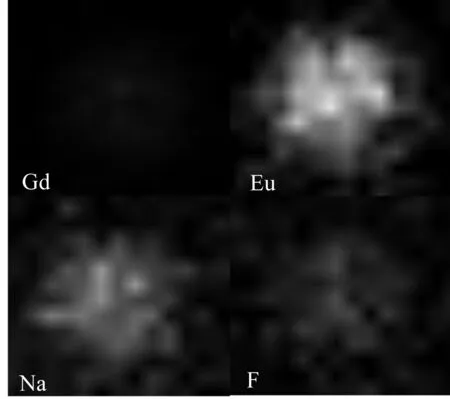
图4 GENPs的EDS映射图Fig.4 EDS mapping of GENPs
因为GENPs是一种典型的稀土下转换纳米颗粒,所以通过测试其荧光激发光谱和发射光谱验证其发光性能。图5是GENPs的荧光激发光谱图,可以看出:该颗粒在277,315,395 nm附近出现了明显的激发峰,说明这3个波段均可作为GENPs的激发波长,且最高峰在395 nm处。进而以277,395 nm两个波长的光作为激发光,分别测试GENPs的发射光谱。如图6所示,在这两个波长的光的激发下,GENPs均出现了明显的荧光发射峰。其中,592,615,695 nm处出现的发射峰是由于Eu3+离子的5D0→7F1,5D0→7F2,5D0→7F4能级跃迁引起的[26]。此外,395 nm光激发比277 nm光激发引起的荧光更强,这与395 nm为GENPs最大激发波长的结果相一致。采用标准的Iodogen碘化法[21]将131I连接在GENPs上。由于该过程需在水溶液中完成,而制备的GENPs呈现明显的疏水性,所以需要对GENPs进行修饰[27]。首选使用DSPE-PEG2000-NH2对GENPs进行表面修饰。其中,DSPE端能通过疏水-疏水相互作用包覆在GENPs表面,而亲水的PEG链与溶液接触,带动整个纳米颗粒溶于水,GENPs在水溶液中具有良好的分散性能。Iodogen碘化法还需要修饰SHPP用于连接131I。因此,在修饰DSPE-PEG2000-NH2的基础上,进一步在其表面修饰SHPP。
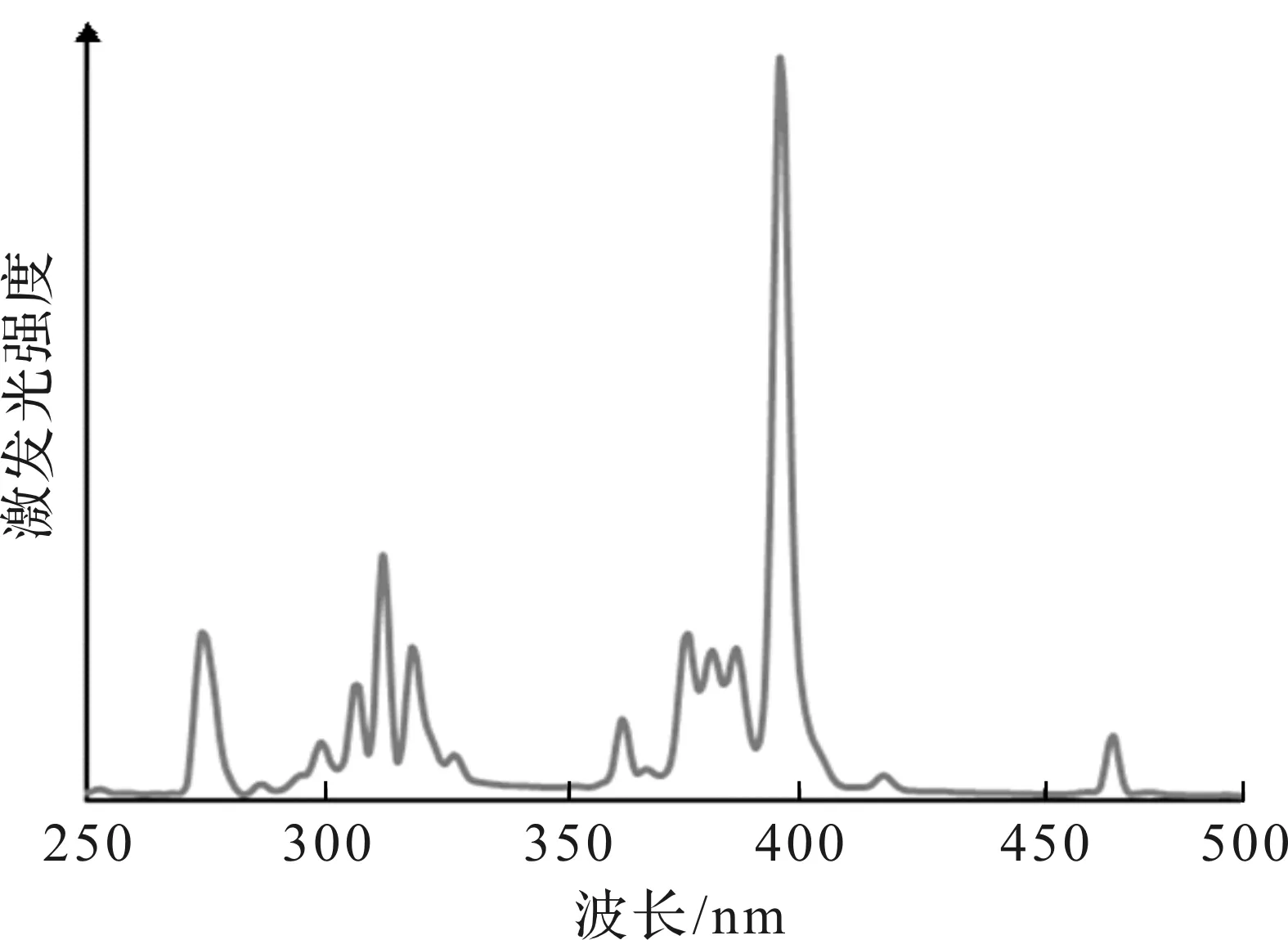
图5 用615 nm滤光片测得的GENPs的激发光谱Fig.5 Excitation spectrum of GENPs with a 615 nm filter

图6 277,395 nm波长光激发后GENPs的发射光谱Fig.6 Emission spectra of GENPs upon excitation at 277,395 nm
修饰PEG和SHPP后GENPs的TEM图如图7(a)所示,可以发现:修饰后纳米颗粒的形貌和尺寸均没有发生明显的变化,并且能在水溶液中分散良好。进而采用Iodogen碘化法对GENPs进行131I标记,其TEM图如图7(b)所示,标记后颗粒仍保持原有形貌,尺寸分布也和在正己烷中分散的类似。如图8所示,水相中纳米颗粒的平均粒径约为15 nm,且分布较窄,能在水中实现分散,没有明显团聚。良好的放射稳定性是实现材料CRET和SPECT成像的前提,因此用瞬时薄层色谱(ITLC)评估131I-GENPs的放射稳定性。如图9所示,在37 ℃条件下,经过12,24 h生理盐水的孵育,131I-GENPs分别保持了98%和95%的放射化学纯度,而在37 ℃条件下,在含有10%血清的培养基(10% FBS)中孵育12,24 h后,131I-GENPs的放射性纯度保持了98%和96%,说明131I能被稳定地标记到GENPs上,且在生理盐水和血清条件下均不易分离,为将131I-GENPs用于自发光成像和SPECT成像奠定了基础。
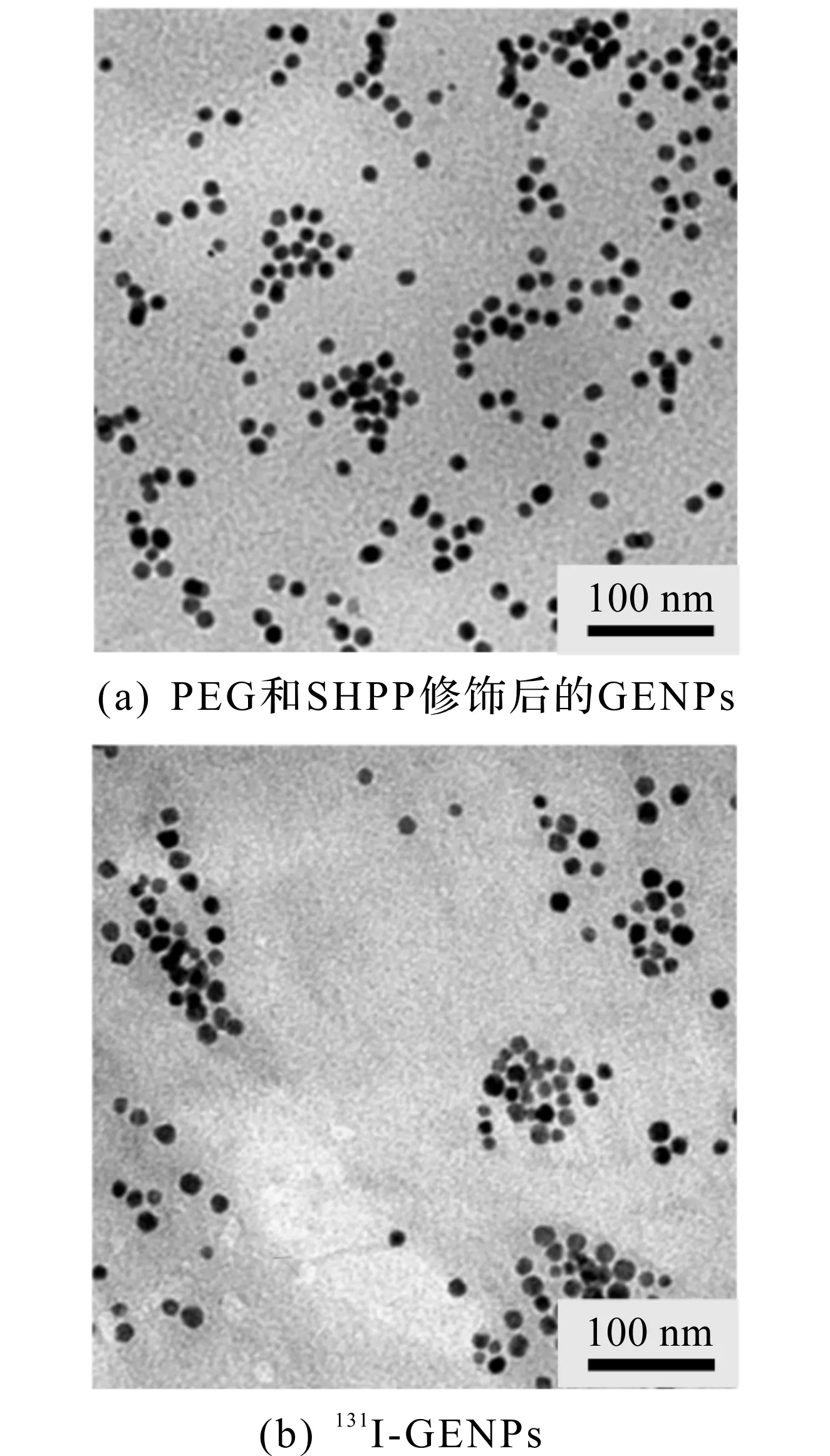
图7 TEM图像Fig.7 TEM images
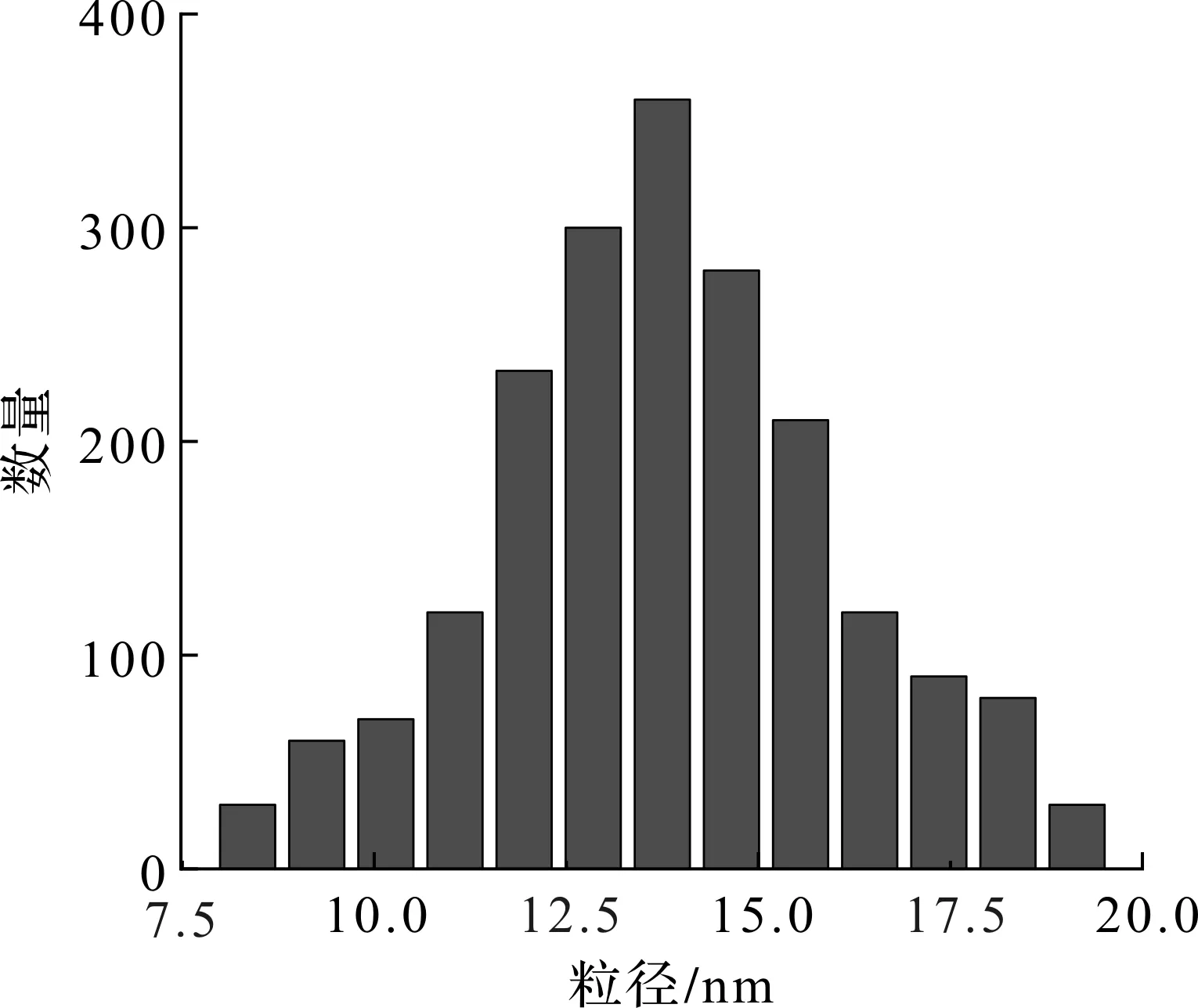
图8 131I-GENPs的大小分布统计图Fig.8 Statistical graph of 131I-GENPs size distribution
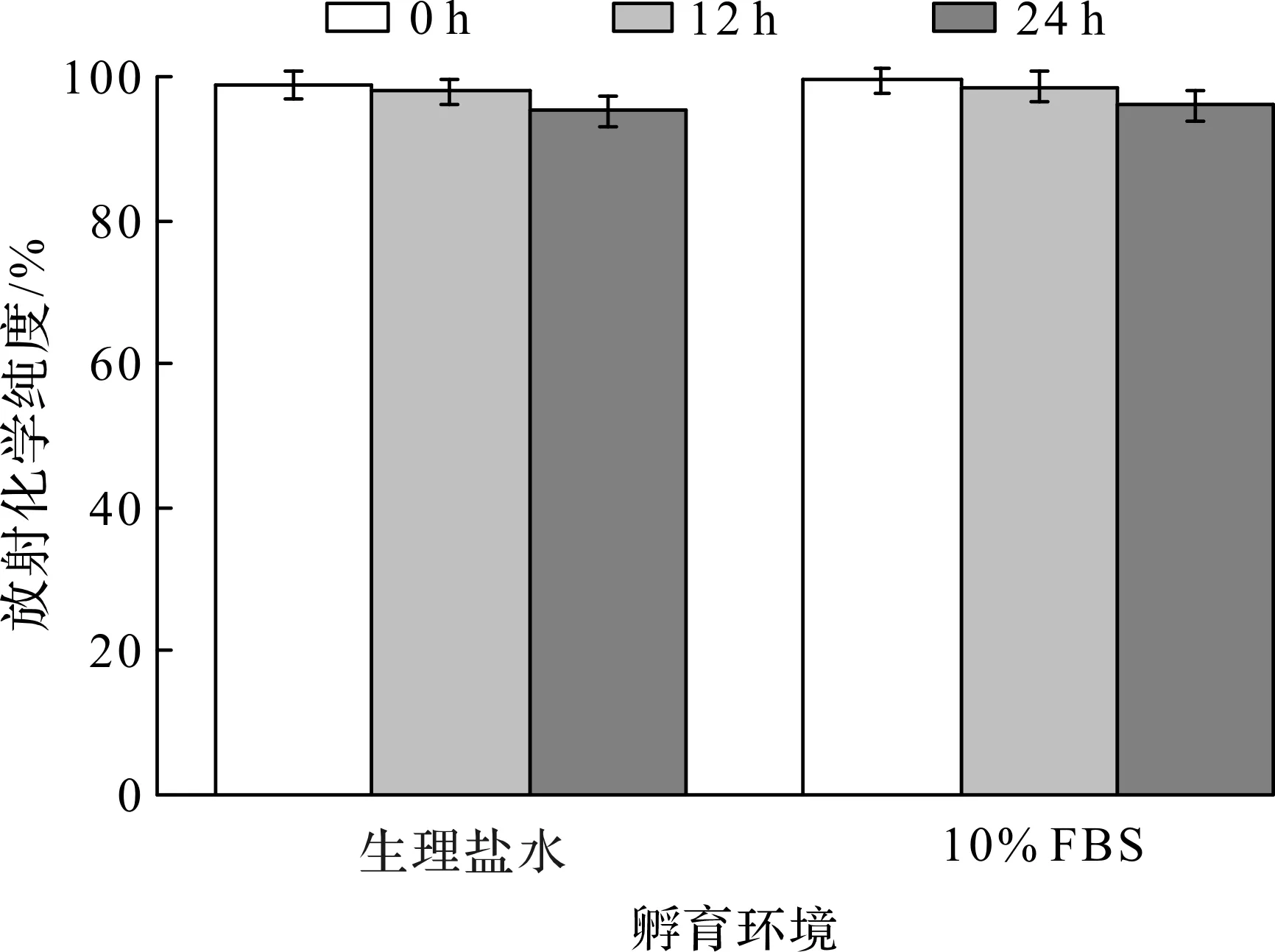
图9 131I-GENPs的放射稳定性Fig.9 Radiolabeling stability of 131I-GENPs
131I-GENPs不仅具有良好的放射稳定性,还具备优秀的荧光成像潜力,将131I-GENPs的水溶液置于IVIS Lumina型荧光成像系统中用于体外CRET荧光成像。在关闭激发光源的条件下,拍摄了荧光照片,结果如图10所示。不同样品的光子通量见图11,由图11可知:131I-GENPs产生的光子数为18.42×105p/(sec·cm2·s),高于Na131I产生的光子数11.18×105p/(sec·cm2·s),说明131I可以成功激发GENPs自发荧光。由于131I衰变时可以同时生成β和γ两种射线,为了研究何种射线是激发GENPs产生荧光的激发源,测试了γ射线发射体Na99mTcO4对GENPs的激发作用。结果显示:单独的Na99mTcO4不产生荧光信号,与GENPs混合后也没有明显的荧光信号,其产生的光子数分别为0.23×105,0.31×105p/(sec·cm2·s),说明γ射线不会产生荧光,也不能激发GENPs产生自发荧光,进而说明β射线才是激活GENPs产生荧光信号的关键。

图10 Na131I,131I-GENPs,Na99mTcO4和Na99mTcO4+GENPs的荧光图像 Fig.10 Fluorescence images of Na131I, 131I-GENPs, Na99mTcO4 and Na99mTcO4+GENPs
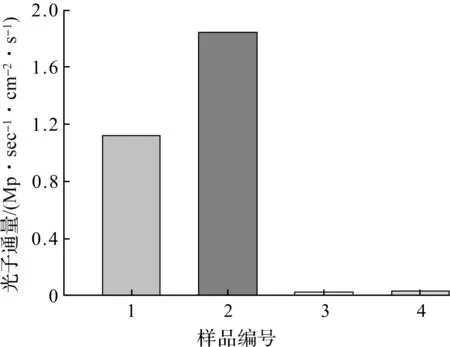
1—Na131I;2—131I-GENPs;3—Na99mTcO4;4—Na99mTcO4+GENPs。图11 Na131I,131I-GENPs,Na99mTcO4和Na99mTcO4+GENPs的光子通量 Fig.11 Photon flux of Na131I, 131I-GENPs, Na99mTcO4, and Na99mTcO4+GENPs
为了考察131I激发GENPs产生荧光的原因,利用不同波长的滤光片考察了释放荧光的波段。Na131I(100 μCi)、131I-GENPs(100 μCi,0.2 mg)和GENPs(0.2 mg)在GFP滤光片(515~575 nm)、Dsred滤光片(575~650 nm)、Cy5.5滤光片(695~770 nm)和ICG滤光片(810~875 nm)下的的荧光图像和SPECT图像如图12所示。游离Na131I由于自身CR效应产生的荧光主要集中在GFP(515~575 nm)和Dsred(575~650 nm)波段。将131I标记至GENPs后,两个波段的光均有所增强,且Dsred波段的信号增加更为明显,是游离Na131I的2.6倍(图13),这与GENPs的发射峰位置吻合较好,说明GENPs成功地将131I以短波为主的切伦科夫辐射转化成了以近红外光为主的CRET荧光,验证了其作为近红外自激发的CRET荧光探针的可行性。此外,单独的GENPs在4个滤光片下均未检测到明显的荧光信号,说明GENPs自身并不会发光。综上所述,131I-GENPs可通过131I与GENPs之间的CRET作用实现自发光。此外,由于131I还可发射γ射线,Na131I和131I-GENPs都表现出明显的SPECT信号,说明131I-GENPs可用于自发光和SPECT双模态成像。
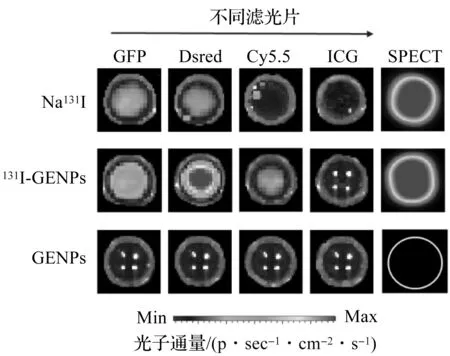
图12 荧光图像和SPECT图像Fig.12 Fluorescence images and SPECT images
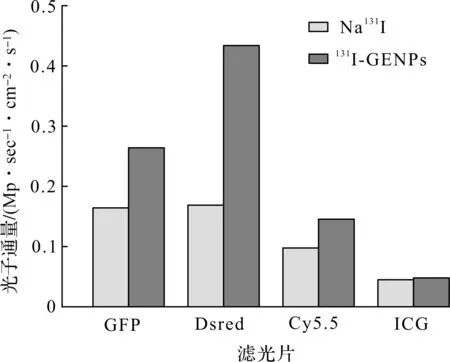
图13 Na131I和131I-GENPs在不同滤光片中的光子通量Fig.13 Photon flux of Na131I and 131I-GENPs in different emission filters
由于合成的131I-GENP具有优良的光学性质和放射性,所以具有潜在的生物医学应用空间。为此,进一步在荷瘤小鼠上检测其自发光成像和SPECT成像的效果。将131I-GENPs(20 μCi,40 μg)以瘤内注射的方式注入小鼠体内,1 h后获取肿瘤部位的荧光信号和SPECT信号。结果如图14(a)所示,注射1 h后肿瘤部位呈现明显的SPCET信号。Dsred波段是131I-GENPs荧光信号最强的波段,在荧光成像中,分别测试了全波长滤光片和Dsred滤光片滤光后的荧光信号。如图14(b)所示,两者均呈现出较强的荧光信号,且Dsred滤光片中的光子通量占总光子通量的25%(图15)。由于Dsred波段(575~650 nm)属于红、橙、黄光波段,其对皮肤的穿透深度较131I自身CR作用产生的蓝绿荧光(515~575 nm)更深,更适用于体内成像。
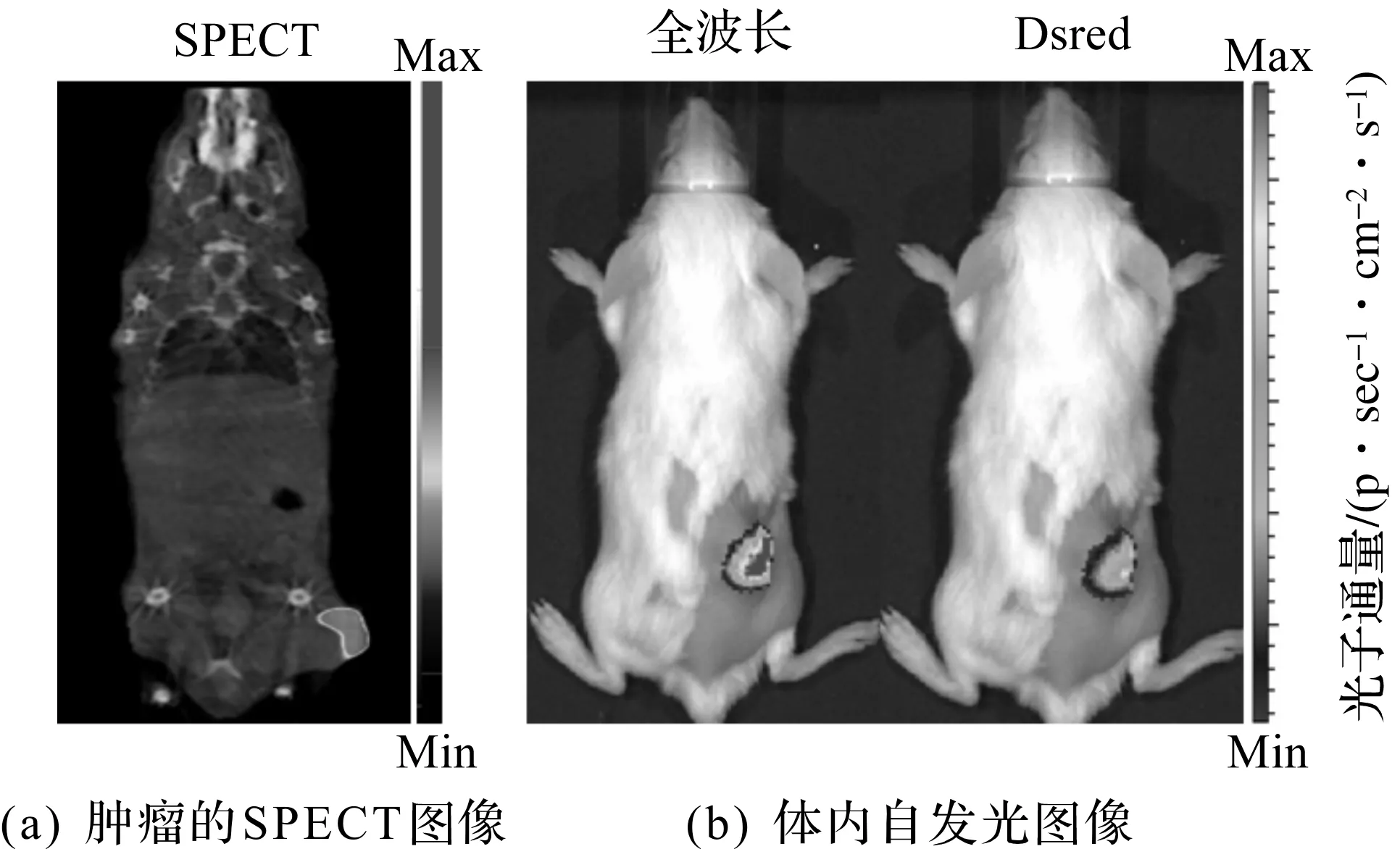
图14 SPECT图像以及体内自发光图像Fig.14 SPECT images and in vivo self-illuminating images
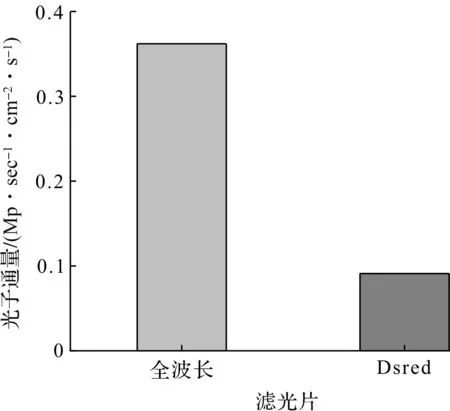
图15 肿瘤区域中的光子通量Fig.15 Photon flux in tumor region
含有Gd3+的配合物,如Gd-DTPA,Gd-DOPA等都是临床上广泛应用的T1-MR成像造影剂,可用于增强T1-MR成像灵敏度和准确性。笔者构建的131I-GENPs也含有Gd3+,因此有望用于MR成像。T1弛豫率(R1)是表征T1-MR成像造影剂成像性能的关键参数,为此测试了不同Gd3+浓度131I-GENPs的T1-MR成像效果并计算其R1,结果如图16,17所示。这种纳米材料在Gd3+浓度为0~0.3 mmol/L时呈现出明显的T1-MR成像信号增强,其R1可高达4.85 mmol/(L·s),优于临床应用的Gd-DTPA[28],是一种性能优异的T1-MR成像造影剂。进而将这些131I-GENPs以瘤内注射的方式注入荷瘤小鼠中,比较注射前后以及注射1 h后肿瘤区域的T1-MR成像信号强度,结果如图18,19所示。在注射后,小鼠的肿瘤区域在T1-MR成像模式下立刻呈现明显的亮信号,其信号强度较注射前提高约41%,而在注射131I-GENPs 1 h后,肿瘤部位的T1-MR成像信号强度较注射前高21%,与已报道的Gd3+基T1-MR成像造影剂的半衰期[29]类似,为其MR成像提供了依据。

图16 不同Gd3+浓度131I-GENPs的MR图像Fig.16 MR images of different concentrations of 131I-GENPs
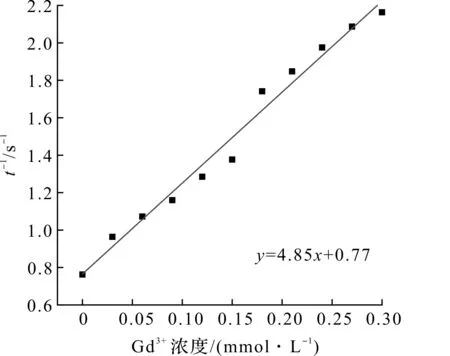
图17 T1弛豫时间的倒数与Gd3+浓度之间的线性关系拟合结果Fig.17 Linear relationship between the reciprocal of T1 relaxation time and Gd3+concentration
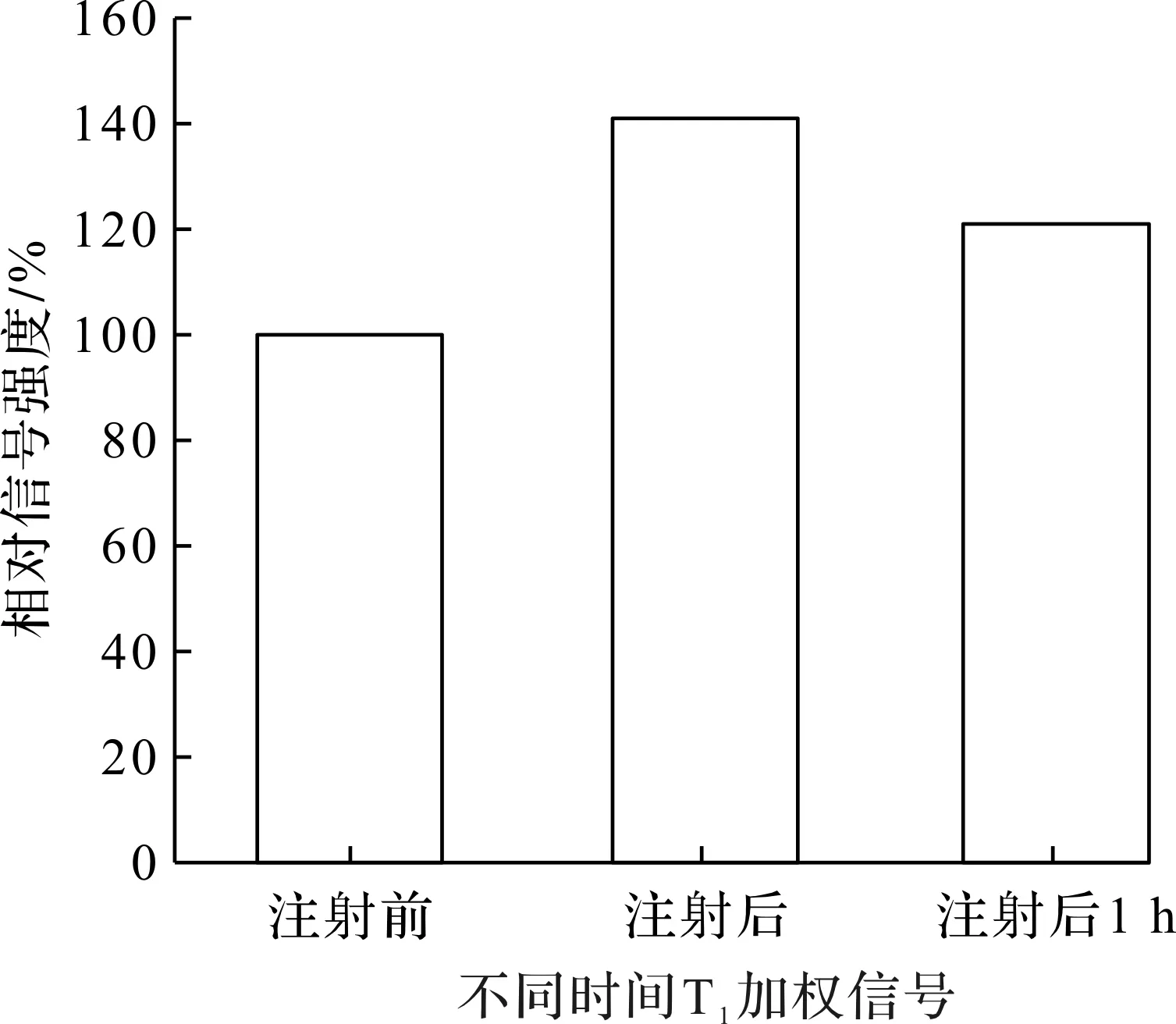
图18 T1加权信号强度变化Fig.18 Intensity changes of T1-weighted signal
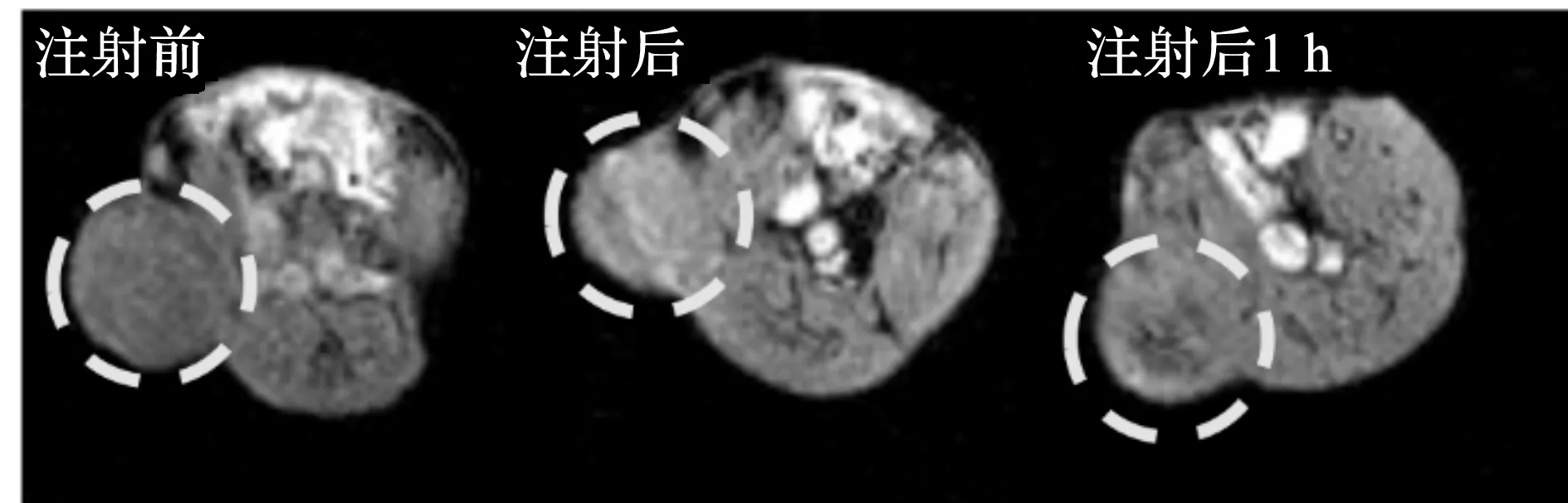
图19 T1加权MR图像Fig.19 Representative T1-weighted MR images
生物安全性是生物医用材料应用的重要指标之一。通过H&E染色的方法评价了131I-GENPs的生物安全性,结果如图20所示。将131I-GENPs以瘤内注射的方式注射到小鼠体内,两天后处死老鼠,解剖出心、肝、脾、肺、肾等重要脏器并进行H&E染色。与注射PBS的对照组相比,注射131I-GENPs后的小鼠组织未发现明显的细胞形态学改变,表明这种纳米颗粒具有良好的生物安全性。
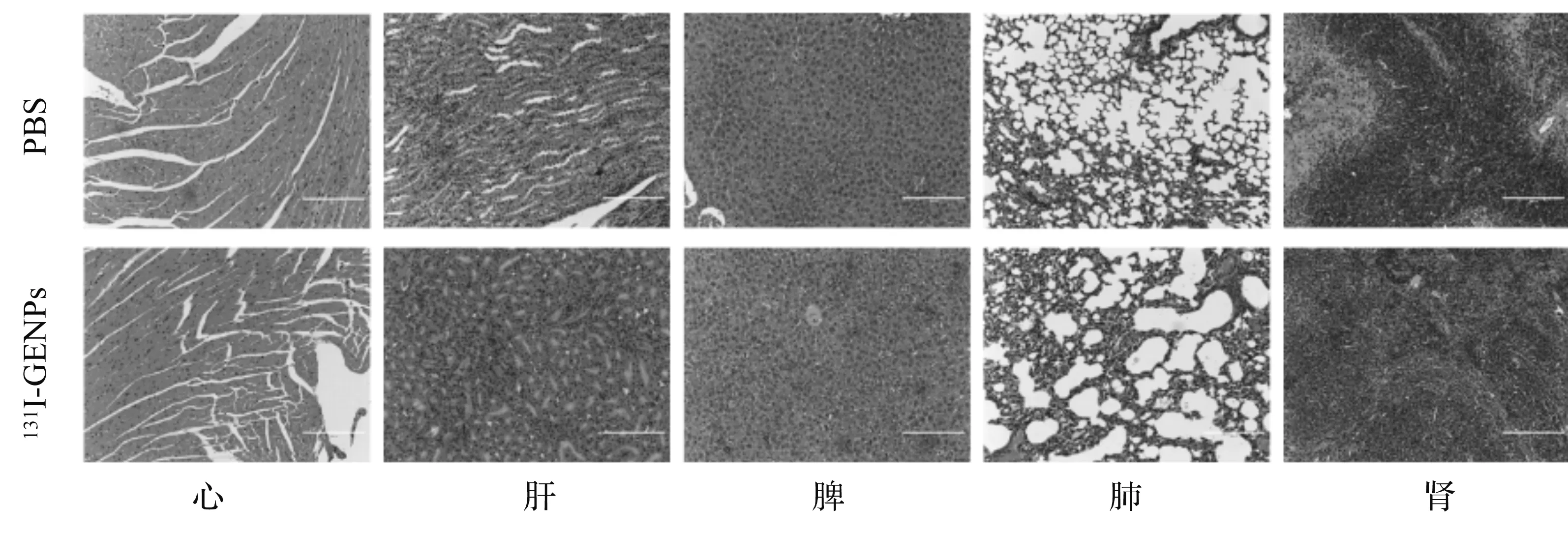
图20 小鼠主要器官的H&E染色图像(比例尺:200 μm)Fig.20 H&E stained images of major organs of mice (scale bar: 200 μm)
3 结 论
制备了131I标记的NaGdF4:Eu3+纳米颗粒(131I-GENPs)用于自发光成像、SPCET和MR成像。131I作为切伦科夫辐射源,不仅通过下转换激发了NaGdF4:Eu3+纳米颗粒的荧光信号,而且基于发射γ射线可以提供SPECT信号。同时,Gd3+的存在也可增强T1-MR成像信号。因此131I-GENPs有望作为自发光、SPCET和MR三模态成像探针用于精准诊断。

