降解胆固醇乳酸菌株的体外筛选及其酸乳发酵特性研究
刘建利,袁凤霞
(北方民族大学生物科学与工程学院,宁夏 银川 750021)
胆固醇具有非常重要的生理功能,但过多的胆固醇摄入体内可能造成血清胆固醇偏高,从而诱发各种疾病[1]。研究发现乳酸菌具有降胆固醇的特性[2-3],相对于药物治疗和饮食控制这两种临床上治疗高胆固醇血症的方式,用含乳酸菌的保健食品控制血清胆固醇浓度,简便易行[4]。目前,已从开菲尔粒和陈年泡菜水[5]、黏面子[6]、辣白菜[6]、辣酱[6]、西藏牦牛乳[7]、发酵香肠[8]等发酵食品及粪便[9]、海洋[10]和水果[11]等环境中分离筛选出降胆固醇的乳酸菌。这些菌株或可通过分泌胆盐来水解酶来水解胆盐,产生游离的胆汁酸,共沉淀胆固醇;或可使细胞膜通过吸附固定或同化吸收胆固醇;或调控胆固醇在人体内的代谢,进而减少胆固醇在血液中的含量[12-13]。
以发酵酸乳的方式摄入功能乳酸菌菌株,可以补充营养物质,容易被消费者所接受。虽然目前关于降解胆固醇乳酸菌株筛选的研究不少,但功能菌株资源的发掘仍需进行,而且现有研究对降解菌株是否能用于酸乳发酵关注的较少。我国各地区人民制作各种乳酸菌发酵食品历史悠久,产品风味独特、组织细腻、口感纯正,在当地自然温度下存放较长时间还能保证其口感和状态[14-15]。因此,在这些传统乳酸菌发酵食品中含有丰富、独特的优良乳酸菌资源。本试验拟以前期从传统乳酸菌发酵食品中分离的250株乳酸菌为候选菌株,筛选具有体外降胆固醇能力的菌株,并评价应用酸乳发酵的潜力和体外胃肠道耐受性,为开发功能发酵酸乳奠定基础。
1 材料与方法
1.1 材料与试剂
250株乳酸菌菌株:从新疆、西藏、青海、内蒙、甘肃等地生产的奶疙瘩、曲拉、乳扇、浆水、泡菜、酵头等传统乳酸菌发酵食品中分离筛选,宁夏特殊生境微生物资源开发与利用实验室-80℃保存。
胆固醇(化学纯):美国Sigma-Aldrich公司;胰蛋白酶(250U/mg):北京拜耳迪生物公司;胃蛋白酶(550U/mg):北京博奥拓达科技有限公司;胰蛋白胨、酵母提取物:英国Oxoid公司;邻苯二甲醛(化学纯):上海笛柏化学品有限公司;牛肉浸粉:青岛海博生物公司;牛胆盐:上海瑞永生物科技有限公司;细菌基因组提取试剂盒:康为世纪生物科技有限公司;2×EasyTaq PCR SuperMix(+dye):北京全式金生物技术有限公司;氯化钠、盐酸、浓硫酸、邻苯二甲醛、葡萄糖、乙酸钠、柠檬酸二胺、吐温-80、磷酸氢二钾、硫酸镁、硫酸锰、碳酸钙、无水乙醇:以上均为化学纯,天津市大茂化学试剂厂;纯牛奶:伊利乳业有限责任公司。
1.2 仪器与设备
TMS-PRO型质构仪:美国FTC公司;NDJ-8S型黏度计:上海庚庚仪器设备公司;S1000型快速梯度基因扩增仪(PCR仪):美国Bio-Rad公司;1-14型台式高速冷冻离心机:美国Sigma公司;754N紫外分光光度计:上海精密仪器仪表有限公司;ND100氮吹仪:杭州瑞诚仪器有限公司;MJ-54A全自动立式高压灭菌锅:施都凯仪器设备(上海)有限公司;DYY-12C电泳仪:北京六一生物科技有限公司。
1.3 试验方法
1.3.1 溶液和培养基配制
胆固醇标准液:准确称取胆固醇0.1 g,无水乙醇定容100 mL,混匀。
邻苯二甲醛溶液:准确称取邻苯二甲醛0.05 g,加冰乙酸溶解定容至100 mL。
50%KOH溶液:准确称取KOH固体50 g溶于100 mL蒸馏水中。
酸溶液:参考文献[16-20]有所修改,将生理盐水的pH值调至3.0,121℃下灭菌20 min。
胆盐溶液:参考文献[16-20]有所修改,称取0.3 g牛胆盐加水溶解定容至100mL,于121℃下灭菌20min。
人工模拟胃液:参考文献[16-20]有所修改,用5%NaCl溶液配制3 mg/mL胃蛋白酶溶液,调节pH值为2.5,经微孔滤膜过滤除菌后备用。
人工模拟胰液:参考文献[16-20]有所修改,用5%NaCl溶液配制1 mg/mL胰蛋白酶溶液,调整pH值为8.0,经微孔滤膜过滤除菌后备用。
高胆固醇培养基:MRS培养液中灭菌后加入除菌胆固醇至浓度0.1 mg/mL。
1.3.2 体外筛选降胆固醇菌株
1.3.2.1 胆固醇标准曲线的制备
分别精确吸取 100、200、300、400、500 μL 胆固醇标准液于10 mL容量瓶中,再用无水乙醇定容,配成10、20、30、40、50 μg/mL 的标准溶液。精确吸取各梯度溶液1.0 mL,加入10 mL试管中,并用氮吹仪吹干溶剂,然后准确加入2.0 mL邻苯二甲醛溶液,振荡使其充分溶解,在室温25℃下静置10 min,再加入1.0 mL浓硫酸,混合均匀,静置10 min使其显色,取2.0 mL邻苯二甲醛溶液加入1.0 mL浓硫酸,在室温25℃下静置10 min后作为对照组调零,在波长550 nm处测定其吸光度。以胆固醇浓度为横坐标,波长550 nm处的吸光度为纵坐标,绘制标准曲线,标准曲线方程为Y=0.022 9X-0.018 4,R2=0.992 9。
1.3.2.2 菌株降解胆固醇能力测定
取保藏的菌株50 μL接入5 mL MRS液体培养基中,37℃100 r/min摇床培养24 h活化;按1%的比例接种高胆固醇培养基中,于37℃培养24 h;以不接种菌、相同培养条件的高胆固醇培养基为空白对照。准确吸取培养液2 mL,12 000 r/min离心10 min。吸取上清液1 mL到50 mL比色管中,加入50%KOH 4.0 mL,混匀后加入6.0 mL 95%乙醇,漩涡振荡1 min。60℃水浴加热15 min,取出冷却至室温25℃后,向比色管中加入5.0 mL正己烷,混匀并加入3.0 mL蒸馏水,漩涡振荡15 min,然后静置15 min,取1.0 mL正己烷层溶液于试管中,用氮吹仪吹干,加入邻苯二甲醛溶液2.0 mL,混匀,室温25℃静置10 min,加入1.0 mL浓硫酸,并迅速涡旋振荡1 min,放置10 min后,在550 nm波长下测定其吸光度,代入标曲计算胆固醇含量,按下列公式计算菌株胆固醇降解率。

式中:X为胆固醇降解率,%;A为空白对照中胆固醇含量,mg/mL;B为接种各乳酸菌株的培养基中胆固醇含量,mg/mL。
1.3.3 评估菌株发酵酸乳能力
1.3.3.1 乳酸菌的活化及菌悬液制备
取各菌株MRS培养液,4℃6000r/min离心5min,弃上层培养液,加入无菌生理盐水制成菌悬液,调整菌液浓度大于1×108cfu/mL。
1.3.3.2 发酵酸乳的制备
取灭菌后的酸乳瓶,每瓶加入30 mL含蔗糖15%的牛奶,95℃灭菌5 min,待冷却后,接种5 mL菌悬液,40℃培养8 h~12 h,凝乳后取出,4℃保存。
1.3.3.3 发酵酸乳感官评定
将冷藏12 h的酸乳取出后,从食品科学与工程专业选8名~15名学生依据感官评价标准对其气味、质地、口感3个指标进行感官评定,评价标准见表1,记录数据计算平均值。

表1 酸乳感官评价标准Table 1 Sensory evaluation scale of yoghourt
1.3.3.4 发酵酸乳质构测定
测试探头型号为圆盘挤压探头P/75。测试条件:测前速率30 mm/min;测后速率与测前速率一致;两次压缩之间的停留间隔0 s;采样速度10 Hz;最小触发力0.3 N。
1.3.4 菌株体外模拟肠胃道耐受性试验
准确吸取0.5 mL菌悬液分别接种于4.5 mL pH 2.0的生理盐水、酸溶液、胆盐溶液、人工模拟胰液和人工模拟胃液中,处理4 h后,取500 μL处理液接种于5 mL MRS培养基中,于37℃下摇床培养8 h后,在600 nm处测量其吸光度,按下列公式计算存活率。

式中:X为存活率,%;A为各菌株在生理盐水中处理后培养液吸光度;B为各菌株在酸溶液、胆盐溶液、人工模拟胰液和人工模拟胃液中处理后培养液吸光度。
1.3.5 菌株分子生物学鉴定
参照细菌基因组DNA提取试剂盒提取菌株DNA,16SrDNA扩增反应体系(50μL):10×PCR Mix 25μL、10 μmol/L 的上下游引物各 1 μL、模板 DNA 1 μL、双蒸水 22 μL;PCR 反应程序:94℃预变性10min;94℃ 变性1 min;56℃退火1 min;72℃延伸1 min;重复扩增30个循环;72℃后延伸5 min。取3 μL PCR产物进行1.5%琼脂糖电泳检测,剩余PCR扩增产物由南京金斯瑞生物公司进行测序。用CIPRES Science Gateway中在线RAxML-HPC2 Blackbaox建ML进化树;在Figtree中编辑系统发育树。
1.3.6 数据处理及分析
采用SPSS11.0软件对试验数据进行方差分析(ANOVA),用Tukey进行多重比较。
2 结果与分析
2.1 各菌株胆固醇降解率测定结果
各菌株胆固醇降解率分布结果见图1,降解率高于40%菌株结果见图2。
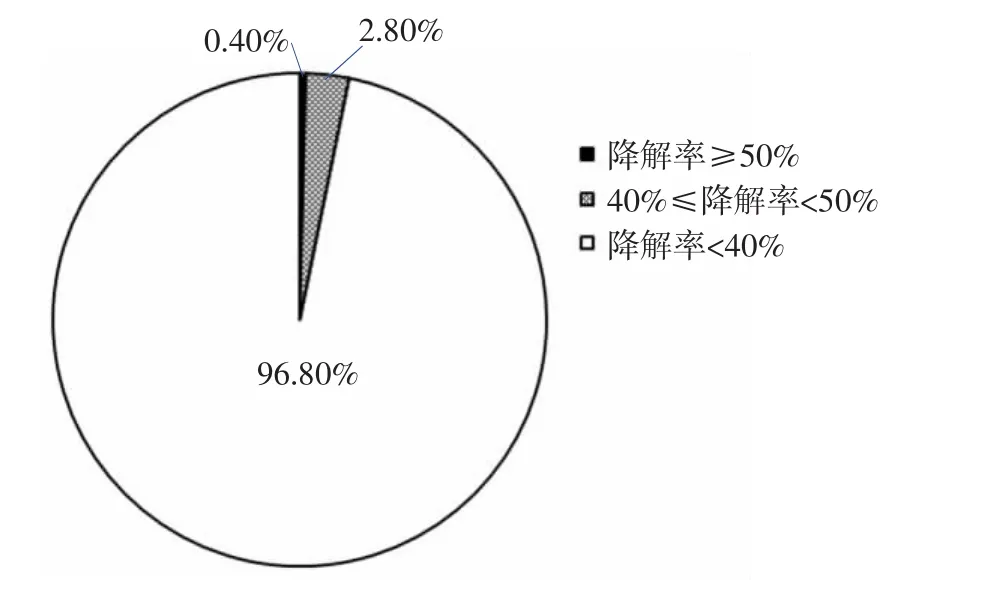
图1 各菌株胆固醇降解率分布Fig.1 The cholesterol-lowering rate distribution of all strains

图2 8株降解率高于40%的菌株Fig.2 The 8 strains with cholesterol-lowering rate more than 40%
如图1所示,大多数菌株胆固醇降解率较低,降解率低于40%的菌株有242株,占总菌株96.8%;如图2所示,降解率高于40%的有8株,占3.2%。分别为菌株“鲜豆腐 8”、“新 A19”、“广汕 1”、“新 E5”、“藏嘎圈 4”、“酸豆腐B10”、“藏嘎圈5”等。降解率高于50%的菌株只有1株,占0.4%,为菌株“青A16”,其降解率为54.64%。选择胆固醇降解率高于40%的8株菌进行后续试验。
2.2 降解胆固醇菌株酸乳发酵能力
2.2.1 降解胆固醇菌株发酵酸乳感官评价
各降解胆固醇菌株发酵酸乳感官评价结果见表2。

表2 各降解胆固醇菌株发酵酸乳感官评价结果Table 2 The result of sensory evaluation scores of yoghourt fermented with different strains
从质地、气味和口感方面评价8株高效降胆固醇菌株发酵酸乳,“鲜豆腐 8”、“新 A19”、“藏嘎圈 4”、“酸豆腐B10”、“藏嘎圈5”、“青A16”6株菌发酵酸乳的总分高于80分;“广汕1”、“新E5”两株菌发酵酸乳总分低于80分,主要是两株菌发酵酸乳气味相对较差。因此,选择80分以上的6株菌作为后续试验供试菌株。
2.2.2 各降解胆固醇菌株发酵酸乳质构测定
各降解胆固醇菌株发酵酸乳质构特性测定结果见图 3~图 5。

图3 各菌株发酵酸乳的咀嚼力测定Fig.3 Chewiness determination of yoghourt fermented with different strains

图4 各菌株发酵酸乳的弹性测定Fig.4 Elasticity determination of yoghourt fermented with different strains

图5 各菌株发酵酸乳胶黏性、硬度、最大黏附力、破裂力、内聚力测定Fig.5 Viscosity,hardness,maximum adhesion,crushing force and cohesion determination of yoghourt fermented with different strains
由图3可知,发酵酸乳的咀嚼力以“青A16”菌株最大(3.02 N),“藏嘎圈 5”的咀嚼力次之,为 2.13 N,“酸豆腐B10”最小,为1.32 N;由图4可知,弹性以“青A16”、“酸豆腐B10”和“藏嘎圈4”的最大,分别为20.93、20.83 N 和 20.67 N,“藏嘎圈 5”的最小(17.05 N);由图5 可知,胶黏性以“青 A16”的最大(0.15 N),“酸豆腐B10”和“藏嘎圈4”的最小,分别为0.07N和0.06 N;硬度“青 A16”的最大(0.28 N),“酸豆腐 B10”和“藏嘎圈5”最小,分别为0.93 N和0.80 N;最大黏附力以“青A16”的最大(0.126 N),“藏嘎圈 4”的最小(0.03 N);破裂力以“青 A16”的最大(0.36 N),“酸豆腐 B10”和“藏嘎圈 4”的最小(0.13 N);内聚力以“酸豆腐 B10”最大(0.54 N),“青 A16”的最小(0.36 N)。因此,除内聚力外,咀嚼性、弹性、胶黏性、硬度、最大黏附力、破裂力等指标均以菌株“青A16”发酵酸乳最高。
2.3 降解胆固醇菌株胃肠道耐受性
各菌株体外模拟胃肠道耐受性结果见图6。
由图6可知,在酸溶液中,只有“青A16”和“鲜豆腐8”两株菌存活率在40%以上;而在胆盐溶液中,“青A16”和“新A19”两株菌存活率达到40%以上,其中最大的是“新A19”,存活率为57.61%;在人工模拟胃液中,“鲜豆腐 8”、“青 A16”和“新 A19”3 株菌的存活率达到40%以上,其中“新A19”的存活率最高,存活率为73.73%;在人工模拟胰液中,除了“新A19”菌株被抑制

图6 菌株胃肠道耐受性结果Fig.6 The result of survive of strains in artificial simulated gastrointestinal tract environment
不同字母表示存在显著差异,p<0.05。了28%左右,其他的菌株生长反而有促进的趋势。综合比较,“青A16”具有较好的耐受性,在各个处理液中存活率均高于40%。
2.4 菌株分子生物学鉴定
菌株分子生物学鉴定结果见图7。
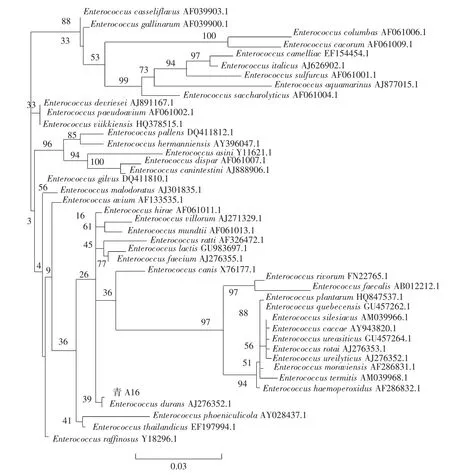
图7 基于16S rDNA构建Enterococcus属系统发育树Fig.7 The phylogenetic tree of the genera Enterococcus based on 16S rDNA sequences
由图7可知,菌株“青A16”的16S rDNA序列在EzBioCloud中经过比对,显示与耐久肠球菌(Enterococcus durans)NBRC 100479(Type)的 16S rDNA 序列相似度高达99.93%;基于16S rDNA用ML法构建Enterococcus属系统发育树,也显示“青A16”菌株与耐久肠球菌分枝聚在一起。因此,分子生物学鉴定结果“青A16”为耐久肠球菌。
3 讨论
已有研究表明,我国传统发酵食品是包括降解胆固醇等各种乳酸菌的重要资源库。例如,西北特有食品浆水[21]、发酵酸肉[22]、藏灵菇[23]、四川泡菜[24]、贵州泡椒[25]、腊肉[26]、腊肠[27]等。本试验筛选到胆固醇降解率最高的菌株“青A16”,分离自西藏牧民自制的曲拉。
已报道降胆固醇乳酸菌主要有乳酸乳球菌乳亚种(Lactococcus lactis subsp.lactis)、乳酪短杆菌(Brevibacterium casei)[21],棉籽糖乳球菌(L.raffinolactis)、消化乳杆菌(L.alimentarius)[22]、嗜酸乳杆菌(L.acidophilus)[23]、植物乳杆菌(L.plantarum)[24]、海氏肠球菌(Enterococcus hirae)[25]、屎肠球菌(E.faecium)[25]等。本试验获得的“青 A16”为耐久肠球菌(E.durans),报道较少。
目前已报道的降解胆固醇菌株的降解能力差异较大,除李雪萍等[21]筛选到4株菌降解率大于75%,最高达92.28%以外,其余报道的菌株降解率均在30%~60%之间[23-27]。菌株降解能力不同,可能和菌株本身有关,也有可能和使用的胆固醇底物有关,有学者使用卵磷脂和胆固醇胶束作为底物[13,22,26-27],胶束在溶液中分布更均匀,但可能会影响菌体吸收;还有小部分研究使用鸡蛋黄作为胆固醇源[24],蛋黄成分较复杂,蛋黄中其他成分如蛋白质、卵磷脂等可能会促进胆固醇较易被菌体吸收。另外,即使用相同胆固醇为底物,在筛选培养基中的初始添加量不同,可能测得的降解率也不同,李雪萍等[21]用2 mg/mL胆固醇测得降解率最高达92.8%,丁苗等[22]用200 mg/mL测得降解率最高达33.78%,黄颖等[23]、汪晓辉等[27]、用 0.1 mg/mL 分别测得降解率最高达50.36%、50.03%,居华等[24]用1 mg/mL测得降解率最高45.31%。本试验用无水乙醇先溶解胆固醇化合物配成母液,再以终浓度0.1 mg/mL初始量添加到MRS液体培养基中,筛选获得的菌株最高降解率54.64%,和黄颖等[23]、汪晓辉等[27]结果相近。
人体正常胃液的pH值在3左右,在此pH值条件下,大部分微生物都难以存活,同时人体肠胃道中胆盐、胃蛋白酶、胰酶等消化酶,也会影响微生物的生长。对于益生乳酸菌,必须进入人体的肠道才能发挥其益生功能,要求菌株必须能够耐受机体胃肠道环境,在人体肠道特殊环境中存活并增殖,因此,菌株在人体肠道内的耐受性尤为重要[28]。本试验筛选的菌株“青A16”对酸、胆盐、胃蛋白酶和胰酶有一定的耐性,在各溶液中存活率都在40%以上,理论上能在人体胃肠道存活。另外,本试验测得菌株降解能力,是体外检测方法,益生菌在肠道发挥作用和体外培养基中有很大不同,后续还需对菌株在模型动物体内降解胆固醇能力和肠道黏附定殖能力进行深入研究。
4 结论
本试验通过高胆固醇培养基筛选获得体外胆固醇降解率为54.64%耐久肠球菌菌株“青A16”,并用此发酵的酸乳感官评价得分和质构测定指标均较高,而且此菌株在酸溶液、胆盐溶液、人工模拟胰液和人工模拟胃液中存活率均达到了40%以上,表明“青A16”菌株既能高效降胆固醇又能用于酸乳发酵还能定植胃肠道,可作为功能酸乳开发候选发酵菌株。

