植物源防腐剂的制备及抑菌机理研究
张梅,李晓君,*,成悦,张志军,渠志灿
(1.中北大学化学工程与技术学院,山西 太原 030051;2.山西纳安生物科技股份有限公司,山西 太原 030006)
防腐剂是指以抑制微生物生长和繁殖为目的而加入产品的一种(类)物质,是产品设计中重要的添加剂,不仅可以保障产品在生产和货架期的稳定,同时可有效防止二次污染。传统的化学合成防腐剂种类繁多[1],部分防腐剂在应用过程存在许多问题,如食品防腐剂超标会引发致病的潜在风险,部分化妆品防腐剂会引发皮肤过敏等不良反应[2],同时近年来大众越来越追求纯天然、绿色产品,越来越多的企业开始寻求新的安全无害的防腐替代方案。
植物提取物(以下简称植提物)以其绿色、安全等特性成为化学防腐剂的最佳替代品[3-5]。但是单一的植提物其抑菌活性和广谱性有限,通过组合复配开发新型防腐剂显得尤为重要。基于此,本文以9种植提物对3种常见污染微生物的抑菌强弱及广谱性为依据,从中筛选出4种植提物,并进一步复配得到一种抗菌性较强的植物源防腐剂,同时通过测定植物源防腐剂对大肠杆菌细胞膜通透性、细胞壁完整性等的影响来探究其抑菌机理,为开发新型绿色、安全、高效的植物源防腐剂提供理论支撑。
1 材料与方法
1.1 试剂与仪器
大肠杆菌、金黄色葡萄球菌、白色念珠菌:中国普通微生物菌种保藏管理中心;连翘精油、无花果精油、丁香精油:江西亿森源植物香料有限公司;紫苏提取物、丁香提取物、无花果提取物(均为水提物):中北大学生物工程实验室提供;2%连翘苷、银杏黄酮19C、银杏黄酮20C:宁波瑞源生物科技有限公司;复配防腐剂(组分:1.0%~1.6%5-氯-2-甲基-4-异噻唑啉-3-酮、0.3%~0.5%2-甲基-4-异噻唑啉-3-酮、0.7%~0.8%氯化镁、20%~25%硝酸镁、水):大连百傲化学股份有限公司;牛肉膏、蛋白胨、氯化钠、琼脂、二甲基亚砜、无水乙醇、葡萄糖、牛血清蛋白、丙烯酰胺、甲叉双丙烯酰胺、考马斯亮蓝G-250、巯基乙醇、2.5%戊二醛、磷酸二氢钾、磷酸氢二钾(均为分析纯):上海阿拉丁生化科技股份有限公司。
可见分光光度计(JH-14-04):上海菁华科技仪器有限公司;台式恒温培养摇床(FLY-200B):深圳市爱特尔电子科技有限公司;立式压力蒸汽灭菌器(YXQLS-50S):北京同德创业科技有限公司;超净工作台(VD-1320):上海市金鹏分析仪器有限公司;酶标分析仪(DNM-9602G):北京普朗新技术有限公司;电导率仪(DDS-11A):杭州奥立龙仪器有限公司;电泳仪(DYY-12):北京市六一仪器厂;扫描电子显微镜(SU8010):日本日立仪器有限公司。
1.2 植物提取物的筛选
1.2.1 菌悬液的制备
将菌种转移至LB液体培养基中,37℃(真菌转移至PDA培养基,28℃)、120 r/min于恒温培养箱中培养,每隔1 h用分光光度计测其在600 nm处的OD值,用比浊法[6]将菌液浓度调至107CFU/mL备用。
1.2.2 植物提取物的浓度梯度
精油类:连翘精油(编号1#)、无花果精油(编号2#)、丁香精油(编号 3#),浓度梯度为 30%、20%、10%、1%、0.5%、0.25%、0.125%;其他植物提取物:紫苏提取物(编号 4#)、2%连翘苷(编号5#)、丁香提取物(编号6#)、银杏黄酮 19C(编号 7#)、银杏黄酮 20C(编号 8#)、无花果提取物(编号9#),浓度梯度为100%、90%、80%、40%、20%、5%、2.5%、1.25%。精油类稀释溶剂为4%二甲基亚砜溶液,其他植提物稀释溶剂为水。
1.2.3 最小抑菌浓度(minimum inhibitory concentration,MIC)的测定
MIC值测定采用96孔板法,确定菌悬液的菌落形成单位(CFU)满足 106CFU/mL~108CFU/mL后,将试验组(各植提物+菌液)、阴性对照组(无菌水+菌液)、空白组(无菌水)分别加入到无菌的96孔板中,在37℃(真菌28℃)培养0、12、24 h后于600 nm处测其OD值,对比OD600得出MIC值,每个样品做3组平行。通过比较9种提取物对3种供试菌的抑菌强弱及广谱性,筛选出4种植提物进行后续试验。
1.3 4种植提物的复配
通过1.2筛选出4种植提物,分别为连翘精油(编号 1#)、无花果精油(编号 2#)、丁香精油(编号 3#)、紫苏提取物(编号4#),用棋盘稀释法[7-8]将4种植提物进行复配,首先两两复配,然后选取有联合作用的两种植提物与第3种植提物进行复配,以此类推。以各提取物MIC值的1/8、1/4、1/2、1倍、2倍进行联合,示意图见图1。
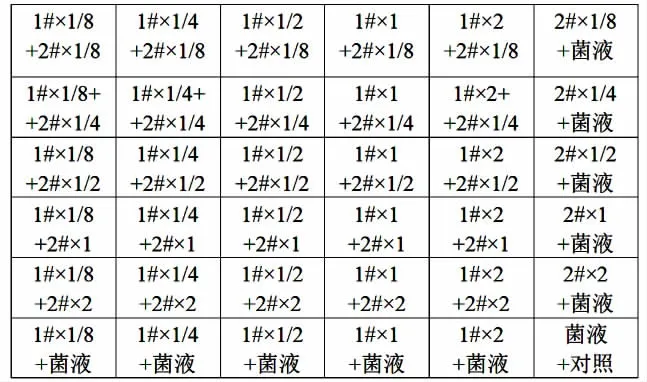
图1 棋盘稀释法示意图Fig.1 Schematic diagram of chessboard dilution method
在96孔板中,保证每个孔内所加液体体积一致,平均每个孔做3组平行。MIC值的测定同1.2.3,通过以下公式计算复配强度(compound strength,CS),判断其复配抑菌效果。

式中:CS≤0.5为协同作用;0.5<CS≤1为相加作用;1<CS≤2 为无关作用;CS>2 为拮抗作用。
1.4 植物源防腐剂抑菌机理分析
按1.3复配后将得到3个配方,以抑菌能力及广谱性为原则,选择最佳配方,并选择抑菌性较强的100%无花果精油作为对照,以大肠杆菌作为试验菌种研究抑菌机理。
1.4.1 植物源防腐剂对3种供试菌MIC值测定
方法同1.2.3。
1.4.2 细胞膜通透性试验
细胞膜通透性指细胞膜遭到破坏后,胞内的物质释放到胞外的程度。细胞膜完整性可通过K+渗透试验及核酸渗漏试验有效反映。
1.4.2.1 K+渗透试验
参照文献方法[9-11]并稍作修改。取对数生长期的菌悬液,8 000 r/min离心10 min,弃去上清液,用5%葡萄糖溶液洗涤3次,重悬菌体调节至107CFU/mL,分别加入无菌水、无花果精油(编号2#)、植物源防腐剂(编号BP)、复配防腐剂(编号MIT)使其最终浓度为各自的0.5 MIC,于37℃下培养4 h。然后8 000 r/min离心10 min,取上清液测定电导率L1;测定葡萄糖溶液的电导率L0;测定不含菌体、加入不同抑菌剂的葡萄糖溶液的电导率L3;取另一份不加抑菌剂的菌悬液煮沸5min后测定上清液电导率L2,细胞内膜的渗透性用相对电导率C来表示。
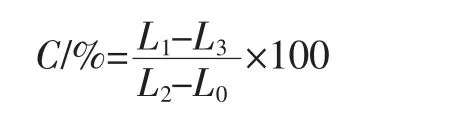
1.4.2.2 核酸渗漏试验
参照Lv等的方法[12]并稍作改动。取对数生长期的菌悬液8000r/min离心10min,弃去上清液,用0.067mol/L的磷酸盐缓冲液(phosphate buffered solution,PBS)(pH7.2)洗涤沉淀3次,用PBS重悬至107CFU/mL得到菌体沉淀和PBS的混合液,混合液分别加入无花果精油(编号2#)、植物源防腐剂(编号BP)使其最终浓度为各自的0.5MIC,以加无菌水的混合液作为阴性对照,加复配防腐剂(编号MIT)的混合液作为阳性对照,37℃恒温振荡培养4 h,10 000 r/min离心10 min,测定上清液OD260值即为核酸渗漏量,阴性对照组以PBS为参比,试验组以加入抗菌剂的PBS为参比。
1.4.3 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDSPAGE)分析
参照Xing等[13]的方法稍作改动。取大肠杆菌菌悬液,分别加入无花果精油(编号2#)、植物源防腐剂(编号BP)使其最终浓度为各自的0.5MIC,以加无菌水的菌悬液作为阴性对照,加复配防腐剂(编号MIT)的菌悬液作为阳性对照,分别加100 μL样品缓冲液,37℃下分别孵育 1、3、6 h,8 000 r/min 离心 1 min,取 20 μL上清液进行SDS-PAGE。浓缩胶和分离胶的浓度分别为5%和12.5%,电泳结束后用考马斯亮蓝染液染色并脱色处理。
1.4.4 扫描电镜分析
参照文献方法[14]并稍作修改。取对数期的菌悬液,分别加入无花果精油(编号2#)、植物源防腐剂(编号BP)使其最终浓度为各自的0.5MIC,以加无菌水的菌悬液作为阴性对照,加复配防腐剂(编号MIT)的菌悬液作为阳性对照,37℃、120 r/min培养3 h,8 000 r/min离心10 min,弃去上清液,用0.067 mol/L的PBS(pH7.2)洗涤沉淀3次,重悬至108CFU/mL。然后用预冷的2.5%戊二醛重悬,4℃下固定24 h后8 000 r/min离心5 min,弃去上清液,按顺序分别用30%、50%、70%、80%、90%、100%乙醇脱水,每次静置10 min,最后将酒精换为叔丁醇,冷冻干燥,喷金后进行扫描电镜观察。
1.5 统计分析
试验均设置3次平行,采用Origin 2019进行绘图。
2 结果与分析
2.1 9种植物提取物对3种供试菌的MIC值测定结果
不同植物提取物对3种供试菌的MIC值见表1。

表1 不同植物提取物对3种供试菌的MIC值Table 1 MIC values of different plant extracts against three tested bacteria
由表1可知,连翘精油、无花果精油、丁香精油、紫苏提取物对3种供试菌抑制作用较强,因此选择这4种植提物进行后续研究。
2.2 4种植提物复配结果
4种植提物联合对大肠杆菌、金黄色葡萄球菌、白色念珠菌的CS值见表2、表3、表4。

表2 4种植提物联合对大肠杆菌的CSTable 2 Four plant extracts combined with CS against Escherichia coli

表3 4种植提物联合对金黄色葡萄球菌的CSTable 3 Four plant extracts combined with CS against Staphylococcus aureus

续表3 4种植提物联合对金黄色葡萄球菌的CSContinue table 3 Four plant extracts combined with CS against Staphylococcus aureus
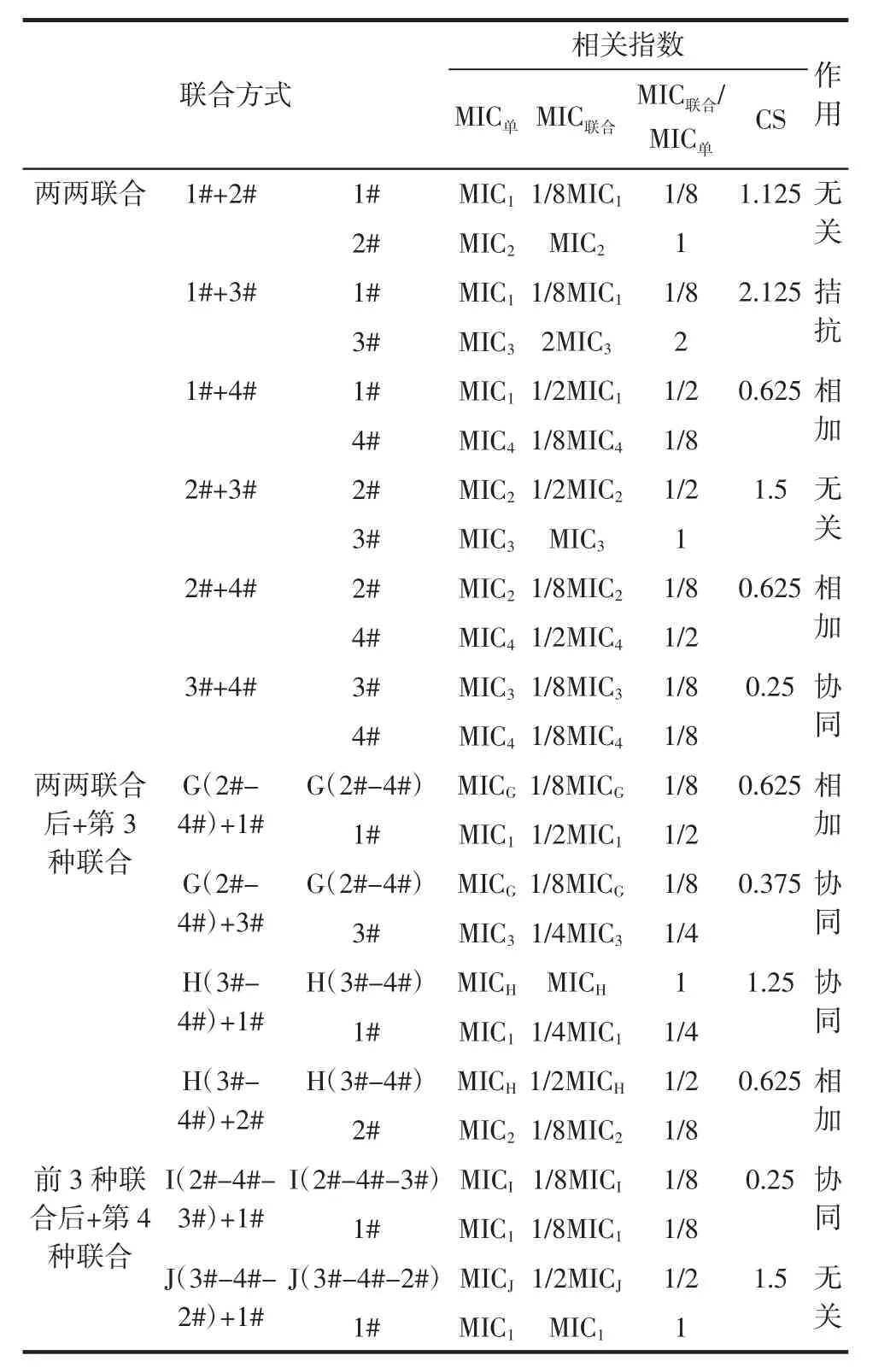
表4 4种植提物联合对白色念珠菌的CSTable 4 Four plant extracts combined with CS against Candida albicans
由表2、表3、表4可知,4种植提物对大肠杆菌、金黄色葡萄球菌、白色念珠菌得到3种复配结果,分别为配方Ⅰ(0.062 5%连翘精油-0.031 25%无花果精油-0.125%丁香精油-1%紫苏提取物)、Ⅱ(0.062 5%连翘精油-0.125%无花果精油-0.031 25%丁香精油-1%紫苏提取物)、Ⅲ(0.062 5%连翘精油-0.031 25%无花果精油-0.125%丁香精油-1%紫苏提取物),体积比均为1∶1∶1∶1。由于配方Ⅰ、Ⅲ结果一致,考虑到植物源防腐剂抑菌广谱性,选择配方Ⅰ为植物源防腐剂最佳配方,即0.062 5%连翘精油-0.031 25%无花果精油-0.125%丁香精油-1%紫苏提取物。
2.3 植物源防腐剂抑菌机理分析
2.3.1 植物源防腐剂对3种供试菌的MIC值
植物源防腐剂对大肠杆菌、金黄色葡萄球菌、白色念珠菌的MIC分别为0.25%、0.125%、0.25%。
2.3.2 植物源防腐剂对细胞膜通透性的影响
2.3.2.1 K+渗透试验
不同试验处理组对K+渗透的影响见图2。

图2 不同试验处理组对K+渗透的影响Fig.2 Effect of different experimental treatment groups on K+permeation
由图2可知,与阴性对照相比,植物源防腐剂处理组(BP处理组)菌悬液相对电导率增加了82.57%,原因可能是植物源防腐剂能破坏大肠杆菌的细胞膜,导致膜内的K+等电解质离子释放到菌悬液中导致菌悬液电导率升高[15],也有可能因为植物源防腐剂进入到大肠杆菌细胞内,破坏了细胞正常生理代谢,导致细胞凋亡,细胞膜破裂。
2.3.2.2 核酸渗漏试验
不同试验处理组对核酸渗漏的影响见图3。

图3 不同试验处理组对核酸渗漏的影响Fig.3 Effect of different experimental treatment groups on nucleic acid leakage
核酸在260 nm处有最大吸收,通过测定菌悬液在260 nm处的OD值可有效反映大肠杆菌的核酸渗漏情况。如图3所示,植物源防腐剂处理组(BP处理组)的核酸含量是阴性对照的3倍,且比纯精油的无花果精油处理组(2#处理组)增加接近1倍,但低于阳性对照组。说明植物源防腐剂增加了菌体细胞膜的通透性,导致在正常状态下处于胞内的核酸大分子通过细胞膜渗漏到胞外,与电导率的变化趋势一致[16],李琪孟等[17]研究所得马铃薯胰蛋白酶抑制剂的抑菌机理也是通过改变细菌细胞膜的通透性导致核酸渗漏增加,与本试验研究结果一致。
2.4 SDS-PAGE测定结果
不同试验处理组对大肠杆菌菌体蛋白质表达的影响如图4所示。

图4 不同试验处理组对大肠杆菌蛋白质表达的影响Fig.4 Effects of different treatment groups on protein expression of Escherichia coli
在作用时间1、3、6 h后,大肠杆菌的蛋白质表达发生显著变化,表现为条带由多变少,3个试验组均能较好地抑制大肠杆菌蛋白质的表达,且由泳道1、2条带的变化可知,植物源防腐剂对蛋白质表达的影响大于无花果精油,究其原因,可能是植物源防腐剂对大肠杆菌菌体相关蛋白酶的活性有所抑制[18]。
2.5 扫描电镜结果
图5为不同试验处理组大肠杆菌扫描电镜图。

图5 不同试验处理组大肠杆菌扫描电镜图Fig.5 Scanning electron microscopy of Escherichia coli in different experimental groups
由图5a和图5b可知,正常生长的大肠杆菌呈棒状、表面光滑;经植物源防腐剂处理过的大肠杆菌表面出现明显突起,部分菌体有明显的扭曲变形(图5c和图5d),表明植物源防腐剂可破坏大肠杆菌细胞壁的完整性,从而抑制其生长繁殖;同时无花果精油处理组和阳性对照组也对大肠杆菌细胞壁有较强的破坏作用。究其原因可能是植物源防腐剂含有精油成分,精油类物质脂溶性较强,细菌细胞膜主要由磷脂双分子层及蛋白质构成,亲脂性较强的植物源防腐剂作用于大肠杆菌导致细胞壁被破坏,细菌细胞质膜失去细胞壁保护极易被破坏[19-20]。
3 结论
通过初筛和组合复配,开发出一款由连翘精油、无花果精油、丁香精油和紫苏提取物组成的植物源防腐剂,其配方为0.062 5%连翘精油-0.031 25%无花果精油-0.125%丁香精油-1%紫苏提取物,体积比为1∶1∶1∶1;并对植物源防腐剂的抑菌机理进行初步探究,与单一植提物相比,经复配后的植物源防腐剂抑菌能力更强。初步推测植物源防腐剂的抑菌机理为破坏细菌的细胞形态及细胞膜的渗透压,改变其通透性,再破坏细菌的遗传物质、蛋白质等结构达到抑菌防腐的目的。本研究说明植物源防腐剂在天然抑菌剂方面有一定的发展前景。

