酶解骨粉对低钙大鼠的补钙功效研究
李玉娟, 肖楠, 刘珊, 刘菲菲, 隋岩
(1. 北京理工大学 生命学院,北京 100081;2.内蒙古天奇生物科技有限公司,内蒙古,赤峰市 024000)
钙是人体所需的常量元素之一,能维持机体细胞正常功能. 人体99%的钙元素以羟基磷灰石的形式存在于骨骼和牙齿中,其余游离钙存在于血液、软组织和细胞外液,形成混溶钙池,骨骼中的钙和混溶钙池保持动态平衡[1]. 人体长期钙含量摄入不足则会打破这个动态平衡,导致骨钙储留不足,引起骨质疏松、佝偻症等代谢性骨病的发生[2-3]. 根据中华人民共和国国家卫生健康委员会发布的WS/T578.2—2018《中国居民膳食营养素参考摄入量》,青少年每日钙推荐摄入量为1 000~1 200 mg,成年人为800~1 000 mg. 但2019年中国居民营养与健康状况调查报告显示,我国居民的膳食营养素中平均钙摄入量不足营养学标准的50%,缺钙现象在儿童、孕妇及老人等人群中则更为明显[4]. 合理选择补钙制剂对改善我国居民钙摄入量不足有重大意义.
目前,上市的补钙制剂种类较多,主要包括无机酸钙(如碳酸钙、磷酸氢钙等)、有机酸钙(葡萄糖酸钙、乳酸钙、柠檬酸钙、氨基酸螯合钙、L-苏糖酸钙)等. 虽然碳酸钙片剂目前市场占有率比较高,但其小肠吸收率仅有30%;葡萄糖酸钙和乳酸钙比碳酸钙溶解性更好,但其含钙量相对较低;L-苏糖酸钙的吸收率很高但价格昂贵[5]. 针对目前补钙产品的现状,亟待研发新型的补钙制剂. 酶解骨粉(enzymatic hydrolyzed bone powder, EBP)是对牛骨物理处理后,采用酶水解法得到的产品,其具有钙含量高、钙易吸收的优势[6-7],但目前全面评价酶解骨粉的相关研究较为少见. 本研究采用低钙饲料喂养构建低钙大鼠模型,灌胃给予大鼠酶解骨粉,通过检测股骨组织病理学、骨密度、股骨干重与灰重、骨钙与骨磷含量、生物力学指标、钙表观吸收率等,以期全面评价酶解骨粉的补钙功效,为其临床应用奠定研究基础.
1 实验材料与方法
1.1 仪器和试剂
RM2235石蜡切片机(德国Leica公司);DPX骨密度仪(美国LUNAR公司);1195电子拉伸机(英国Instron公司);Multiskan MK3酶标仪(美国Thermo公司);Centrifuge 5424高速台式离心机(美国Eppendorf公司);BP61电子分析天平(德国Sartorius公司);DHP-9052A电热恒温培养箱(北京陆希科技有限公司);902型-80 ℃低温冰箱(美国Thermo公司);7500ce电感耦合等离子体质谱仪(美国Agilent公司);Milli-Q超纯水系统(美国Bedford公司).
酶解骨粉(含钙量为25%,内蒙古天奇生物科技有限公司,批号20191212,保质期三年);碳酸钙(优级纯,含钙量为40%,石家庄西默科技有限公司,批号20191017,保质期两年);水合氯醛(分析纯,天津科密欧化学试剂有限公司,批号J22J10H90920,保质期两年).
低钙饲料配制(含钙量10~20 mg/kg,北京互持生物科技有限公司,批号20191209,保质期三个月)[8]:酪蛋白10.0%,黄豆粉15.0%,小麦面粉54.0%,玉米油4.0%,纤维素2.0%,混合盐2.6%,混合维生素 1.0%,氯化胆碱0.2%,dl-蛋氨酸0.2%, 淀粉11.0%.
1.2 实验动物
4周龄雄性SD大鼠60只,SPF级,体重(80±10)g,由中国食品药品检定研究院提供,经动物伦理委员会同意,许可证号:SCXK(京)2017-0005. 屏障环境饲养,环境温度(24 ± 2)℃,相对湿度40%~60%,12 h光/12 h暗交替. 自由采食和饮水. 实验前适应性喂养一周,期间自由摄食饮水.
1.3 构建低钙模型与给药
4周龄健康雄性SD大鼠适应性喂养1周后,随机分为对照组(CON)、低钙模型组(MOD)、酶解骨粉低、中、高剂量组(分别记做LEBP、MEBP、HEBP)和阳性药碳酸钙(POS)组,每组10只. 对照组饲以正常饲料,自由饮水,其余各组大鼠给予低钙饲料6周,自由饮用去离子水. 第7周开始,连续4周给与各组大鼠200、400、800 mg/kg的酶解骨粉混悬液、500 mg/kg的碳酸钙混悬液,低钙模型组和对照组大鼠灌胃给与等量去离子水.
1.4 钙代谢实验
灌胃给药最后3天进行钙代谢实验. 将大鼠移入代谢笼,分笼喂养. 记录3天进食量,连续收集72 h粪便,80 ℃烘干,称重,记录粪便量. 将鼠粪研细、过筛、混匀、消化,采用火焰原子吸收法测定粪钙含量,计算钙的表观吸收率,计算公式如下:
摄入钙=饲料中钙含量×饲料消耗量
粪钙=鼠粪中钙含量×粪便量
钙的表观吸收率=(摄入钙-粪钙)/摄入钙×100%
1.5 样本收集
末次给受试物后禁食24 h,大鼠腹腔注射水合氯醛(0.3 g/kg),待其麻醉后,剪开大鼠腿部皮肤,将大鼠左右两侧股骨剥离干净,剔除胫骨上附着的肌肉组织和韧带. 左侧股骨用生理盐水浸湿的纱布包裹,-80 ℃冻存;右侧股骨固定于4%多聚甲醛中,4 ℃保存.
1.6 病理学检查
将固定于组织固定液中的大鼠右侧股骨用磷酸盐缓冲液漂洗,置于4.13%的EDTA-2Na溶液(pH 7.4)中4 ℃脱钙30天. 脱钙完全后,以流水冲洗30 min,然后将右侧后肢股骨上1/3端沿正中矢状面剖开,石蜡包埋切片,苏木素-伊红(HE)染色,显微镜下观察.
1.7 骨密度、生物力学指标检测
取大鼠左侧股骨置于DPX骨密度仪测试台上,扫描并测定股骨中点密度. 在1195电子拉伸机上进行三点弯曲实验. 将左侧股骨放置于支座上,使其横截面短轴方向与载荷方向保持一致,跨距为17 mm,加载速度为3 mm/min. 通过所得载荷-挠度曲线得到位移、斜率、强度力学指标.
1.8 股骨干重、灰重、骨钙、骨磷含量测定
去除左侧股骨软组织,用生理盐水冲去骨髓,在环流热空气高热箱中120 ℃烘干1 h,用三氯甲烷和甲醇(2∶1)混合液浸泡72 h脱脂,烤箱120 ℃烘干6 h,称量其干重. 然后置于马福炉中600 ℃灰化6 h,测量其灰重. 采用火焰原子吸收法测定骨钙、骨磷含量.
2 数据处理
运用Prism 8.0软件进行数据处理和统计分析. 数据均以均值±标准差(Mean±SD)表示,组间差异比较采用单因素方差分析,p< 0.05表示有显著的统计学差异.
3 结果与讨论
3.1 酶解骨粉有效改善股骨组织病理学
采用HE染色对各组大鼠右侧股骨进行组织病理学观察和病理评分,结果如图1所示. 与对照组相比,模型组骨皮质厚度降低,骨基质黏液变性加重,骨小梁数量显著减少且局部结构紊乱,骨髓腔明显扩大,骨膜增生严重,表明长期低钙饲养使模型组大鼠骨密度降低,骨脆性增加. 给与酶解骨粉后大鼠股骨中骨皮质厚度提高,骨小梁数量显著增加,骨髓腔面积减小,其中高剂量酶解骨粉和阳性药组大鼠骨小梁结构最为清晰(图1(e),1(f)),表明酶解骨粉对低钙导致的骨小梁减少和结构紊乱有很好的保护作用.
3.2 酶解骨粉提高低钙大鼠的钙表观吸收率
通过钙代谢实验计算各组大鼠的钙表观吸收率,结果见表1. 模型组大鼠钙表观吸收率为-96.5%,与对照组相比显著降低(p< 0.01),说明钙流失严重. 给予低钙大鼠酶解骨粉后,低、中、高剂量组的钙表观吸收率依次为-2.55%、-1.57%和-0.283%,显示大鼠体内钙表观吸收率均显著增加(与模型组相比,p< 0.01),且随着剂量的增加而提高. 以上结果说明酶解骨粉能有效缓解低钙大鼠的骨钙流失,有助于低钙大鼠的钙表观吸收率恢复到正常水平.

表1 大鼠钙表观吸收率
3.3 酶解骨粉对低钙大鼠股骨密度、生物力学指标的影响
通过骨密度仪和三点弯曲实验检测大鼠股骨密度及生物力学指标(位移、斜率、强度),测定结果如表2所示. 相较于对照组,模型组大鼠股骨密度降低了17.8%. 与模型组相比,低、中、高剂量酶解骨粉组大鼠的股骨密度逐渐升高,高剂量组和阳性药组大鼠股骨密度分别提高了14.1%和15.1%. 位移、斜率和强度都是衡量骨骼强度的重要力学指标,可以反映骨生长代谢状况. 模型组大鼠股骨位移和斜率均低于对照组大鼠,但未见显著差异. 给予低钙大鼠各剂量酶解骨粉后,大鼠股骨位移和斜率都表现出升高趋势,而股骨强度表现无显著规律. 以上结果表明,高剂量酶解骨粉能有效提升低钙大鼠的股骨密度,并且对股骨力学性能的提高或有积极作用.

表2 酶解骨粉对低钙大鼠股骨骨密度和生物力学指标的影响
3.4 酶解骨粉对低钙大鼠股骨干重、灰重、骨钙和骨磷含量的影响
大鼠股骨干重(dry weight of femur)、灰重(ash weight of femur)、骨钙(Ca-bone)和骨磷(P-bone)的测定结果如图2所示. 与对照组相比,模型组大鼠股骨干重、灰重均显著降低(p< 0.01),分别减少了13.7%、15.1%. 酶解骨粉给药大鼠的股骨干重、灰重随着给药剂量的增加而上升,干灰重比也略有提高,但与模型组相比未见显著性差异. 与对照组相比,模型组大鼠股骨的骨钙、骨磷分别降低了16.4%、16.9%. 三个剂量组的酶解骨粉均能显著提高低钙大鼠的骨钙和骨磷含量(与模型组相比,p< 0.01). 低剂量酶解骨粉组升高大鼠股的骨钙和骨磷含量效果最为显著(与模型组相比,p<0.01),分别提高了13.0%和15.0%,且效果显著优于阳性药碳酸钙. 以上结果说明酶解骨粉能有效提高低钙大鼠骨骼中钙磷酸盐等矿物质含量,促进骨基质中的钙沉积,加快骨形成,从而发挥补钙作用. 酶解骨粉对低钙大鼠股骨钙与磷含量的提升作用并未表现出剂量依赖性关系,低剂量酶解骨粉的作用最为显著,或更能有效提高股骨中钙磷酸盐的含量.
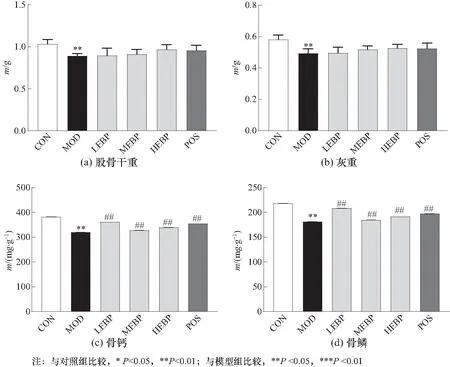
图2 各组大鼠股骨干重、灰重、骨钙和骨磷含量
4 结束语
钙主要经小肠吸收,通过粪便和尿液排出,极少量通过皮肤经汗液排出[9]. 人体的钙吸收率一般为30%~80%[10]. 钙代谢平衡实验是经典的营养学研究方法[11],钙表观吸收率表示了钙元素在体内吸收利用情况,钙表观吸收率高表示摄入的钙在体内的吸收效果好,其易受性别、鼠龄、环境、饲料成分等影响. 本研究除对照组大鼠之外,其余组均给予相同的低钙饲料,含钙量为10~20 mg/kg(维持饲料含钙量为10~18 g/kg). 有研究表明钙的摄入量会影响钙表观吸收率[12],钙摄入过少会导致“钙饥饿”,导致机体最大化吸收利用钙,使钙表观吸收率显著增加,钙摄入过多则会降低钙吸收. 实验结果可以看出,低钙饲养导致大鼠钙流失严重,酶解骨粉能显著提高低钙大鼠的钙表观吸收率. 相对于模型组,低剂量酶解骨粉组大鼠的钙表观吸收率有显著的提高,钙流失大大减少,随着酶解骨粉给药剂量的提高,大鼠的钙表观吸收率上升幅度则明显减缓.
缺钙会导致骨密度和骨强度下降,严重会引起骨质疏松和佝偻症. 骨密度是骨骼强度的一个重要指标,是衡量骨质疏松程度的标准之一[13]. 良好的补钙剂能有效提高骨密度. 实验结果显示,酶解骨粉能有效提高低钙大鼠的骨密度,降低骨髓腔部分面积,恢复骨小梁致密结构. 高剂量酶解骨粉组大鼠股骨密度显著增加,与碳酸钙给药大鼠股骨密度水平相当. 骨骼中矿物质的含量是决定骨密度的因素之一,钙磷以羟磷灰钙的形式构成骨盐,其比值大约为2∶1,并处于稳定状态[14]. 从实验结果可以看出,随着酶解骨粉剂量的增加,大鼠的股骨干重和灰重有增加趋势,中剂量酶解骨粉组大鼠股骨的干灰重比的提高最为显著. 各酶解骨粉组大鼠股骨中钙、磷含量均显著升高. 骨干灰重比、骨钙和骨磷含量越高,均说明了酶解骨粉有良好的补钙效果.
酶解骨粉以新鲜牛骨为原料,利用酶水解法促进骨骼中钙的转化,使骨钙充分分离出来,含有天然生物钙、骨胶原蛋白,骨粉中钙磷比适宜(约为2∶1). 酶解骨粉中的骨钙与人体内游离氨基酸作用生成可溶性氨基酸钙,有助于钙的肠道转运和吸收. 骨胶原蛋白和钙离子形成螯合物,能进一步促进钙的利用. 此外,牛骨组成与人体骨组织相似,和人体骨细胞有较强的亲和力,或许也是酶解骨粉生物利用率较高的原因之一,但其补钙机制仍需进一步研究.

