脚桥被盖网状核在全身麻醉觉醒调控中的作用机制研究
郑 达,陈飘雨,赵 娇,刘 俊,李琼艳,袁 杰
(1.遵义医科大学 贵州省麻醉与器官保护基础研究重点实验室,贵州 遵义 563099;2.贵州省普通高等学校脑科学特色重点实验室,贵州 遵义 563099;3.遵义医科大学附属医院 疼痛科,贵州 遵义 563099)
近年研究发现,全身麻醉药导致的意识消失-恢复与自然睡眠-觉醒之间有相似之处。影像学研究显示,非快动眼睡眠(Non-rapid eye movement sleep,NREM sleep)较觉醒状态(Waking state)时脑干区(脚桥被盖网状核所在脑区)、基底前脑、丘脑、以及楔前叶和后扣带回皮质等脑区显著失活(Deactivation),这与在全身麻醉状态下观察到的大脑活动情况相似[1-3]。脑电图研究发现,丙泊酚麻醉下,下丘脑(结节乳头体核所在脑区)、前额叶皮质、楔前叶及后扣带回皮质是清醒状态时最为活跃的脑区[4]。此外,参与调控自然觉醒的功能核团几乎都参与了全身麻醉的意识恢复过程[5-8]。以上现象和研究结果提示全身麻醉药可能通过作用于睡眠-觉醒通路发挥致意识消失作用。
脚桥被盖网状核(Pedunculopontine tegmental nucleus,PPTg)是维持中枢觉醒的关键核团之一。位于脑干的PPTg是上行网状激活系统(Ascending reticular activating system,ARAS)的重要组成部分。已有报道ARAS关键核团蓝斑核参与调节丙泊酚全麻后意识恢复过程[9],而主要由胆碱能、谷氨酸能和GABA能神经元组成的PPTg是否也参调控全麻后意识恢复,目前仍不清楚[10]。PPTg发出密集的胆碱能神经纤维经腹侧通路投射至TMN、下丘脑外侧区(Lateral hypothalamic)及基底前脑(Basal forebrain)[11],通过激活这 3个核团神经元产生兴奋皮层维持觉醒的作用。此外,PPTg还可通过背侧通路直接作用于丘脑,亦可激活皮层并维持皮层兴奋性[12]。Kroeger等[11]等利用化学遗传学技术(Chemogenetic)发现,选择性激活PPTg区谷氨酸能神经元(vGluT2-Cre)可促进皮层兴奋和行为觉醒,激活胆碱能神经元(ChAT-Cre)可抑制NREM睡眠期低频脑电节律,而激活GABA能神经元(vGAT-Cre)可缩短REM睡眠持续时间。可见,PPTg区的 3组异质性神经元在维持皮层兴奋性和调控睡眠-觉醒状态过程中扮演着不同的角色。
本项目假设PPTg觉醒参与调控全身麻醉后意识恢复过程,拟通过行为学及光纤钙信号技术,探索吸入麻醉药异氟烷对PPTg核团电活动的影响,从而明确该核团影响全麻后意识恢复的神经生理学机制以及胆碱能神经元所发挥的作用。借助觉醒来研究全麻后意识恢复机制可能为解释全麻药物的作用机理提供新的线索。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SPF级健康雄性C57小鼠购自长沙市天勤生物技术有限公司,动物许可证号:SCXK(湘)2014-0011。饲养于麻醉实验室SPF级动物房,饲养环境:不限制小鼠活动、饮水、饮食,8~10周,小鼠体重在20~25 g。开灯时间/关灯时间为12 h/12 h,室温23~26 ℃,相对湿度为60%左右。
1.1.2 实验仪器 大鼠脑立体定位仪购自USA STOELTING公司;颅骨钻(FOREDOM,51449)购自瑞沃德生命科技有限公司;手术操作显微镜(PSMB5)购自WPI公司;微量注射泵(WZS-50F6)购自密斯医学仪器有限公司;小鼠麻醉诱导箱、异氟醚麻醉气体挥发罐购自瑞沃德生命科技有限公司;CED1401电生理记录仪、MODEL 3000信号放大器购自Spike 2公司;BX51W1-IR7荧光显微镜购自Olympus公司。
1.1.3 实验试剂 利多卡因注射液购自西南药业股份有限公司;水合氯醛购自成都市科龙化工试剂厂;AAV-hSyn-Gcamp6s-WPRE-pA Virus购自枢密科技;自凝型义齿基托树脂购自上海二医张江生物材料有限公司;异氟烷购自鲁南贝特制药有限公司;卡巴胆碱、美卡拉明、多聚甲醛购自Sigma公司;磷酸盐缓冲溶液(PBS)购自北京中杉金桥生物技术有限公司。
1.2 实验方法
1.2.1 光纤钙信号模型建立 选取SPF级成年雄性C57鼠16只,体重25~28 g,大鼠10%水合氯醛(0.4 mL/100 g)麻醉后固定于脑立体定位仪上,皮下注射利多卡因(2%)局麻后,手术暴露颅骨表面。确定Bregma(B)点和Lambda(λ)点位置后,进行调平,高度相差在0.02 mm以内。根据小鼠脑立体定位图谱定位PPTg区域(坐标:-4.48,±1.2,-4)并行颅骨钻孔术,连接微量注射泵与微注射针以100 nL/min速度抽取病毒AAV-hSyn-Gcamp6s-WPRE-pA (300 nL),再分别缓慢注入单侧PPTg(60 nL/min)。注射针放置10 min后缓慢地撤出,之后插入并固定光纤陶瓷插芯。术后连续3 d肌肉注射青霉素钠(8万U),待病毒转染 21 d后进行钙信号光纤记录。
1.2.2 光纤钙信号记录 该技术基于钙离子浓度变化的荧光成像技术,被广泛用来记录神经元活性,可以实时检测细胞的活性变化。钙离子浓度敏感蛋白GCaMPs通过荧光信号强度变化可以表征神经元的活性。将GCaMPs表达到神经元中,然后通过光纤激发GCaMPs的荧光并实时监测记录荧光信号强度的方法即光纤记录。
在多通道光纤钙信号记录系统中,采用480 nm激发LED和分色镜对GCaMPs的荧光信号进行采集。光纤尖端的光功率设置为20~30 μW以最小化褪色作用。对GCaMPs的荧光信号进行40 Hz滤波和500 Hz数字化处理,然后用软件进行记录。
清醒状态记录300 s后,在1.4%的异氟烷ISO的诱导箱中观察,记录翻正反射(LORR)消失时间和翻正反射恢复时间(RORR),并于RORR后300 s停止记录(见图1)。每组8只,且每组麻醉3次,间隔3 d休息时间。实验结束后处死小鼠,冰冻切片脑组织进行荧光检测,以验证病毒的表达和光纤的植入。

图1 光纤钙信号记录流程
1.2.3 光纤钙信号分析 光纤测光数据被输出到Matlab2016a进行分析。用(F-F0)/ F0表示荧光(ΔF/F) 的变化,其中F是测试荧光信号,F0是基础信号的均值和标准差。
1.2.4 微注射导管准备 选取SPF级成年雄性c57鼠16只,体重25~28 g,大鼠10%水合氯醛(0.4 mL/100 g)麻醉后固定于脑立体定位仪上,皮下注射利多卡因(2%)局麻后,手术暴露颅骨表面。确定Bregma(B)点和Lambda(λ)点位置后,进行调平,高度相差在0.02 mm以内。根据小鼠脑立体定位图谱定位PPTg区域(坐标:-4.48,±1.2,-4)并行颅骨钻孔术,植入微注射导管并固定。术后连续3 d肌肉注射青霉素钠(8万U),待组织恢复14 d后,进行微注射行为学观察。
1.2.5 给药后行为学观察记录 将微量注射泵与导管连接,按照分组分批次(1 批/ 3 d)注射生理盐水、AChRs激动剂卡巴胆碱(5 mMol/L)、N-AChR拮抗剂盐酸美卡拉明(10 μg),分别在浓度为在1.4%的异氟烷ISO的诱导箱中观察,流程如图2,记录翻正反射(LORR)消失时间和翻正反射恢复时间(RORR),间隔3 d休息时间。实验结束后处死小鼠,冰冻切片脑组织进行伊红染色,以验证导管的植入和药物的作用位置。

图2 微注射行为学记录流程

2 结果
2.1 光纤钙信号实验 观察在异氟烷麻醉诱导下调控PPTg神经元活性对全麻后意识消失和恢复时间及皮层脑电信号的影响。
2.1.1 光纤钙信号变化与翻正反射恢复及消失的记录 将注入钙信号病毒的小鼠分别逐个放入1.4%的ISO中观察记录其翻正反射消失时间(LORR)和翻正反射恢复时间(RORR)。光纤测光数据被输出到Matlab2016a进行分析。用(F-F0)/F0表示荧光(deltaF/F)的变化。结果见图3A~D。钙信号活性表达热图与LORR、RORR跟踪启动对齐的信号。每行绘制一条线索,共演示了8个试验。右侧的色度表示+F/F。△F/F表示在给予异氟烷之前,GCAMPs荧光与均值水平的变化反映核团活性表达的变化。

A、B:异氟烷麻醉下,LORR光纤钙信号活性表达热图及统计学分析;C、D: 异氟烷麻醉后恢复,RORR光纤钙信号活性表达热图及统计学分析;#: 实验分组;*: P<0.05;**:P<0.01;***:P<0.001。
结果表明,与基线相比,在异氟烷麻醉诱导下,PPTg核团活性由高到低,且时间越推移,变化越显著(b.s.vs -50~0 s,P=0.028;b.s.vs 0~100 s,P=0.000 2;-50~0 s vs 0~100 s,P=0.000 4);而异氟烷麻醉停止后,PPTg核团活性由低到高,且随时间推移,变化越显著(b.s.vs -50~0 s,P=0.013 7;b.s.vs 0~100 s,P=0.000 2;-50~0 s vs 0~100 s,P=0.002 9)。这表明PPTg核团确实参与了异氟烷麻醉诱导的全麻后意识消失与恢复,发挥一定的调控作用。
2.1.2 脑组织切片染色和验证 灌注固定取脑,光纤测定钙信号活性实验的小鼠脑组织切片并荧光染色后在荧光显微镜下观察,验证病毒的表达和光纤植入位置。图4A显示,PPTg核团处显示荧光,病毒已表达,光纤植入位置正确。微注射行为学观察实验的小鼠脑组织切片并伊红染色后在光学显微镜下观察,验证微注射位置。图4B显示,微注射痕迹位于PPTg核团区域内,微注射位置正确。
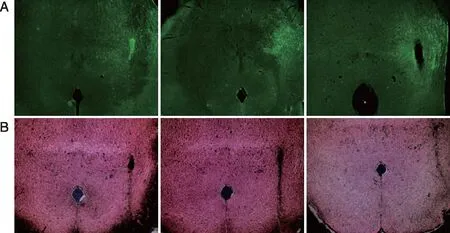
A:在小鼠PPTg处AAV-hSyn-GCaMPs病毒注射和光纤植入位置验证,放大倍数为10×4;B:小鼠PPTg处微注射位置验证,放大倍数为10×4。
2.2 行为学实验 观察激动和拮抗PPTg胆碱能神经元对全麻后LORR和RORR的影响。在小鼠PPTg微注射生理盐水、AChRs激动剂卡巴胆碱(5 mMol/L)、N-AChR拮抗剂盐酸美卡拉明(10 μg),分别在浓度为1.4%的异氟烷吸入下全身麻醉,观察并记录LORR和RORR。
结果表明:组内对照,空白组RORR时间(207.44±78.61)s和LORR时间(81.67±9.89)s,激动组RORR时间(161.66±87.59)s较LORR时间(92.11±12.6)s长,而拮抗组RORR时间(100.89±44.13)s则与LORR时间(96.33±29.49)s相差不大。经单因素方差分析,LORR时间 3组对照无统计学意义(P=0.27),但RORR时间具有统计学差异(P=0.007)。分析可知,激动胆碱能神经可缩小C57小鼠麻醉与苏醒时间的差距,拮抗胆碱能神经则将这种差距缩小得更明显。组间对照,激动组和拮抗组较空白组都延长了一定的LORR时间,而RORR时间则缩短。
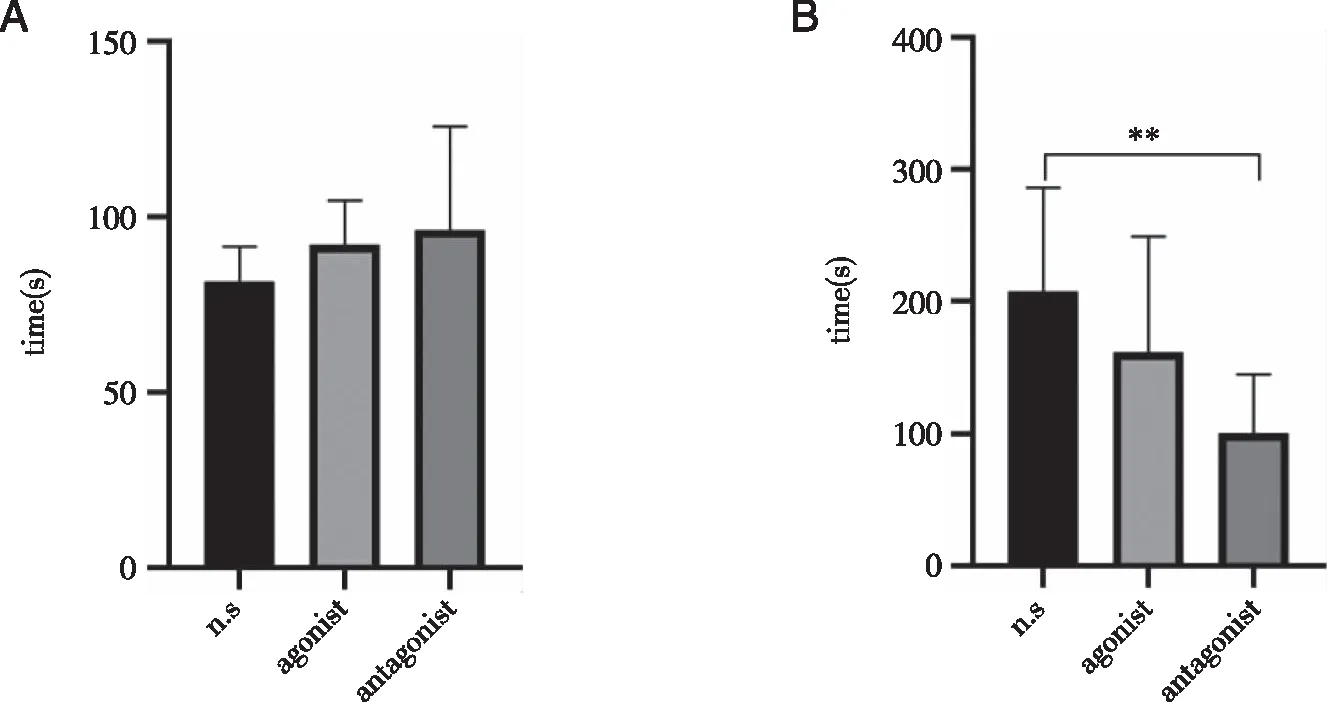
A: LORR时间,P>0.05;B: RORR时间;**: n.s vs antagonist P<0.05,n=8。
3 讨论
光纤钙信号记录实验中,小鼠在ISO的麻醉诱导条件下,出现LORR和RORR的行为学表现,通过PPTg核团位置的GCaMPs的荧光信号改变反映其神经元活性表达情况。根据实验结果钙信号活性表达热图的色条变化以及统计学差异性分析显示,在全身麻醉过程中,小鼠出现LORR时,PPTg核团的神经元的活性下降,表明PPTg核团的神经元被抑制;当小鼠出现RORR后PPTg核团的神经元的活性恢复,表明PPTg核团的神经元被激活,这提示PPTg核团的神经元可能参与了全身麻醉的调控。
微注射行为学实验中,通过微注射不同试剂对PPTg核团的胆碱能神经元功能起到促进和抑制作用。小鼠在ISO的麻醉诱导条件下,通过记录其行为学表现自身对照的时间变化,发现只有RORR过程中使用胆碱能抑制剂后与使用胆碱能激动剂后之间存在统计学差异(P=0.007),这提示PPTg核团的胆碱能神经元可能主要在全麻后意识恢复期间发挥促进意识恢复的作用,但RORR组中进行处理的结果与空白对照没有统计学差异,该结果可能由实验过程中存在的误差以及可能存在不同苏醒过程的神经通路所导致,其中Kroeger等[11]激活PPTg核团的胆碱能神经元发现可通过抑制NREM睡眠期低频脑电节律以促进苏醒。而在异氟烷麻醉诱导过程中,对小鼠LORR时间没有影响的结果提示PPTg核团的胆碱能神经元可能主要参与了异氟烷麻醉的苏醒过程,而非诱导过程,另外Zhou 等[13]实验发现,毁损大鼠VTA内的多巴胺能神经元可显著延长丙泊酚麻醉苏醒时间,但对LORR也无明显影响。本实验证明PPTg核团中胆碱能神经元参与调节了全麻后意识恢复过程的神经通路。
全身麻醉药异氟烷致意识消失期间,PPTg核团神经元活性下降,意识恢复期间活性上升。这提示了PPTg核团神经元参与全身麻醉药致意识改变的恢复过程;其中胆碱能神经元主要参与全麻苏醒并发挥促觉醒作用。PPTg核团中谷氨酸能与GABA能神经元是否参与调控全麻意识消失与觉醒,仍有待进一步研究。

