超未成熟双胎儿临床救治结局及变化分析:一项广东省多中心回顾性研究
石碧君 李颖 吴繁 冯周善 崔其亮 杨传忠 叶晓彤 戴怡蘅 梁伟怡 叶秀桢莫镜 丁璐 吴本清 陈宏香 黎炽旺 张喆 荣箫 沈薇 黄为民 杨冰岩吕峻峰 黄辉文0 霍乐颖0 饶红萍 严文康 任雪军 杨勇 王方方 刘东刁诗光 刘晓燕 孟琼 王玉 王斌 张丽娟 黄宇戈 敖当 李伟中陈洁玲 陈艳玲 李薇 陈志凤0 丁月琴0 李晓瑜 黄越芳 林霓阳蔡扬帆 韩莎莎 金雅 柳国胜 万忠和 班奕 白波 李广洪严越秀超未成熟儿与超低出生体重儿研究协作组
(1.广州医科大学附属第三医院儿科,广东广州 510150;2.广东省深圳市妇幼保健院新生儿科,广东深圳518028;3.广东省佛山市妇幼保健院新生儿科,广东佛山 528000;4.广东省妇幼保健院新生儿科,广东广州510010;5.广东省深圳市人民医院新生儿科,广东深圳 518020;6.广东省梅州市人民医院新生儿科,广东梅州 514031;7.广州市妇女儿童医疗中心新生儿科,广东广州 510120;8.南方医科大学南方医院新生儿科,广东广州 510515;9.广东省中山市博爱医院新生儿科,广东中山 528400;10.广东省珠海市妇幼保健院新生儿科,广东珠海 519001;11.广东省惠州市中心人民医院新生儿科,广东惠州 516001;12.广东省东莞市妇幼保健院新生儿科,广东东莞 523002;13.广东省江门市中心医院儿科,广东江门 529000;14.广东省粤北人民医院新生儿科,广东韶关 512026;15.广东省第二人民医院儿科,广东广州 510317;16.南方医科大学珠江医院新生儿科,广东广州 510280;17.广东医科大学附属医院儿童医学中心,广东湛江,524001;18.汕头大学医学院第二附属医院儿科,广东汕头 515041;19.暨南大学医学院附属东莞医院儿科,广东东莞 523900;20.广东省东莞市人民医院儿科,广东东莞 523000;21.中山大学附属第一医院新生儿科,广东广州 510080;22.汕头大学医学院第一附属医院新生儿科,广东汕头 515041;23.暨南大学附属第一医院新生儿科,广东广州510630;24.广东省佛山市南海区人民医院新生儿科,广东佛山 528200;25.广州市花都区人民医院新生儿科,广东广州 510800;26.广东省肇庆市第一人民医院儿科,广东肇庆 526020)
随着环境-社会因素改变、高龄孕妇增加及辅助生殖技术的广泛应用,早产儿和双胎儿的出生率逐年上升。同时,由于围生医学和新生儿监护技术的进步,早产儿尤其是极低/超低出生体重儿的救治存活率得到了明显的改善。然而超未成熟儿(extremely preterm infant,EPI)由于其出生时身体各器官发育极不成熟,生后救治难度大,并发症多、死亡率高的情况仍然较为严峻。既往研究已表明,双胎妊娠的整体死产率和新生儿死亡率比单胎分别高4倍和5~7倍[1]。在临床实践中,基于出生人群的活产双胎数据对医疗决策是至关重要的,然而目前国内外针对双胎儿存活情况的研究报道尚少且未集中于EPI[2]。为了解超未成熟双胎儿的临床救治现状和变化趋势,本研究拟对广东省26家三级甲等医院新生儿科入院的双胎EPI的临床资料进行分析,旨在分析双胎EPI的救治现状和变化趋势,为双胎EPI管理提供理论依据。
1 资料与方法
1.1 研究对象
本研究为回顾性研究,研究对象选自于广东省超未成熟儿与超低出生体重儿研究协作组数据库。入选标准:(1)胎龄<28周,同时出生体重<1 500 g的活产新生儿,且为双胎儿;(2)新生儿出生及母亲孕期资料完整者;(3)入院时间在2008年1月至2017年12月。排除标准:生后发现存在复杂型先天性心脏病[如先天性大动脉扭转、法洛四联症等,不包括动脉导管未闭(patent ductus arteriosus,PDA)和卵圆孔未闭]、遗传代谢性疾病、严重器官发育畸形等。
根据入院年份分为2组,2008年1月至2012年12月入院者为前5年组;2013年1月至2017年12月入院者为后5年组。同时,双胎中按照出生体重高低分为重婴和轻婴。
1.2 资料收集
广东省26家三级甲等医院作为协作组单位,采用统一标准对入选对象的相关资料进行调阅、整理,填写《协作组单位新生儿概况》和《广东省超未成熟儿、超低出生体重儿临床多中心研究调查表》,并对其真实性和完整性负责,详见文献[3-5]。
1.3 相关定义和诊断标准
(1)新生儿窒息及严重程度、新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome,NRDS)、支气管肺发育不良(bronchopulmonary dysphasia,BPD)、坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、PDA、早产儿视网膜病(retinopathy of prematurity,ROP)、脑室周围-脑室内出血(periventricular-intraventricular hemorrhage,P-IVH)、脑室周围白质软化(periventricular leukomalacia,PVL)与新生儿持续肺动脉高压(persistent pulmonary hypertension of newborn,PPHN)的诊断标准参照《实用新生儿学》第4版[6]。医 院 内 获 得 性 感 染(hospital-acquired infection,HAI)的诊断参照医院感染诊断标准[7],但由于生后48 h内出现的感染临床上难以确定是宫内感染还是分娩过程中发生的感染,故本研究中HAI仅限于住院48 h后发生的感染。
(2)出院标准:可自主吸吮进奶;在室温中体温稳定;至少7 d内无呼吸暂停及心动过缓发作,并已停止用药及氧疗;体重增长速度达到每天10~30 g/kg,并≥2 000 g。以上4条均达到为治愈,若有1~3条达到者则为好转,治愈出院和好转出院的存活者定义为存活。转院治疗或出院时病情均未达到出院标准者,在转院或出院后1~2个月采用电话形式回访以确定其是否存活。
(3)不良孕产史指既往出现过自然流产、人工流产/引产、异位妊娠、早产、死胎(含稽留流产)、死产、生后夭折等情形中的一种或几种;产前感染指母亲在分娩前1周内出现急性感染或慢性感染急性发作,主要包括呼吸道、生殖道(含绒毛膜羊膜炎)、泌尿系统、胃肠道等器官局部或全身性感染,不包括各类慢性病毒性肝炎(如乙型肝炎、丙型肝炎);产前使用糖皮质激素指足疗程使用,包括分娩前7 d内使用地塞米松6 mg肌内注射(每12 h 1次,连续使用4次),或倍他米松12 mg静脉滴注(12 h后重复1次,共2次)[8]。
(4)小于胎龄儿(small for gestational age,SGA)指新生儿出生体重小于同胎龄儿平均体重的第10百分位数,生长曲线参考Fenton早产儿生长曲线(2013年版)[9]。
(5)双胎出生体重差异(%)=(重婴出生体重-轻婴出生体重)/重婴出生体重×100%;以双胎出生体重差异>15%作为判断双胎儿出生体重不一致的标准[10]。
本研究经广州医科大学附属第三医院伦理委员会审查(医伦审[2017]第071号)。
1.4 统计学分析
使用SPSS 26.0统计软件进行数据处理。正态分布计量资料采用均数±标准差(±s)表示,两组间比较采用两样本t检验;偏态分布计量资料采用中位数(四分位数间距)[M(P25,P75)]表示,两组间比较采用Mann-WhitneyU检验;计数资料采用频数及率(%)表示,组间比较采用χ2检验、趋势χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 两组孕母和新生儿一般情况
26家新生儿重症监护病房在2008~2017年符合入选标准的双胎EPI 284对,排除15对(其中复杂型先天性心脏病7对,严重先天性畸形8对),余269对EPI纳入分析。其中,前5年组有60对,后5年组有209对。后5年组孕母使用辅助生殖技术比例高于前5年组,产前糖皮质激素使用率低于前5年组(P<0.05),见表1。后5年组双胎EPI重度窒息发生率、出生头围、出生身长低于前5年组(P<0.05),后5年组双胎中重婴、双胎中轻婴的重度窒息发生率、出生头围低于前5年组(P<0.05),见表2~3。
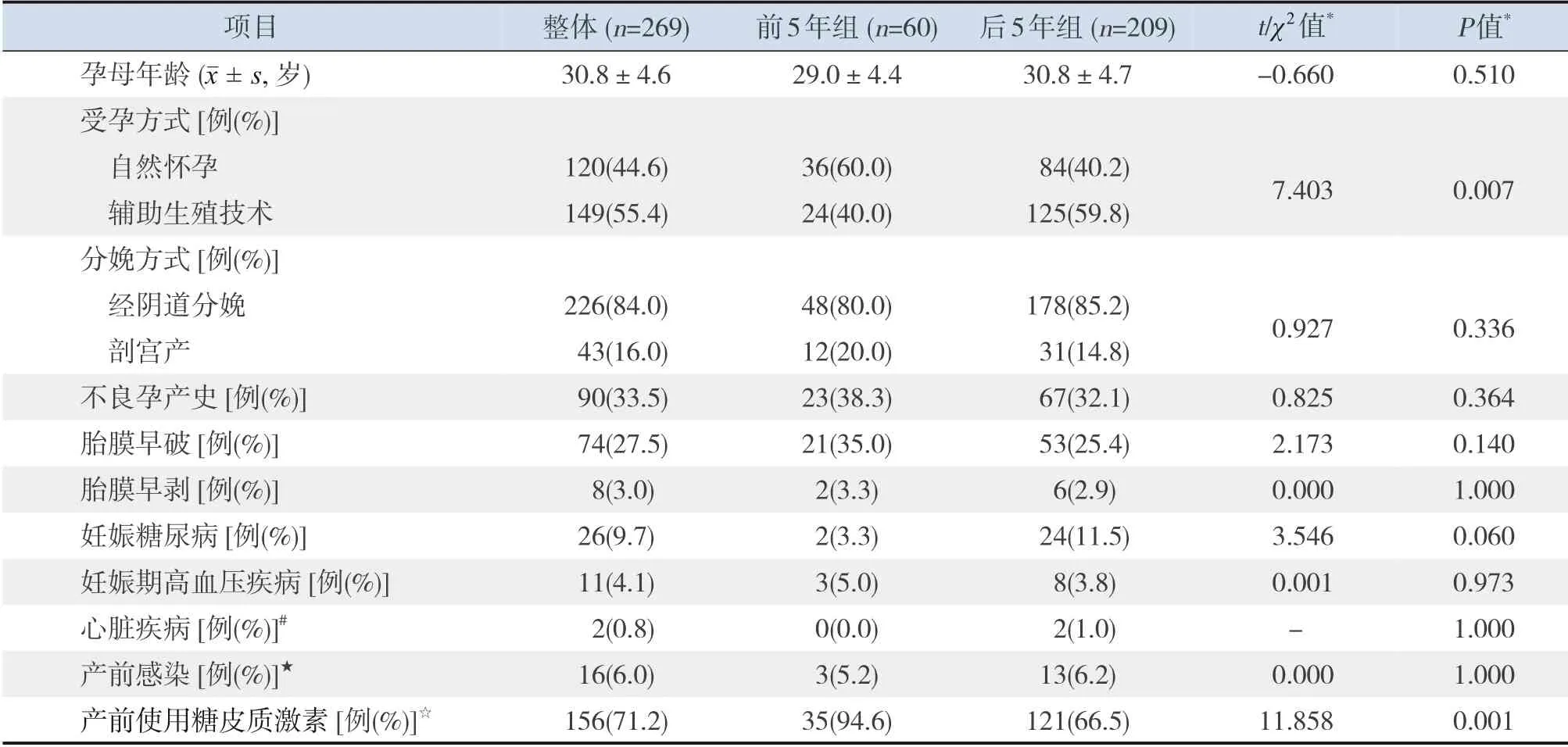
表1 两组孕母一般情况比较
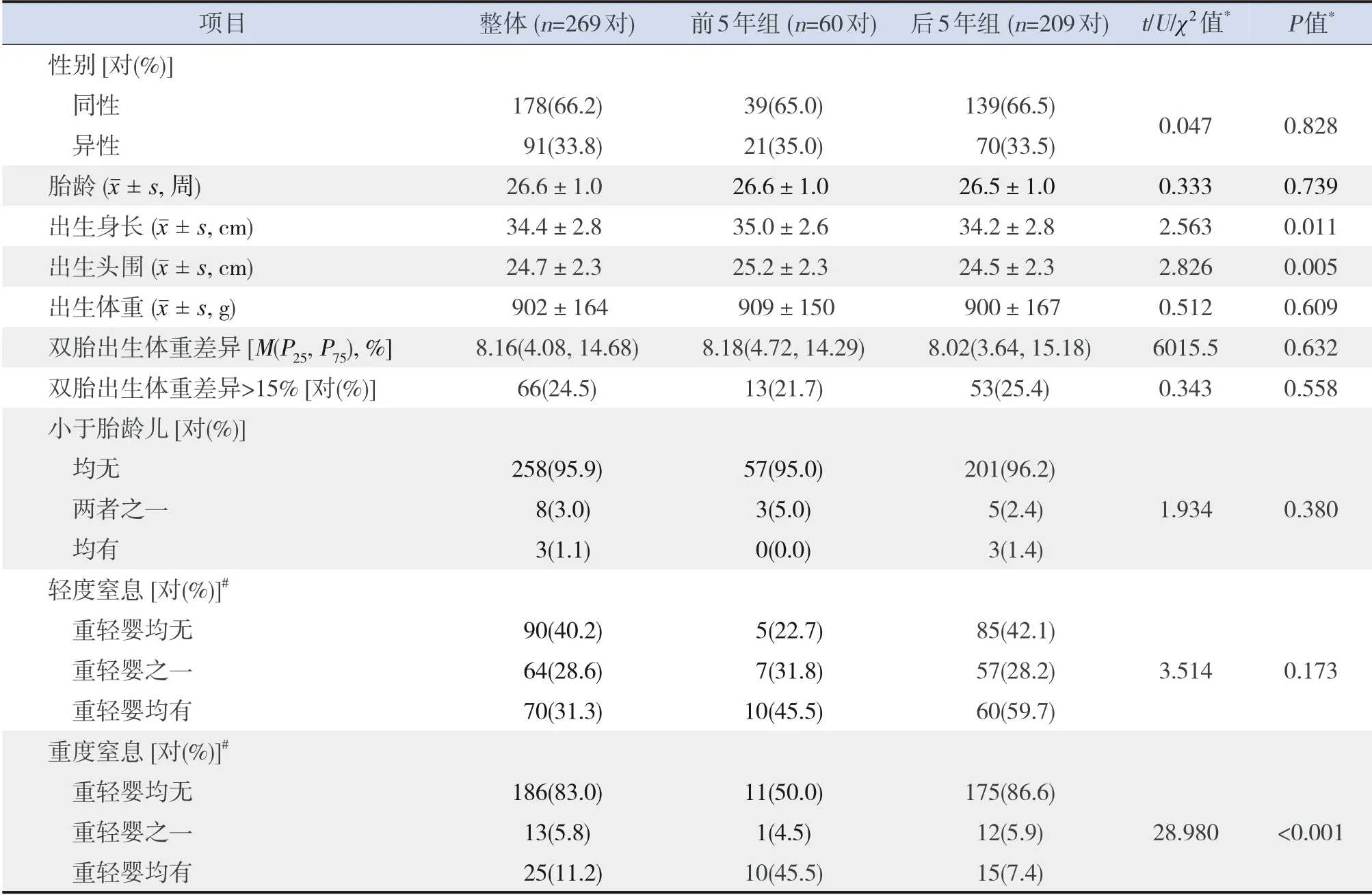
表2 两组EPI一般情况比较

表3 两组EPI重、轻婴出生情况比较
2.2 两组双胎EPI存活率比较
2008~2017年269对双胎EPI共存活265名新生儿,整体存活率为49.3%(265/538)。后5年组双胎EPI均死亡的比例低于前5年组,且双胎中重婴、双胎中轻婴后5年组病死率也低于前5年组,差异有统计学意义(P<0.05),见表4。
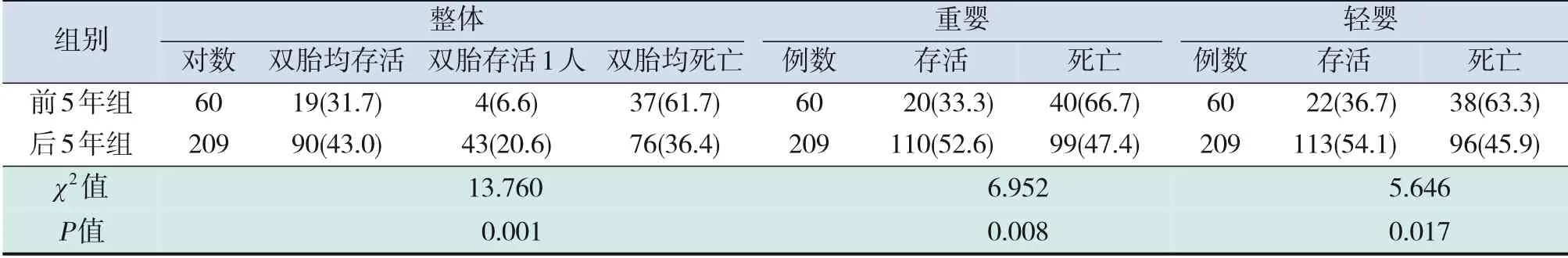
表4 两组双胎EPI存活率及比较
2.3 两组双胎EPI新生儿住院期间并发症比较
后5年组双胎中重婴NRDS、肺出血、PDA、PVL、P-IVH发生率均低于前5年组,差异有统计学意义(P<0.05);后5年组双胎中轻婴NRDS、肺出血、PDA、P-IVH发生率低于前5年组(P<0.05)。后5年组双胎中重婴、双胎中轻婴BPD发生率和住院总费用均高于前5年组(P<0.05)。见表5~6。

表5 两组重婴新生儿住院情况比较
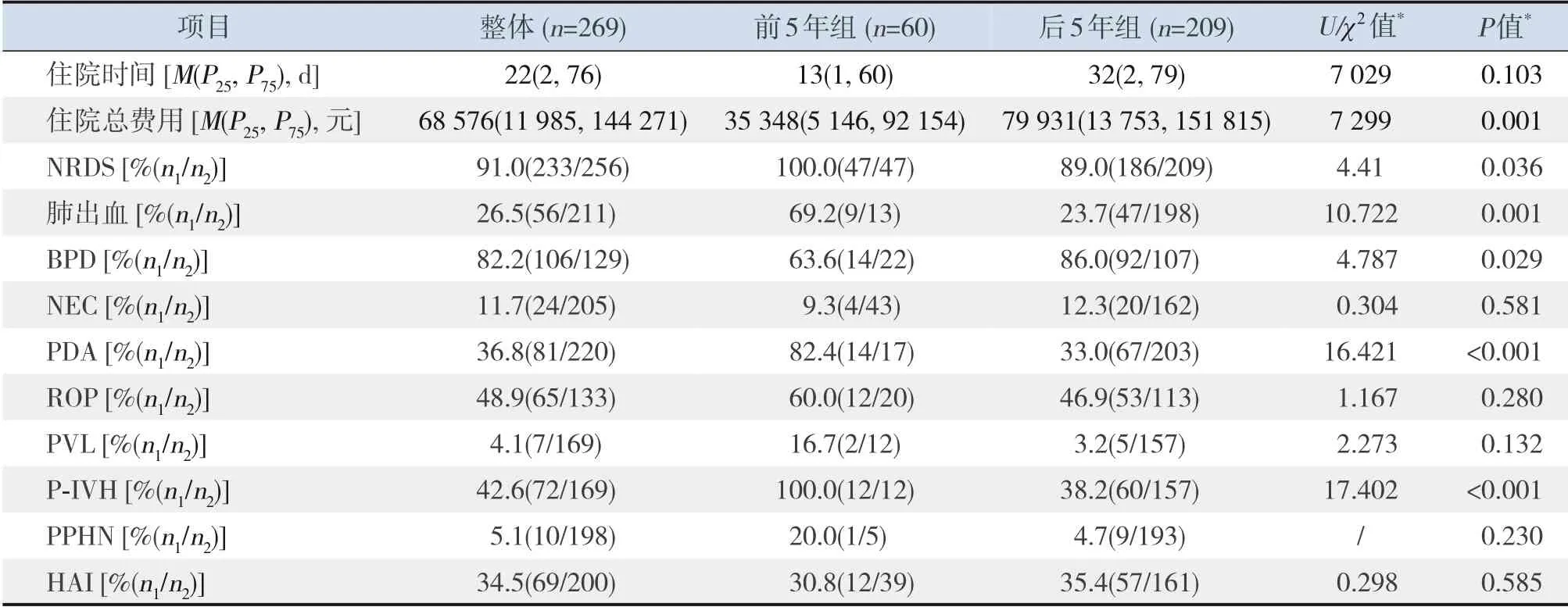
表6 两组轻婴新生儿住院情况比较
3 讨论
早产是导致婴儿死亡和发病的主要原因,而EPI是新生儿死亡的最主要构成人群。世界卫生组织将EPI定义为胎龄<28周的婴儿。在全球范围内,EPI占所有早产的5.2%,胎龄越低,死亡率越高[11]。虽然不同研究报道EPI的存活率差异较大,但据美国国立儿童健康与人类发展研究所(National Institute of Child Health and Human Development,NICHD)新生儿研究网络估计,2000~2011年间约74%EPI能在生后的住院治疗中幸存下来[10]。近年来EPI的存活率逐年上升。JAMA发表的对胎龄<27周早产儿结局的研究表明,活产婴儿1年存活率从2004~2007年的70%上升到2014~2016年的77%,无任何重大疾病的活产婴儿存活率从32%上升到38%[12]。
既往研究已表明双胎妊娠发生新生儿死亡的风险是单胎的7倍[1]。本研究双胎EPI的存活率(49.3%)低于国外文献中发表的总体人群数据[13],一定程度上与总体人群包括单双胎有关。其次,也与2007~2015年11个国家参与的协作网数据[14]中超早双胎儿86.8%的存活率相差较远,表明我国诊疗技术与国外仍存在差距。另外,近年来双胎EPI的存活率亦逐年上升。一项对2005~2013年美国双胎儿的人口学调查结果显示,在780 315例非畸形双胎活产儿中,2013年胎龄23周双胎的新生儿死亡率比2005年低12%,胎龄24周的双胎降低了14%[15]。这与本研究结果相一致,后5年组娩出的活产双胎EPI的病死率(包括死亡1个或2个)均明显低于前5年组,且重婴和轻婴的病死率均下降,提示随着年份的推移,双胎EPI的救治成功率逐渐提高。因此对此类EPI母亲的围生期管理和预后咨询,需要更加积极[16]。
“不成熟”为EPI的主要死因,同时引发一系列肺部疾病,包括NRDS和BPD。BPD的高发生率从胎龄22周婴儿的88%到胎龄28周婴儿的24%不等[11]。NEC在EPI中的发生率可高达10%[17]。除此之外,P-IVH和PVL亦是EPI的常见并发症。Payne等[18]在2006~2008年的一项研究报告显示,31%的胎龄<27周婴儿会发生P-IVH。PDA在胎龄22~28周婴儿中的发生率为32%~60%,且与P-IVH、BPD和死亡相关[11,18-20]。国内报道EPI的肺出血发生率为7%~26%[21]。美国一项针对8 515例存活时间>12 h的EPI的研究表明,早期并发症发生率为RDS 93%,ROP 59%,BPD 42%,晚期败血症36%,P-IVH 32%,NEC 11%,PVL 3%[13];另一项来自日本的研究显示,在1 057例胎龄22~25周的EPI中,并发症发生率为RDS 76.8%,BPD 33.4%,需治疗的ROP 30.1%,败血症19.6%,Ⅲ~Ⅳ度P-IVH 16.0%,PVL 4.5%,NEC 4.0%[22]。本研究显示,在2008~2017年间双胎EPI中重婴相关疾病的发生率分别为NRDS 92.2%,BPD 79.8%,ROP 47.2%,P-IVH 45.9%,PDA 35.8%,肺出血27.1%,NEC 10.0%;轻婴分别为NRDS 91.0%,ROP 48.9%,BPD 82.2%,P-IVH 42.6%,PDA 36.8%,肺出血26.5%,NEC 11.7%。各并发症发生率与2010年报道的美国数据[13]相当,略高于2013年报道的日本数据[22]。
Rysavy等[23]发现,不同研究机构间胎龄26周前娩出早产儿存活率的差异有78%归因于出生后不同的治疗和干预措施(如气管插管、机械通气)。同时,本研究中后5年组娩出的EPI无论重婴还是轻婴,其发生重度窒息、肺出血、PDA、P-IVH、BPD的比例均较前5年组明显下降,轻婴的NRDS发生率显著下降,重婴具有下降趋势,提示我们进行积极的呼吸支持、预防出血、关闭动脉导管、脑保护等治疗起到了一定的疗效。本研究结果提示广东地区三级甲等医院的EPI具有与国外相当水平的并发症发生,但存活率较低。值得注意的是,后5年组BPD发生率较前5年组明显增加。而BPD是导致1岁内婴儿死亡的重要病因,影响了超过50%的超早产婴儿[24]。因此存活率低可能与BPD发生增加有关,未来对双胎妊娠应在产前积极行胎儿监测,选择合适分娩时机[25],高危人群产前合理应用糖皮质激素促胎肺成熟[26];产后合理用氧,及时应用肺表面活性物质治疗NRDS,尽可能缩短机械通气时间,减少肺损伤导致的BPD,并注重BPD进行性发展阶段的呼吸管理[27],以期降低新生儿病死率。
本研究存在不足之处。首先,2008~2012年的双胎EPI数量较少且数据完整性欠佳,可能对统计结果造成一定影响;其次,不同研究机构间的诊疗手段仍存在差异,无法量化其对EPI预后造成的影响。另外,受到研究设计的限制,我们未对定义为好转的对象进行电话随访。因此在后续的研究中,我们将进一步延长病例采集的年限,扩大参与研究单位的数量,采用前瞻性试验设计,以期获得更多有价值的结果。
综上所述,广东省26家三级甲等医院入院的胎龄<28周超未成熟双胎儿的存活率显著上升,且双胎内无论是重婴还是轻婴,发生重度窒息、肺出血、PDA、P-IVH的比例均明显下降,而发生BPD比例增加。由此可见,随着产前诊断、产科、新生儿科等医学诊疗水平提升,新生儿不良救治结局得以改善。但针对双胎妊娠的特殊性,现有孕期管理指导仍不明确[28],迫切需要更多的孕期评估监测、常见并发症管理及多学科协作来指导临床实践。
利益冲突声明:所有作者均声明不存在利益冲突。

