芍药远缘杂交不亲和PlABCG15基因的克隆及表达分析
贺丹, 曹健康, 何松林, 张明星, 华超, 张佼蕊, 刘艺平,3
(1.河南农业大学风景园林与艺术学院,河南 郑州 450002;2.河南科技学院园艺园林学院,河南 新乡 453003;3.河南省优质花卉蔬菜种苗工程研究中心,河南 郑州 450002)
牡丹(Paeoniasuffruticosa)和芍药(Paeonialactiflora)同属于芍药科芍药属植物,其花色艳丽、品类繁多,深受人们的喜爱[1-2]。远缘杂交可以打破种属之间的界限,扩大遗传变异,是改良作物品质和创造新物种的重要手段[3-5]。牡丹、芍药远缘杂交种‘Itoh’因具有更强的抗性、观赏性,获得更多学者的关注[6-7]。但芍药属远缘杂交存在着严重的不亲和问题,这导致了其育种工作进展缓慢[8-10]。有研究表明,激素在远缘杂交不亲和中起着重要的作用[11]。在百合[12]、杨树[13]的相关研究中发现,自交亲和样本中ABA含量低于杂交不亲和样本,这表明内源激素ABA对于杂交亲和性起着重要的作用。ABC蛋白作为植物细胞膜蛋白的重要组成成分,参与植物细胞生命活动的诸多过程[14]。其中ABCG蛋白作为ABC八大家族蛋白之一,在植物的花器官发育、次生代谢产物运输、激素的运输、胚发育等方面发挥着重要的作用[15]。已有研究报道,ABCG家族基因可以调控花粉外壁形成,从而影响花粉的发育,如在拟南芥中AtABCG26、AtABCG1、AtABCG16通过影响花粉外壁形成所需物质的运输,影响花粉的育性[16-17];在水稻中OsABCG3、OsABCG11与OsABCG15亦通过影响花粉外壁的形成进而对花粉的育性产生影响[18-22]。ABCG部分家族基因可以参与细胞间ABA信号通路,控制气孔的开关,在拟南芥响应外界胁迫中起着重要作用[23-24]。河南农业大学牡丹资源与育种学课题组在前期研究中发现,芍药ABC家族基因PlABCF3在芍药属远缘杂交过程中与内源激素有着密切关系,为研究芍药属远缘杂交不亲和提供了一个新的思路。在芍药转录组基础上克隆出一个芍药ABC家族中ABCG基因,将其命名为PlABCG15,通过对该基因进行生物信息学分析、表达特性分析及亚细胞定位,以期为进一步研究PlABCG15基因的功能以及在芍药属远缘杂交不亲和中的作用奠定理论基础。
1 材料与方法
1.1 试验材料
试验所用材料均取自于河南省优质花卉蔬菜种苗工程研究中心,以芍药‘粉玉奴’为母本,牡丹‘凤丹白’为父本。根据前期研究得到不亲和的关键时期,选取‘粉玉奴’自交、‘粉玉奴’与‘凤丹白’杂交1~12、24、36 h的柱头以及‘粉玉奴’的根、茎、叶、花、芽为试验材料,将获得的材料液氮速冻后放入-80 ℃冰箱进行保存。
1.2 试验方法
1.2.1 RNA的提取与反转录 RNA提取采取改良的CTAB法[25], RNA的反转录参照HiScript®II1st Strand cDNA Synthesis Kit (+gDNA wiper)试剂盒(南京诺威赞),3次生物学重复,于-20 ℃储存备用。
1.2.2PlABCG15基因的克隆 利用软件peimer 5进行PlABCG15基因的特异性引物设计PlABCG15-F和PlABCG15-R(表1)。以cDNA为底物进行PCR扩增,反应体系20 μL:2xfast pfu master mix 10 μL,上下游引物各1 μL,cDNA1 μl,最后补充ddH2O到20 μL。反应程序为:95 ℃预变性3 min;95 ℃变性15 s,53 ℃退火30 s,72 ℃扩增延伸90 s,35个循环;72 ℃延伸15 min;12 ℃保存。PCR产物经质量分数为1%的琼脂糖凝胶电泳检测后回收。
将回收产物同Takara的pMDTM18-T进行载体连接并转化到大肠杆菌TOP10中,37 ℃倒置培养8~12 h,选取阳性菌株送生工生物工程(上海)股份有限公司进行测序。将测序正确的菌株扩大培养后提取质粒。
1.3 PlABCG15基因的生物信息学分析
通过在线网站(https://www.ncbi.nlm.nih.gov/orffinder/)对芍药PlABCG15基因的ORF区进行查询;利用在线工具推导PlABCG15蛋白理化性质、信号肽、跨膜结构、结构域及二级结构[26-27]。同源氨基酸序列比对用DNAMAN9.0;利用MEGA7.0程序,按照邻近法构建系统发育树。
1.4 PlABCG15基因的实时荧光定量
通过生工生物工程上海(股份)有限公司用PlABCG15基因的cDNA序列设计荧光定量引物,内参基因为β-Tubulin(表1)。以芍药‘粉玉奴’自交1~12 、24 、36 h的柱头cDNA、芍药‘粉玉奴’与牡丹‘凤丹白’杂交1~12 、24 、36 h的柱头cDNA以及芍药‘粉玉奴’的根、茎、叶、花、芽的cDNA为模板;操作步骤参照SYBRPremixExTaq TM试剂盒(宝日医生物技术有限公司)。反应结果采取2-ΔΔCt法计算目的基因表达量。
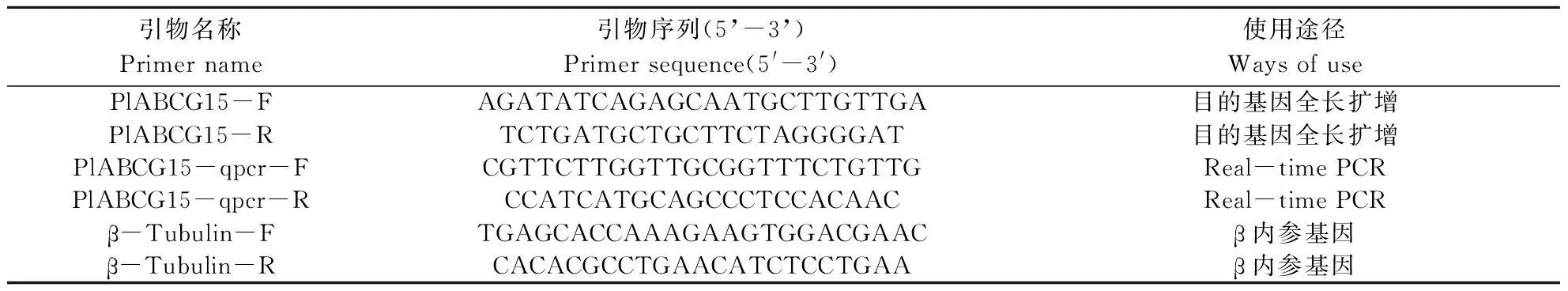
表1 PlABCG15扩增引物与荧光定量引物Table 1 Amplification primers and fluorescent quantitative primers of PlABCG15
1.5 PlABCG15基因的亚细胞定位
将获得的质粒与pcambia 2300载体质粒用QuickCut Sal Ⅰ和QuickCutKpnⅠ(Takara)进行双酶切,用ClonExpress II One Step Cloning Kit试剂盒(南京诺威赞)进行基因重组构建GFP融合表达载体。将GFP融合表达载体通过热击法转入大肠杆菌Top 10中,挑菌检测后将序列正确的菌落进行质粒提取。将获得的质粒与农杆菌GV3101按热击法进行转化,将测序正确的菌落与空载菌液加入含有50 mg·L-1Kan、50 mg·L-1Str和50 mg·L-1Rif的3种抗生素的LB液体培养基扩大培养后进行烟草叶片注射,将处理后的叶片黑暗处理24 h再正常光照培养2 d后进行亚细胞定位。
1.6 ABA激素的提取与测定
对自交柱头(1~12,24 ,36 h)及杂交柱头(1~12 ,24 ,36 h)利用酶联免疫法进行ABA含量的测定。具体的实验材料处理及操作步骤参照植物激素脱落酸(ABA)酶联免疫分析(ELISA)试剂盒(上海酶联生物)。运用 Microsoft Excel 2016 软件对数据进行统计整理制图,用 SPSS 22.0 软件进行PlABCG15基因与 ABA激素之间的相关性分析。
2 结果与分析
2.1 PlABCG15基因的克隆
以芍药‘粉玉奴’与牡丹‘凤丹白’杂交24 h柱头的cDNA为底物,获得一条1 098 bp的条带(图1)。将条带切下后送生工生物工程上海(股份)有限公司进行测序,测序结果与目的基因序列比对显示完全一致。
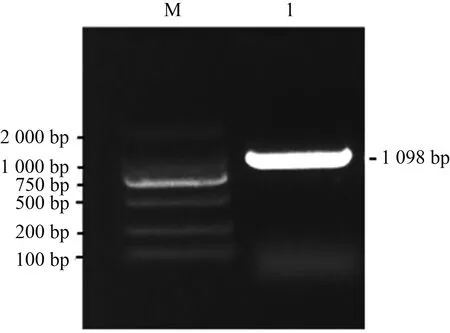
注:泳道M表示DL 2 000 Marker;泳道1表示PlABCG15基因的CDS全长。Note: Lane M represents DL 2 000 marker; Lane 1 represents the full length of CDS of the PlABCG15 gene.图1 PlABCG15的电泳图Fig.1 Electrophoretogram of PlABCG15
该基因的ORF区共编码366个氨基酸序列,通过NCBI比对发现,该基因与葡萄中的VvABCG15同源性最高,故命名为PlABCG15,GenBank登录号为MZ374449。利用NCBI中blast对芍药PlABCG15基因氨基酸比对,选取同源性较高的10种植物,利用MEGA 7.0软件进行构树。系统进化树(图2)显示,芍药与海棠分为一支。
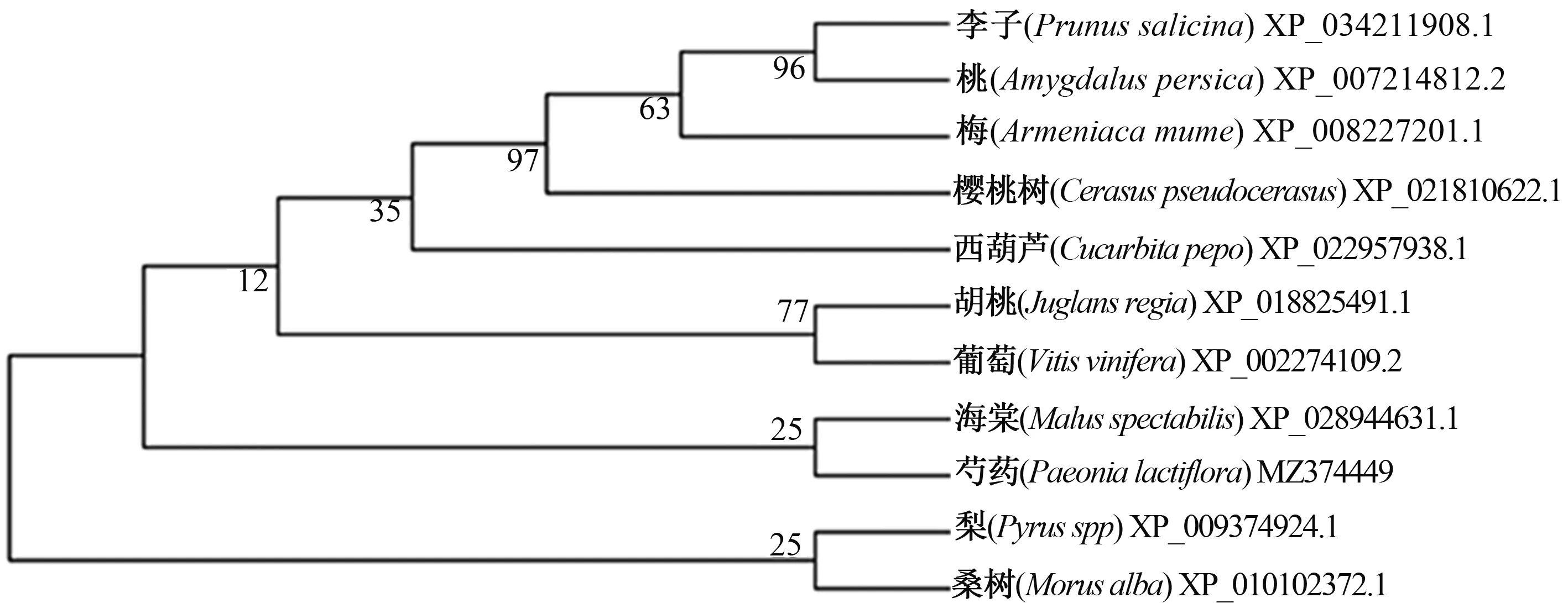
图2 PlABCG15基因的氨基酸序列与其他物种氨基酸序列比对图Fig.2 Amino acid sequence alignment of PlABCG15 with other species
从NCBI数据库中下载与PlABCG15基因氨基酸序列同源性较高的胡桃、樱桃、猕猴桃、苹果、海棠5种植物的ABCG15氨基酸序列,用DANMAN9.0进行氨基酸序列比对(图3),结果显示,其相似性为73.90%~74.79%,其中与胡桃的相似度最高。MEME在线软件共鉴定出5个相同的保守结构区域(图3)。
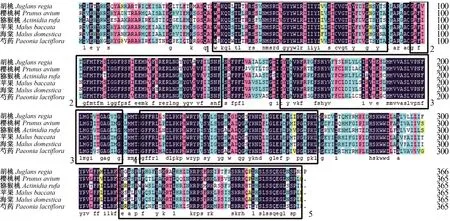
图3 PlABCG15基因的氨基酸序列与其他物种氨基酸序列比对图Fig.3 Amino acid sequence alignment of PlABCG15 gene with other species
2.2 PlABCG15基因的蛋白理化性质
通过在线工具ProtParam分析可知PlABCG15基因的理论相对分子质量约为41.4,原子总数5 849个,预测分子式C1917H2931N483O495S23,理论等电点(pI)为9.71。开放阅读框共1 098 bp,共编码366个氨基酸,其中带有负电荷氨基酸残基(Asp+Glu)总电荷为20,正电荷氨基酸残基(Arg+Lys)总电荷数39,总体呈正电荷。该蛋白的不稳定系数40.86,总亲水性平均系数0.239,由此可推测这是一个带正电荷的不稳定疏水性蛋白。TMpred显示该蛋白具有6个跨膜螺旋区,分别位于64~81,94~113,140~163,171~197,200~221,291~309位氨基酸。GOR4预测显示该蛋白的二级结构中,α-螺旋(Alpha helix)为21.64%,延伸链(Extended strand)为31.23%,不规则卷曲(Random coil)为47.12%(图4-a)。CD-search结果显示,PlABCG15蛋白含有1个功能结构域,为在47~252位氨基酸残基组成的ABC2功能结构域(图4-b)。
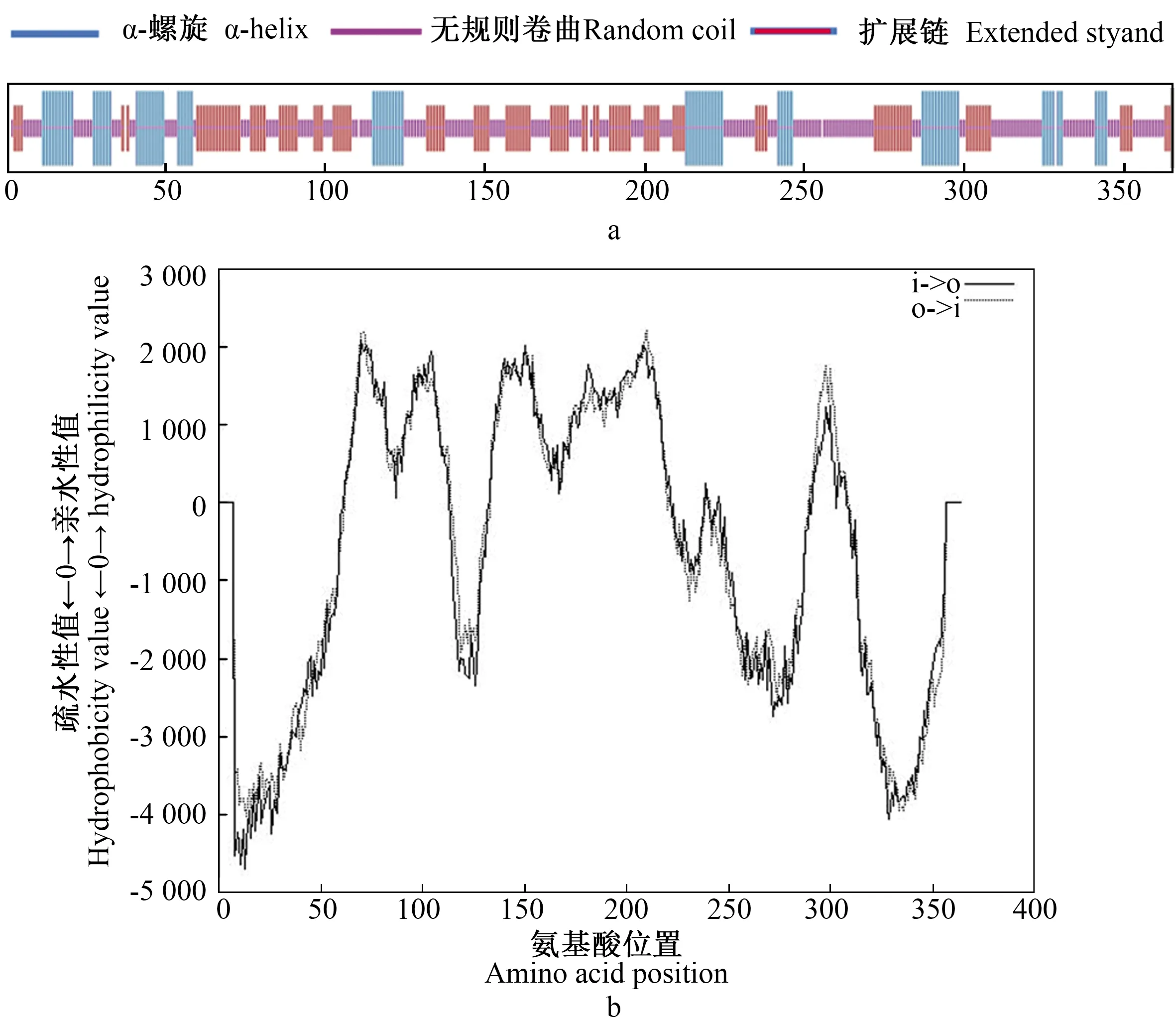
注:a:PlABCG15蛋白的二级结构预测;b:PlABCG15蛋白的跨膜区域预测。Note: a:secondary structure prediction of PlABCG15 protein; b:Transmembrane region prediction of PlABCG15 protein.图4 芍药PlABCG15蛋白氨基酸序列的结构预测Fig.4 Structural prediction of amino acid sequence of herbaceous peony PlABCG15 protein
2.3 PlABCG15基因的实时荧光定量与激素测定
不同部位的荧光定量结果显示,PlABCG15基因在茎中的表达量达到最高,在根、花、叶中表达量较低(图5)。不同自、杂交时期的实时荧光定量结果显示,自交时期的基因表达量高于杂交时期,均呈整体上升趋势(图6)。在自交柱头中,自交1~8 h基因表达量持续上升,8~12 h表达量上升幅度较小,在36 h表达量达到最大。在杂交柱头中,1~3 h基因表达水平较低,4 h表达量增加后随即降低,5~12 h表达水平相持,在36 h表达量达到最大。自交与杂交柱头在授粉后24 h后基因的表达量均出现了明显的变化,且自交柱头的变化量远高于杂交柱头。自交、杂交不同时期的柱头中ABA含量如图7所示,自交柱头中ABA含量在4 h达到最高,在2、7、9、24、36 h含量相持且最低,其余时期含量相持且较高;杂交柱头中在12 h含量最高,前7个时期含量持续下降(6 h上升),8 h上升后随即下降,直到12 h含量上升并达到最高,随后ABA含量逐渐下降并在36 h达到最低。在同一时期的柱头中,将同一处理柱头的PlABCG15基因表达量与ABA含量数据导入SPSS 22.0,采用Bivariate correlations方法进行相关性分析,结果显示,杂交柱头中两者呈显著负相关关系,其Pearson相关系数为-0.474(P<0.01);自交柱头中两者亦呈显著负相关关系,其Pearson相关系数为-0.155(P<0.01)。
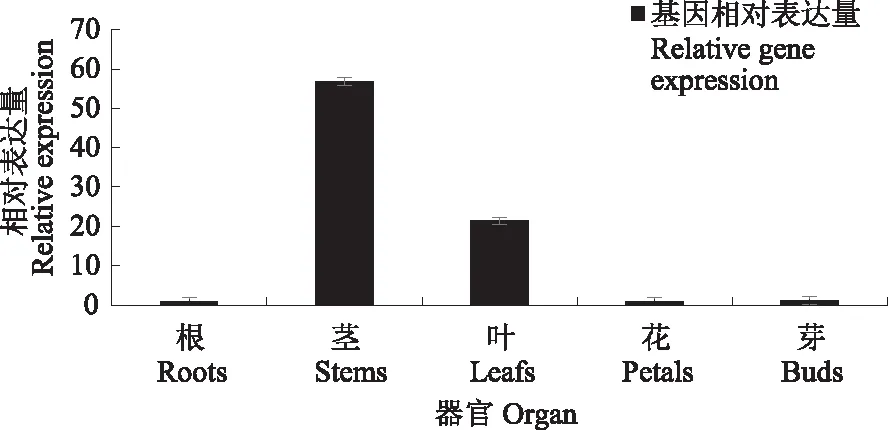
图5 芍药‘粉玉奴’不同部位中ABA含量与PlABCG15基因的表达分析Fig.5 Analysis of ABA content and expression of PlABCG15 gene in different parts of Paeonia lactiflora ‘fenyunu’
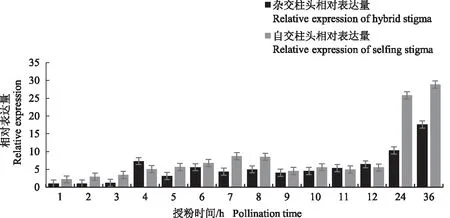
图6 自交、杂交不同时期柱头中PlABCG15基因的表达分析Fig.6 Expression analysis of PlABCG15 gene in stigma at different stages of inbreeding and hybridizations
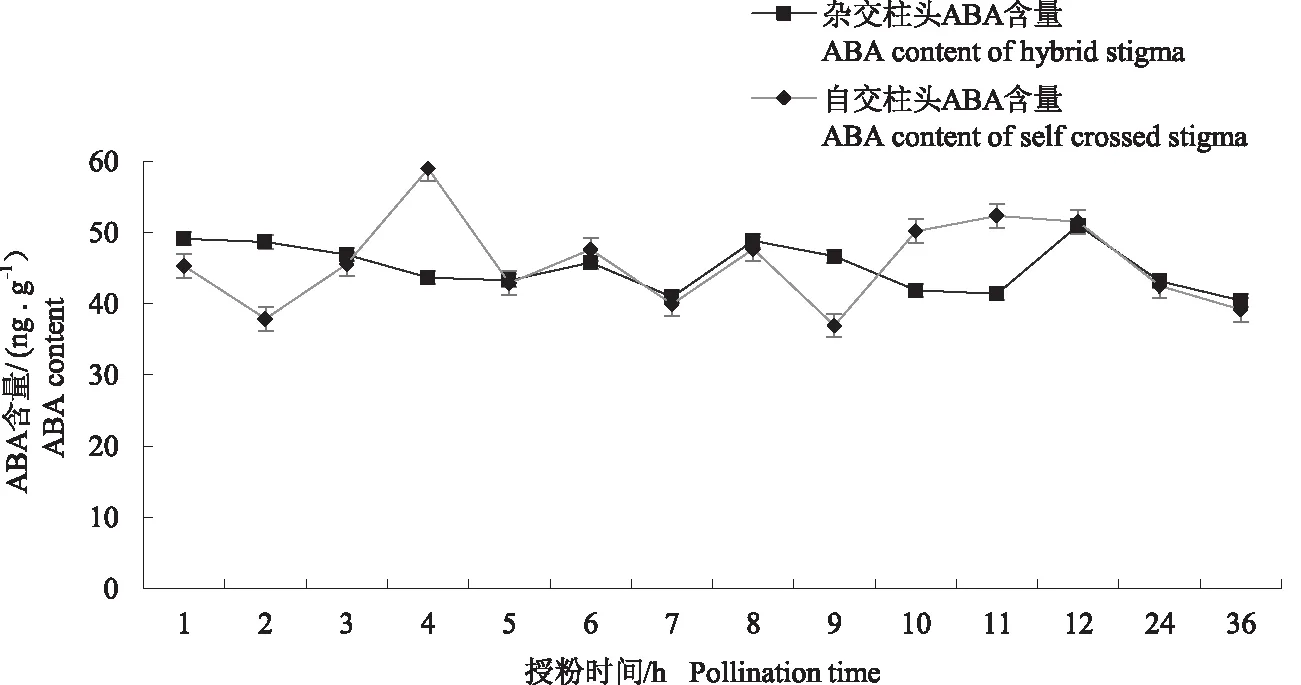
图7 自交、杂交不同时期柱头中ABA含量分析Fig.7 Analysis of ABA content in stigma at different stages of inbreeding and hybridization
2.4 PlABCG15基因的亚细胞定位
将过表达载体注射进入烟草叶片细胞中后,制作切片在共聚焦显微镜下观察荧光信号。结果显示,空载体定位在细胞膜上(图8),GFP融合表达载体定位与细胞的质膜上。
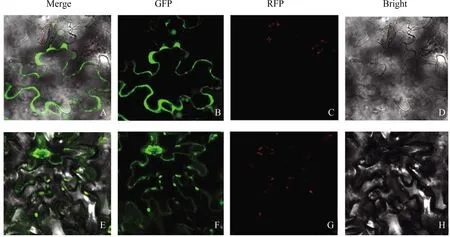
注:All、GFP、RFP、Bright分别表示红色荧光和白光和绿色荧光叠加、绿色荧光、红色荧光、白光D表示GFP融合蛋白在不同视野下的定位结果,比例尺为20 μm;E-H表示空载在不同视野下的定位结果,比例尺为50 μm。Note: All, GFP, RFP and Bright represents red fluorescence(RFP), white light and green fluorescence(GFP) superposition, green fluorescence(GFP), red fluorescence (RFP)and white light, respectively D showed the localization results of GFP fusion protein in different visual fields, with a scale of 20 μm; E-H refers to the positioning results of no-load in different fields of vision, with a scale of 50 μm.图8 PlABCG15蛋白在烟草叶片中的亚细胞定位Fig.8 Subcellular localization of PlABCG15 protein in tobacco leaves
3 结论与讨论
本研究从芍药‘粉玉奴’与牡丹‘凤丹白’杂交24 h柱头中克隆出一个1 098 bp的ABCG家族基因,命名为PlABCG15(GenBank登录号:MZ374449),该基因共编码366个氨基酸。生物学信息分析显示PlABCG15的氨基酸序列与葡萄的VvABCG15氨基酸序列相似度最高,推测芍药PlABCG15蛋白在次生代谢产物及激素的运输方面扮演着重要角色[28]。qRT-PCR结果显示,PlABCG15基因在芍药‘粉玉奴’的根、茎、花、叶、芽中均有表达,在茎中表达量最高,这表明PlABCG15具有组成型表达的特点。
研究表明,ABCG基因与花粉的生长发育相关,水稻的OoABCG3与OoABCG15基因通过影响水稻花粉壁与绒毡层的形成,从而导致花粉失去活力,育性降低[19,21]。在拟南芥花粉壁形成的研究中发现,AtABCG1与AtABCG16基因主要是通过将花粉壁形成所需要的物质提前从绒毡层细胞运输到花药室来影响花粉壁的形成[18]。河南农业大学牡丹资源与育种课题组在前期研究中发现,杂交后24 h与36 h为不亲和的关键时期[29],在本研究中,PlABCG15基因在24、36 h时自交柱头中的相对表达水平显著高于杂交柱头,因此推测PlABCG15可能通过影响花粉外壁形成和花粉发育来调控其远缘杂交不亲和性。ABA在植物的远缘杂交中扮演着重要角色,ABA的产生与运输由相关基因调控,ABCG家族中部分基因对ABA的运输起着重要作用[30]。在杨树[13]、虞美人[31]、南方枣[32]、鸭梨[33]、苹果[34]的相关研究中发现,高含量的ABA对花粉识别、花粉萌发及花粉管的伸长起到了抑制作用。本研究中发现,杂交柱头中ABA含量高于自交(除4、6、10、11 h外),尤其在授粉后2 h,杂交柱头ABA含量显著高于自交柱头。在之前的研究中观察到授粉后2 h杂交柱头上的花粉萌发较少,因此推测可能是由于高含量的ABA抑制了柱头上花粉萌发,最终影响了远缘杂交的亲和性。通过相关性分析发现,自交与杂交不同时期柱头ABA含量与PlABCG15基因的相对表达量呈显著负相关关系,这一结果与张鹏[13]、朱玮[31]等的研究结果一致,因此推测,PlABCG15基因可能通过对ABA的负调控来影响花粉的发育,进而影响了远缘杂交不亲和性。亚细胞定位显示,PlABCG15编码蛋白定位在质膜上,推测PlABCG15基因具有转运功能,为进一步验证PlABCG15基因在转运激素方面的作用奠定基础。

