添加氯化钾和蛋黄对虹鳟精液冷冻保存的效果
张俊杰 王彦博
摘 要:为筛选出更有效的虹鳟(Oncorhynchus mykiss)精液冷冻保存液,在以10%甲醇和0.3 M葡萄糖作为主要成分的基础上,分别或同时添加0.9 g/L氯化钾和10%蛋黄形成四种冷冻保存液,用于虹鳟精液冷冻保存试验,分别形成4个处理组:Ⅰ#(不添加氯化钾和蛋黄)、Ⅱ#(添加氯化钾)、Ⅲ#(添加蛋黄)和Ⅳ#(添加氯化钾和蛋黄),比较不同处理组冻精精子激活比例、存活时间和精子活率。结果表明,Ⅰ#组的精子活率最高,达到24.59%,但与其它三组相比没有显著性差异;该组冻精的激活比例最高(24.00%±9.67%),显著高于Ⅲ#和Ⅳ#组,但与Ⅱ#组无显著性差异。Ⅳ#组冻精的精子平均存活时间最长,达80.3 s。由此推测,添加氯化钾或蛋黄都降低了虹鳟冻精的精子激活比例和精子活率,而添加氯化钾可在一定程度上提高精子存活时间。总之,分别或同时添加氯化钾和蛋黄可能会降低虹鳟精液冷冻保存效果,推荐使用不添加氯化钾和蛋黄的Ⅰ#冷冻保存液用于虹鳟精液的冷冻保存。
关键词:虹鳟(Oncorhynchus mykiss);冷冻保存;精液;氯化钾;蛋黄;激活比例
虹鳟(Oncorhynchus mykiss)属鲑形目(Salmoniformes),鲑科(Salmonidae),鲑属(Salmo),原产于北美洲太平洋沿岸的淡水水域。虹鳟肉质细嫩,营养丰富,生长迅速,是优良的世界性冷水性养殖鱼类,在流水养殖下产量很高,也是新疆目前养殖面积和产量最高的冷水鱼养殖品种。我国1959年从朝鲜引进发眼卵进行人工养殖,1982年引入新疆进行人工养殖[1-2]。由于虹鳟在全世界的广泛养殖,其育种和保种工作就显得尤为重要,精液冷冻保存技术为虹鳟的育种繁殖和种质保存工作带来了很多益处。
鱼类精液冷冻保存技术研究开始于1953年,Blaxter[3]用干冰(-79℃) 将大西洋鲱精巢保存6个月后解冻,获得了80%的受精率。从1960年Terao開始冷冻虹鳟鱼精液以后,虹鳟鱼精液冷冻保存研究,包括冷冻保护液的配置、冷冻的方法等方面,已经进行了很多工作,并取得显著的进步,其中冷冻保护液配制已经从复杂逐渐简化,抗冻剂也由原来以二甲亚砜为主,转变成甲醇为主[4-6]。如Hisashi等[4]用由NaCl、KCl、盐酸氨甲基丙二醇和血清白蛋白组成的,并用二甲亚砜(7.5%的终浓度)作为抗冻剂,其冻精可以获得最高41%的受精率。而Lahnsteiner等[5]用由NaCl、KCl、CaCl2、MgSO4和Hepes(4-羟乙基哌嗪乙磺酸)组成的基础稀释液,用10%甲醇作为抗冻剂,获得最高89.2%的受精率。Ciereszko等[6]用由0.18 M葡萄糖和9%甲醇组成的冷冻保护液,获得的虹鳟鱼冻精受精率大于80%。但是K+作为鲑科鱼类重要的精子抑制剂[7],蛋黄曾经作为重要非渗透性抗冻剂[8],它们对虹鳟精液冷冻保存效果的影响一直未见报道。
本研究在以10%甲醇和0.3 M葡萄糖作为主要成分的基础上,分别或者同时添加氯化钾和蛋黄形成四种冷冻保存液,研究了它们对虹鳟冻精精子激活比例、存活时间和精子活率的影响,进而探讨蛋黄和K+对虹鳟精液冷冻保存效果的影响,为虹鳟生产应用和种质保存服务。
1 材料与方法
1.1 试验材料
1.1.1 亲鱼的选择 试验所用虹鳟亲鱼为北园春市场出售的人工养殖虹鳟,挑选身体健康且发育成熟的雄鱼。
1.1.2 试验环境 试验场所选择在新疆农业大学冷水性鱼类实验室,试验水温为5 ℃,养殖场所光线比较暗,同时采取必要的避光措施,尽量避免光线对精子的杀伤,减少试验结果的误差。
1.2 试验方法
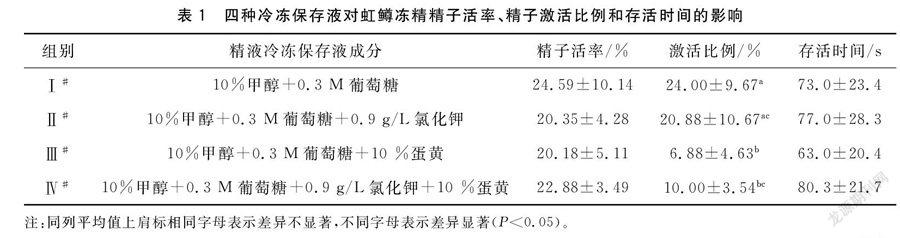
1.2.1 精液稀释液的配制 参考Ciereszko[6]和Zhang等[9]的研究结果,以10%的甲醇(MeOH)作为冷冻保护剂,以0.3 M的葡萄糖作为基础溶液的主要成分,再分别或者同时添加10%蛋黄、0.9 g/L的KCl,配制出四种不同的虹鳟精液冷冻保存液,分别用于虹鳟精液冷冻保存试验,形成4个不同的处理组(见表1)。
1.2.2 精液的采集 虹鳟精液采集的方法:采精前先把雄鱼体表的水用干毛巾擦干,然后在精巢位置用手进行挤压,将精巢内的精液挤入干燥小烧杯中,置于冰盒内,避光储存,整个过程要防止精液接触水分。采精后在显微镜下进行精子浓度和活力的检查,将合格的精液混匀备用。
1.2.3 精液的冷冻保存 分别将四种已预冷的冷冻保存液与精液以3∶1的比例混合,并迅速分装到0.25 mL的麦管中,每种冷冻保存液装20~35支,用熨斗封口,形成4个处理组(Ⅰ#—Ⅳ#),随后将麦管水平放置在距液氮表面2 cm处,经过5 min的降温后,迅速投入液氮中,然后装入相应的袋子中,保存在液氮罐内。
1.2.4 伊红染色检测精子活率 精子活率的检测参考周佳勃等[10]的方法进行。用激活液(100 mM NaCl,pH=9)将冻精200倍稀释混匀后,迅速取20 μL精子悬液与等量伊红染液(0.5%)在载玻片上混匀并加盖盖玻片,1 min后在400倍显微镜下观察并记录一个视野内的着色精子和未着色精子(一个样品至少计数150个精子),并按以下公式计算相对精子活率:
精子活率(%)= 未着色精子数/精子总数×100。
1.2.5 检测精子激活比例和存活时间 将装有冻精的麦管从液氮罐里取出,迅速放入25 ℃水浴中进行解冻,10 s后迅速取出,剪断麦管取出中部的精液涂到载玻片上,用激活液激活,用显微镜录像技术观察并记录精子激活比例(解冻的精子经过激活后活动的精子数占总精子数的比例)和精子存活时间(解冻的精子经过激活后95%精子停止运动所经历的时间)。
1.3 数据分析
用SPSS16.0软件对数据进行统计分析,数据用平均值±标准差表示,均数的比较采用One-Way ANOVA分析法,P>0.05为差异不显著。
2 结果与分析
2.1 四种冷冻保存液对虹鳟冻精精子活率的影响
四种冷冻保存液获得的虹鳟冻精精子活率分别为24.59%、20.53%、20.18%、22.88%,其中以Ⅰ#冷冻保存液获得的冻精的精子活率最高,但与其它三组都未达到显著性差异水平,见表1。这一结果说明,在以10%甲醇和0.3 M葡萄糖为主要成分的基础上,无论分别还是同时添加氯化钾和蛋黄,都降低了虹鳟冻精的精子活率。
2.2 四种冷冻保存液对虹鳟冻精精子激活比例的影响
四种冷冻保存液获得的虹鳟冻精精子激活比例整体上都不是很高,其中Ⅰ#冷冻保存液激活比例最高,为24.00%±9.67%,显著高于Ⅲ#和Ⅳ#冷冻保存液,但与Ⅱ#冷冻保存液无显著性差异。Ⅱ#、Ⅲ#和Ⅳ#冷冻保存液激活比例分别为20.88%±10.67%、6.88%±4.63%、10.00%±3.54%。Ⅱ#冷冻保存液显著高于Ⅲ#冷冻保存液,与Ⅳ#冷冻保存液无显著性差异,Ⅲ#与Ⅳ#冷冻保存液之间也无显著性差异。见表1。从这些结果可以看出,在以10%甲醇和0.3 M葡萄糖为主要成分的基础上,无论是添加氯化钾,还是添加蛋黄,都降低了虹鳟冻精精子的激活比例,尤其是添加蛋黄的Ⅲ#和Ⅳ#冷冻保存液降低效应尤为显著。
2.3 四种冷冻保存液对虹鳟冻精精子存活时间的影响
四种冷冻保存液获得的虹鳟冻精精子存活时间分别介于63~80.3 s之间,添加氯化钾的Ⅱ#和Ⅳ#冷冻保存液分别提高了虹鳟冻精精子存活时间,其中以同时添加氯化钾和蛋黄形成的Ⅳ#冷冻保存液最高,只添加了蛋黄的Ⅲ#冷冻保存液精子存活时间最低,但各组之间的差异都没有达到显著性水平。见表1。
3 讨论
淡水鱼精子产出前在精浆中保持静止状态,K+是淡水鱼类精浆的重要组成成分之一,也是构成精浆渗透压的主要物質和淡水鱼类精子激活的主要抑制因子[11]。在鲑鱼中,细胞外K+浓度的降低触发了鞭毛运动的启动[12],所以在进行鲑科鱼类精液冷冻保存液的筛选时,K+是一个重要的考虑成分,但是很多研究并没有得到确定积极的结果。Judycka等[13]研究发现,在海藻糖作为主要成分的基础上,添加40 mM KCl,可使虹鳟鱼冻精获得更高比例活细胞,延长解冻后的储存时间,但是对受精率没有明显影响。Judycka等[14]进一步研究发现在以0.18 M葡萄糖和9%甲醇为主要成分的冷冻保护液基础上,添加K+对四种鲑鱼冻精的精子活力有负面影响,并可通过提高冷冻保护液的渗透压,降低这种负面影响,证明渗透压而不是钾离子,是鲑鱼精子冷冻保存成功的最重要因素。本研究为防止精液在与精液冷冻保存液混合过程中被激活,在10%甲醇和0.3 M葡萄糖的基础上添加0.9 g/L KCl,希望通过0.3 M葡萄糖提供足量渗透压的同时,添加KCl进一步抑制精子的激活。试验结果证明添加KCl降低了虹鳟冻精精子的激活比例和精子活率,但在一定程度上提高了精子存活时间。从这个结果可以看出,K+对冻精激活的抑制作用可能与其添加浓度过高有关,导致其稀释激活时,K+可能仍然发挥着一定的抑制作用,这个情况有待进一步研究探讨。
在哺乳动物精子冷冻保存研究中,卵黄可改善精子解冻后的运动能力,因为低密度脂蛋白组分(LDL)与细胞膜结合,并在冷冻保存过程中提供保护,防止损伤[15]。据报道,用卵黄覆盖精子细胞膜,可以减少冷冻过程中细胞膜的溶解[16]。在许多低温冷冻保存试验中,将蛋黄作为添加到精液稀释液中的一个添加成分或者作为低温保护剂加以研究,但Jodun等[8]研究发现补充蛋黄的有益效果似乎具有物种特异性和特定于冷冻保护液配方,在葡萄糖、KCl和甲醇组成的冷冻保护液中添加蛋黄可提高大西洋鲑冻精受精率,对精子提供额外保护,但在葡萄糖、KCl和二甲基亚砜组成的冷冻保护液中添加蛋黄则使冻精受精率下降。Lahnsteiner等[17]在由NaCl、KCl、CaCl2、MgSO4和Hepes组成的基础稀释液和以二甲基亚砜、甘油、蔗糖和牛血清白蛋白作为抗冻剂的基础上,添加蛋黄显著提高了虹鳟冻精的激活比例。本研究为探讨补充蛋黄对虹鳟冻精是否有益,在以10%甲醇和0.3 M葡萄糖为主要成分的基础上,添加10%蛋黄却降低了虹鳟冻精精子的激活比例和精子活率。这进一步说明评估外部低温保护剂时需要针对每一个物种,并要考虑特定的配方组合。
参考文献:
[1]
郭焱.新疆鱼类志[M].乌鲁木齐:新疆科学技术出版社,2012:35-37.
[2] 孟庆闻.鱼类分类学[M].北京:中国农业出版社,1995:309-331.
[3] BLAXTER J H S.Sperm storage and cross-fertilization of spring and autumn spawning herring[J].Nature,1953,172:1189-1190.
[4] HISASHI K,REIJIRO S.Cryopreservation of Rainbow trout sperm[J].Bulletin of the Japanese Society of Scientific Fisheries,1980,46(12):1493-1495.
[5] LAHNSTEINER F,WEISMANN T,PATZNER R A.Methanol as cryoprotectant and the suitability of 1.2 ml and 5 ml straws for cryopreservation of semen from salmonid fishes[J].Aquaculture Research,1997,28(6):471-479.
[6] CIERESZKO A,DIETRICH G J,NYNCA J,et al.Cryopreservation of rainbow trout semen using a glucose-methanol extender[J].Aquaculture,2014,420:275-281.
[7] ZUCCARELLI M D,JENSEN N,INGERMANN R L.Inhibitory effect of osmotic concentration,potassium and pH on motility of the sperm of the North American burbot Lota lota maculosa[J].Journal of Fish Biology,2007,70:178-189.
[8] JODUN W A,KING K,FARRELL P,et al.Methanol and egg yolk as cryoprotectants for Atlantic salmon spermatozoa[J].North American Journal of Aquaculture,2007,69(1):36-40.
[9] ZHANG J J,LI S Z,TULAKE K,et al.The effects of extenders and sperm-egg ratios on fertilizing ability of cryopreserved testicular sperm of northern pike(Esox lucius L.)[J].Journal of Applied Ichthyology,2011,27:1037-1040.
[10] 周佳勃,岳順利,朱赫,等.解冻速度对马鹿精子参数的影响[J].黑龙江畜牧兽医,2008(8):96-97.
[11] 陈松林.鱼类精子和胚胎冷冻保存理论与技术[M].北京:中国农业出版社,2007:3-48.
[12] MORITA M,FUJINOKI M,OKUNO M.K+-independent initiation of motility in chum salmon sperm treated with an organic alcohol,glycerol[J].The Journal of Experimental Biology,2005,208(23):4549-4556.
[13] JUDYCKA S,CEJKO B I,DRYL K,et al.The effect of supplementation of a trehalose-based extender with KCl on rainbow trout(Oncorhynchus mykiss) sperm freezability and post-thaw motility[J].Aquaculture,2016,465:303-310.
[14] JUDYCKA S,NYNCA J,LISZEWSKA E,et al.Potassium ions in extender differentially influence the post-thaw sperm motility of salmonid fish[J].Cryobiology,2016,73(2): 248-256.
[15] POLGE C.Freezing of spermatozoa[M]// ASHWOOD-SMITH M J,FARRANT J.Low temperature preservation in medicine and biology.Turnbridge Wells:Pitman Medical,1980:45-64.
[16] SCOTT A P,BAYNES S M.A review of the biology,handling and storage of salmonid spermatozoa[J].Journal Fish Biology,1980,17(6):707-739.
[17] LAHNSTEINER L F,BERGER B,WEISMANN T,et al.The influence of various cryoprotectants on semen quality of the rainbow trout(Oncorhynchus mykiss) before and after cryopreservation[J].Journal of Applied Ichthyology,1996,12(2):99-106.
Effect of potassium chloride and egg yolk on cryopreservation of rainbow trout semen
ZHANG Junjie,WANG Yanbo
(College of life sciences,Xinjiang Agricultural University,Urumqi,830052,China)
Abstract:In order to screen out a more effective rainbow trout (Oncorhynchus mykiss) semen cryopreservation solution, on the basis of 10% methanol and 0.3 M glucose as the main components, 0.9 g/L potassium chloride and 10% egg yolk were added respectively or simultaneously to form four cryopreservation solutions for rainbow trout semen cryopreservation test. Four treatment groups were formed respectively: I #(no potassium chloride or egg yolk),II #(adding potassium chloride), Ⅲ# (adding egg yolk) and Ⅳ# (adding potassium chloride and egg yolk). The sperm activation ratio, survival time and sperm viability of rainbow trout frozen sperm among the groups were compared. The results showed that the sperm viability of frozen semen in group I# was the highest, which was 24.59%, however, no significant difference was found compared with those of the other three groups, and the activation ratio of frozen semen of this group was also the highest (24.00% ± 9.67%), which was significantly higher than those of group Ⅲ# and Ⅳ#, but no significant difference with that of groupⅡ#.The average survival time of frozen sperm in group Ⅳ# was the longest, which was 80.3 s. Therefore, it is speculated that the addition of potassium chloride or egg yolk decreased the activation ratio and sperm viability of frozen semen of rainbow trout; the addition of potassium chloride improved the sperm survival time to a certain extent. In conclusion, the addition of potassium chloride and egg yolk respectively or in combination may reduce the cryopreservation effect of rainbow trout semen. I# cryopreservation solution without potassium chloride and egg yolk is recommended for the cryopreservation of rainbow trout semen.
Key words:Oncorhynchus mykiss; cryopreservation;semen;potassium chloride;egg yolk; activation ratio
(收稿日期:2021-09-04;修回日期:2021-11-09)

