饥饿胁迫对克氏原螯虾生理生化和肠道健康的影响
赖 婷 聂子盈 张小雨 孙存鑫 徐骁迪 蒋 青 刘明阳 刘 波, 王爱民
(1. 南京农业大学无锡渔业学院, 无锡 214081; 2. 中国水产科学研究院淡水渔业研究中心,农业农村部淡水渔业和种质资源利用重点实验室, 无锡 214081; 3. 西南科技大学生命科学与工程学院, 绵阳 621010;4. 盐城工学院海洋与生物工程学院, 盐城 224051)
克氏原螯虾(Procambarus clarkii)又称淡水小龙虾, 属节肢动物门, 甲壳纲, 十足目, 鳌虾科, 为美国中南部和墨西哥北部的土著物种, 经由日本传入我国, 是一种淡水经济甲壳动物[1,2]。近年来, 以克氏原螯虾为主导的产业, 经济效益好, 产业链长, 已经成为江淮地区的特色产业[3]。随着克氏原螯虾这一消费热点的持续增长, 克氏原螯虾养殖的相关研究变得尤为重要。目前我国的克氏原螯虾养殖主要以池塘精养和稻田综合种养等模式为主, 在养殖过程中存在苗种退化, 养殖密度难以估算, 存在越冬饥饿、投喂不及时、不充分的现象。因此饥饿已经成为克氏原螯虾养殖过程中最易受到的生理胁迫之一[4]。
在过去的几十年里, 科研人员针对饥饿对鱼类生理、内分泌和消化系统影响展开了大量的分析[5],许多结果表明年龄、基因型、饮食结构及栖息环境可以改变鱼体肠道微生物结构组成, 进而对机体的生长发育和免疫调控等产生影响[6,7]。刘波等[8]发现长期饥饿会降低吉富罗非鱼GIFT(Oreochromis niloticus)机体免疫和抗氧化能力, 影响罗非鱼的健康; Sun等[9]在团头鲂(Megalobrama amblycephala)的饥饿实验中发现饥饿会损害鱼体的肠道结构并改变其微生物群落组成, 从而影响肠道消化并造成炎症; Semova 等[10]也发现斑马鱼(Danio rerio)在饥饿胁迫下, 肠道微生物多样性呈现下降趋势, 并且其微生物群组组成变化可能会影响脂肪的分解代谢和自噬水平。在饥饿对甲壳类生理的影响方面,王晨赫等[11]发现河蟹(Eriocheir sinensis)在饥饿初期肠道微生物多样性会出现短暂上升, 而后期则呈现下降趋势, 其体内存在大量长期稳定存在的“优势种群”, 在维持肠道内稳态方面发挥着重要作用。目前有关饥饿对克氏原螯虾生理功能影响的研究还比较匮乏, 饥饿胁迫对克氏原螯虾生长及肠道健康方面的影响还有待进一步研究。因此本研究旨在通过组织病理学、高通量测序和生物信息学分析技术, 探明不同程度饥饿胁迫对克氏原螯虾生理生化和肠道健康的影响, 为克氏原螯虾的养殖和投喂等提供参考依据。
1 材料与方法
1.1 实验虾及日粮
克氏原螯虾来源于江苏南京浦口区林涛怀善家庭农场, 将规格基本一致的克氏原螯虾(20.2±0.15) g随机分到6个养殖箱, 每个养殖箱10尾。投喂饲料为市售克氏原螯虾商品日粮。每日以体重的2%—4%投喂颗粒饲料2次(9: 00和18: 00), 每次达饱食, 1h后移除残饵, 在水族箱中驯化养殖2周后进行饥饿实验。
1.2 饲养管理
克氏原螯虾水族箱驯化14d后进行饥饿实验,实验过程保持日夜连续充气增氧, 监测水温, 吸污以保证水质清洁。整个饲养过程水质如下: 水温为(28.0±3)℃, pH为 6.0—8.0, 氨氮低于0.05 mg/L, 硫化氢低于0.05 mg/L, 溶解氧保持在5 mg/L以上。
1.3 样品采集与分析
在饥饿0d、7d、14d和28d采样, 每个时间点采集6尾虾血淋巴测定常规生理生化指标以评定克氏原螯虾的生理状态; 3尾虾肠道于4%多聚甲醛固定液, 进行肠道HE染色和TUNEL细胞凋亡检测; 3尾虾肠道内容物进行16SrRNA测序。
血淋巴生化指标测定使用1 mL无菌注射器从克氏原螯虾的头胸甲后缘刺入围心腔, 抽取0.5 mL血淋巴, 放入1.5 mL装有等量抗凝剂的离心管中。4℃静置4h, 4000 r/min离心15min, 取上清液用于生理生化指标的测定。尿素(UREA)、血糖(GLU)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、总蛋白(TP)和甘油三酯(TG)水平均采用深圳迈瑞生物医疗电子股份有限公司制造的BS-400全自动生化分析仪测定。
肠道HE染色从多聚甲醛固定液中取出固定好的肠道, 修剪好后放入包埋盒内用蒸馏水冲洗0.5h, 染色方法参照Fischer等[12]依次脱水、浸蜡、包埋和切片。HE染色过程为: (1)先用低浓度乙醇溶液处理, 逐渐提高浓度至脱水完成, 随后将切片放入二甲苯中脱蜡; (2)数次用浓度梯度依次降低的乙醇溶液逐级复水, 处理后放入蒸馏水; (3)用苏木素溶液处理3—8min后水洗, 水洗处理完用1%盐酸-乙醇溶液分色, 分色后水洗; (4)0.6%氨水返蓝处理后使用酒精逐级脱水; (5)脱水后用伊红染液染色1—3min, 用乙醇溶液处理后用二甲苯处理至透明;(6)以中性树胶使切片密封,显微镜观察拍照。
肠道TUNEL细胞凋亡将多聚甲醛固定液中取出的石蜡切片用酒精固定2h后进行TUNEL检测, TUNEL检测方法参照袁永辉等[13]的改进方法:(1)石蜡切片在脱蜡后, 用0.1% Triton X-100和0.1%枸橼酸三钠混合液低温处理5min; (2)切片在滴入TUNEL反应混合液前用0.1%焦碳酸二乙酯(DEPC)处理20min; (3)3% H2O2-甲醇液浸泡15min后加入山羊血清; (4)吸去多余血清, 加入POD转换剂进行避光孵育; (5)苏木素复染细胞核; (6)中性树胶封片后在光学显微镜下观察凋亡细胞。
16S rRNA测序将虾的肠道内容物挤压出并收集, 提取DNA进行细菌16S rRNA测序分析, 每个时间点取3个重复共12个肠道内容物样本, 方法参照沙玉杰[14]分析内容包括OTU聚类、OTU抽平、OTU Venn图分析、OTU PCAf分析、物种分类和丰度分析、物种热图分析、样品复杂度分析(单个样品复杂度分析和样品间复杂度分析)、显著性差异分析、LDA EffectSize分析、系统进化树、NMDS分析及功能注释等。
1.4 数据统计与分析
在完成16S rRNA 测序后, 使用MOTHUR软件在0.97相似度下进行聚类划分分类单元 (Operational taxonomic unit, OTU), 应用Ribosomal Database Project测序数据进行微生物种类划分。通过sliva rRNA数据库(http://www.arb-silva.de/)数据库对OTU进行比对, 血淋巴生化指标采用SPSS软件单因子方差分析(One-way ANOVA)进行处理, 多重比较用Duncan’s进行差异显著性检验, 结果用平均值±标准误(mean±SE,n=6)表示。
2 结果
2.1 饥饿对克氏原螯虾血淋巴生化指标的影响
由表 1可知, 血糖(GLU)水平随着饥饿时间延长呈现降低趋势(P<0.05); 而尿素(UREA)和甘油三酯(TG)呈现先显著上升后下降的趋势, 且都在第7天达到了最大值(P<0.05); 谷丙转氨酶(ALT)没有发生显著变化; 总蛋白(TP)和谷草转氨酶(AST)呈先下降后上升的趋势, 其中总蛋白(TP)在饥饿7d时出现最小值(P<0.05)。长期处于饥饿状态的克氏原螯虾血淋巴生理发生紊乱。
2.2 饥饿胁迫对克氏原螯虾肠道组织结构的影响
克氏原螯虾肠道HE染色结果显示(图 1), 对照组上皮细胞与黏膜下层一起向内形成肠绒毛, 绒毛排列相对整齐, 随着饥饿时间的延长28d时, 克氏原螯虾肠道上皮细胞萎缩, 肌肉层厚度减小, 肠绒毛高度呈现萎缩、凌乱的现象。
2.3 饥饿胁迫对克氏原螯虾肠道细胞凋亡的影响
克氏原螯虾肠道组织细胞凋亡结果, 肠道组织可见大量的TUNEL阳性细胞(图 2), 整个细胞着色较深, 细胞核内有较强的棕色颗粒。小龙虾肠道组织细胞凋亡平均指数结果表明(图 2), 与饥饿0d组比较, 饥饿7d组无显著差异, 饥饿14d组和饥饿28d组有显著差异, 随饥饿时间的延长, 凋亡平均指数有上升趋势。
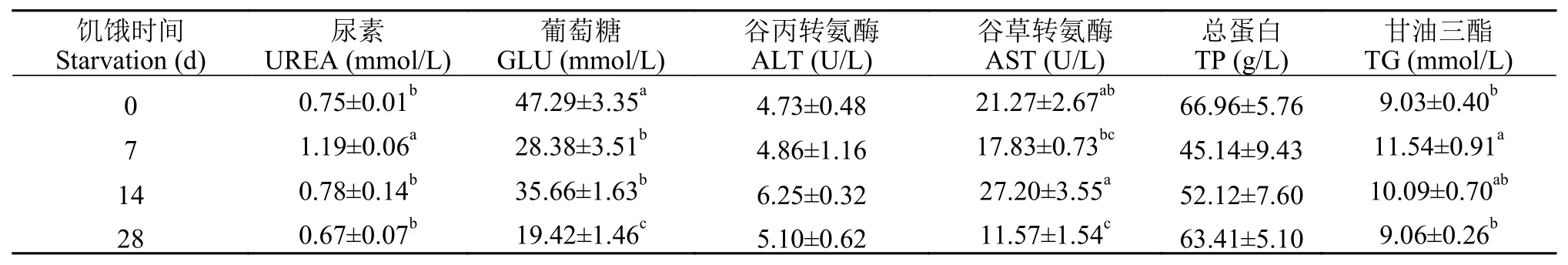
表 1 饥饿胁迫对克氏原螯虾血淋巴生化指标的影响Tab. 1 Effects of starvation stress on hemolymph physiology indexes of Procambarus clarkii (n=6)
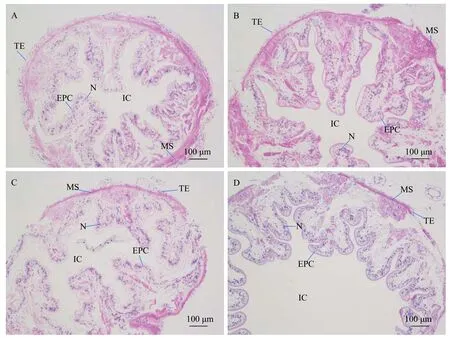
图 1 饥饿后克氏原螯虾的肠道组织学结构Fig. 1 The intestinal histological structure of Procambarus clarkii after starvation (200×)
2.4 克氏原螯虾在不同饥饿程度下肠道微生物组成多样性差异分析
OUT venn图OTU (Operational Taxonomic Units)的丰度初步说明了样品的物种丰富程度。由图 3可以看出, 在0.97的相似度下, 得到了每个组的OTU个数, 利用Venn图可以展示多组别共有和各自特有OTU数目, 直观展示样品间OTU的重叠情况。4个不同饥饿程度12个样品中共产生2317种OTU, 其中4个不同饥饿程度共同含有671种OTU。D0、D7、D14和D28样品中独有的OTU数量分别为78、259、133和208, 差异较为明显。综上可分析出, D7的肠道微生物多样性最多, D28次之, D0最少。
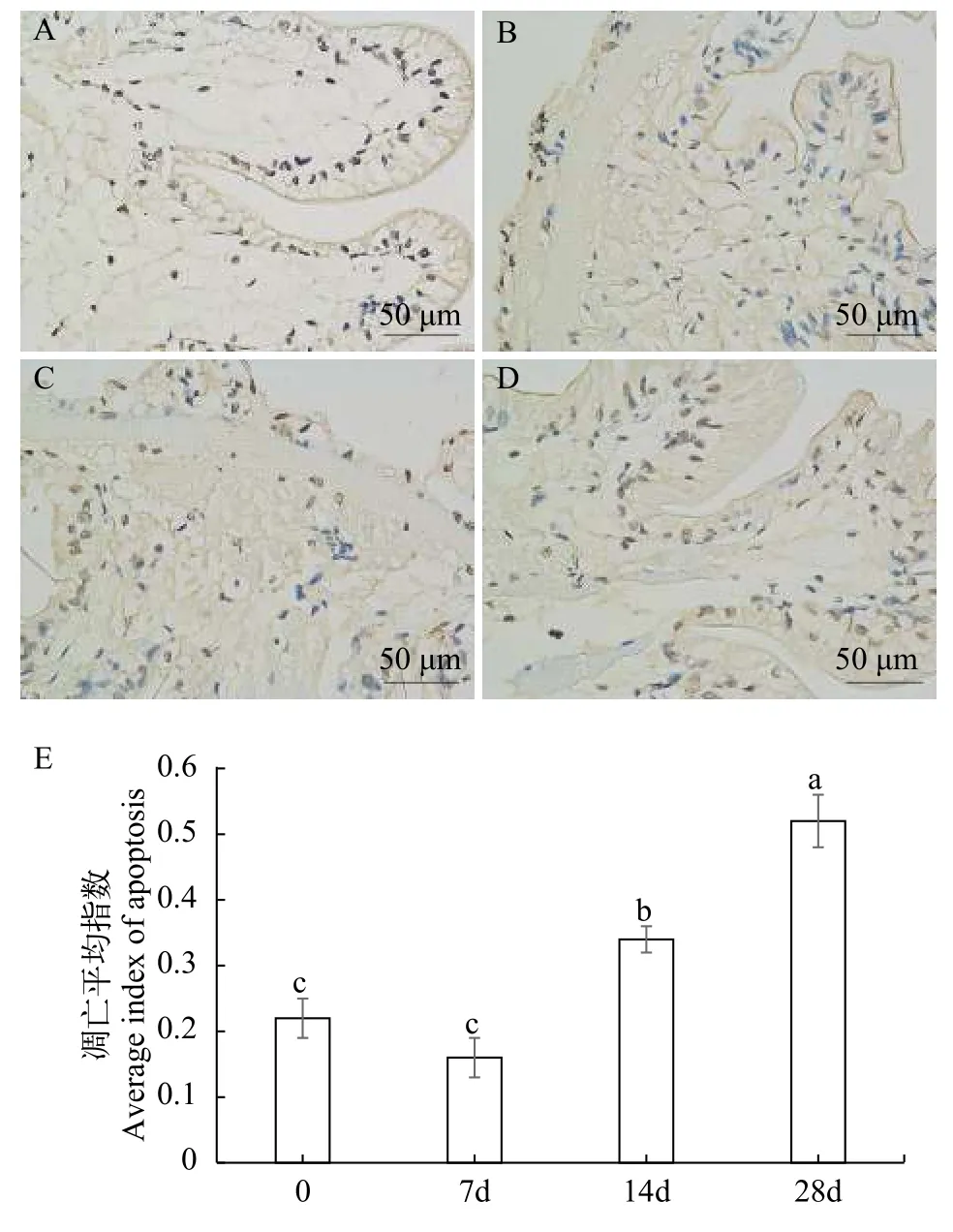
图 2 饥饿后克氏原螯虾肠道组织TUNEL染色及凋亡平均指数柱状图Fig. 2 TUNEL staining (400 ×) and average apoptotic index histogram of intestinal tissue of Procambarus clarkii after starvation (n=6)
不同分类水平中物种组成及其动态变化使用基于OTU的丰度及注释信息, 对每个样品在各分类水平(Phylum, Class, Order, Family)上的序列数目占总序列数的比例进行统计, 可以有效地评估样本的物种注释分辨率及样本的物种复杂度。在样品不同分类水平柱状图(图 4)中, 鉴定出21个细菌门类, 相对丰度较高(丰度大于0.5%)且12个样品中均有分布的细菌门类有变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)和柔膜菌门(Tenericutes)。随着饥饿程度的不断加深, 拟杆菌门(Bacteroidetes)的种群数量出现显著变化, 经历了先减少后增加的动态变化, 且在饥饿的第7天出现最小值, 第28天逐渐回到至第0天水平;厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和浮霉菌门(Planctomycetes)的种群数量则在饥饿胁迫的第7天达到最大值, 此时复杂度最高, 而在饥饿胁迫28天后下降至接近第0天水平, 复杂度也随之降低。在纲水平上, 种群丰度变化最大的是拟杆菌纲(Bacteroidia), 其变化趋势与拟杆菌门(Bacteroidetes)保持高度一致, 而芽孢杆菌纲(Bacilli)、α-变形菌纲(Alphaproteobacteria)和放线菌纲(Actinobacteria)微生物水平则呈现先显著上升趋势, 并在后期维持相对高位的动态平衡。在目水平上, 肠杆菌目(Enterobacteriales)和乳杆菌目(Lactobacillales) 变化较大, 其中隶属于肠杆菌目(Enterobacteriales)的肠杆菌科(Enterobactertaceae)微生物种群数量在饥饿开始后急剧下降, 后虽有涨幅, 但仍低于初始水平。
不同门下属水平分析如图 5所示, 在不同程度饥饿胁迫下克氏原螯虾肠道内定植最多的是拟杆菌门(Bacteroidetes)下的拟杆菌属(Bacteroides),其水平在饥饿胁迫后第7天降至最小值, 而后出现大幅攀升; 厚壁菌门(Firmicutes)下的链球菌属(Streptococcus)在饥饿胁迫开始后出现繁殖速度加快, 并在后期保持较高位种群数量的稳定; 变形菌门(Proteobacteria)下的柠檬酸杆菌属(Citrobacter)对饥饿变化最为敏感, 胁迫开始后立即降至低水平,并在后期维持低位种群数量; 同属变形菌门(Proteobacteria)的奈瑟菌属(Neisseria)及嗜血杆菌属(Haemophilus)在饥饿胁迫后的数量变化上具有一致性, 出现小幅增殖, 随后保持稳定。
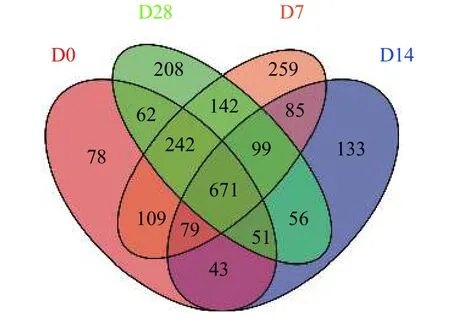
图 3 OTU venn图Fig. 3 OTU venn diagram
PICRUSt2二级通路注释为了了解不同饥饿程度小龙虾肠道菌群功能, 采用PICRUSt软件对肠道菌群功能进行了预测(图 6)。饥饿的4个实验组, 其肠道微生物参与的代谢基本相似, 主要参与了新陈代谢(Metabolism)、环境信息加工(Environmental information processing)和遗传信息加工(Genetic information processing)这三大功能。这些微生物为宿主克氏原螯虾提供了包括糖代谢(Carbohydrate metabolism)、氨基酸代谢(Amino acid metabolism)、脂代谢(Lipid metabolism)、能量代谢(Energy metabolism)、膜运输(Membrane transport)、转录(Transcription)、翻译(Translation)、折叠、分类和降解(Folding, sorting and degradation)在内的等42个功能。
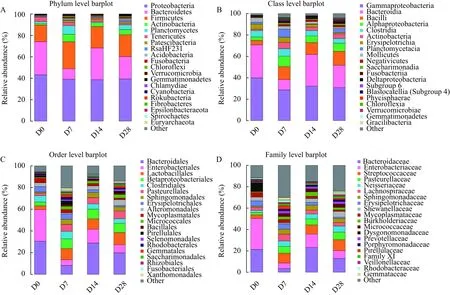
图 4 样品不同分类水平中物种profiling柱状图Fig. 4 Species profiling histogram in different classification levels of samples
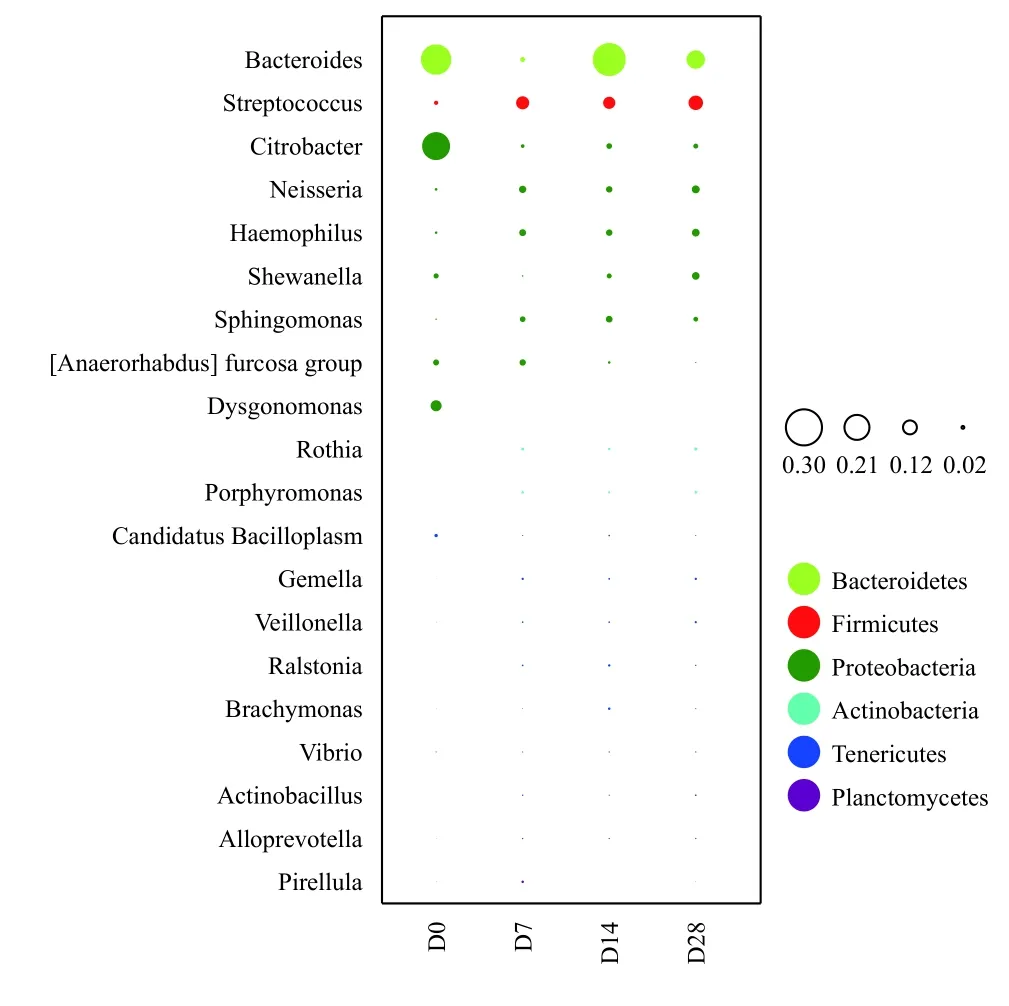
图 5 不同门下top20属水平的气泡图Fig. 5 Bubble diagrams of top20 genus levels under different phyla
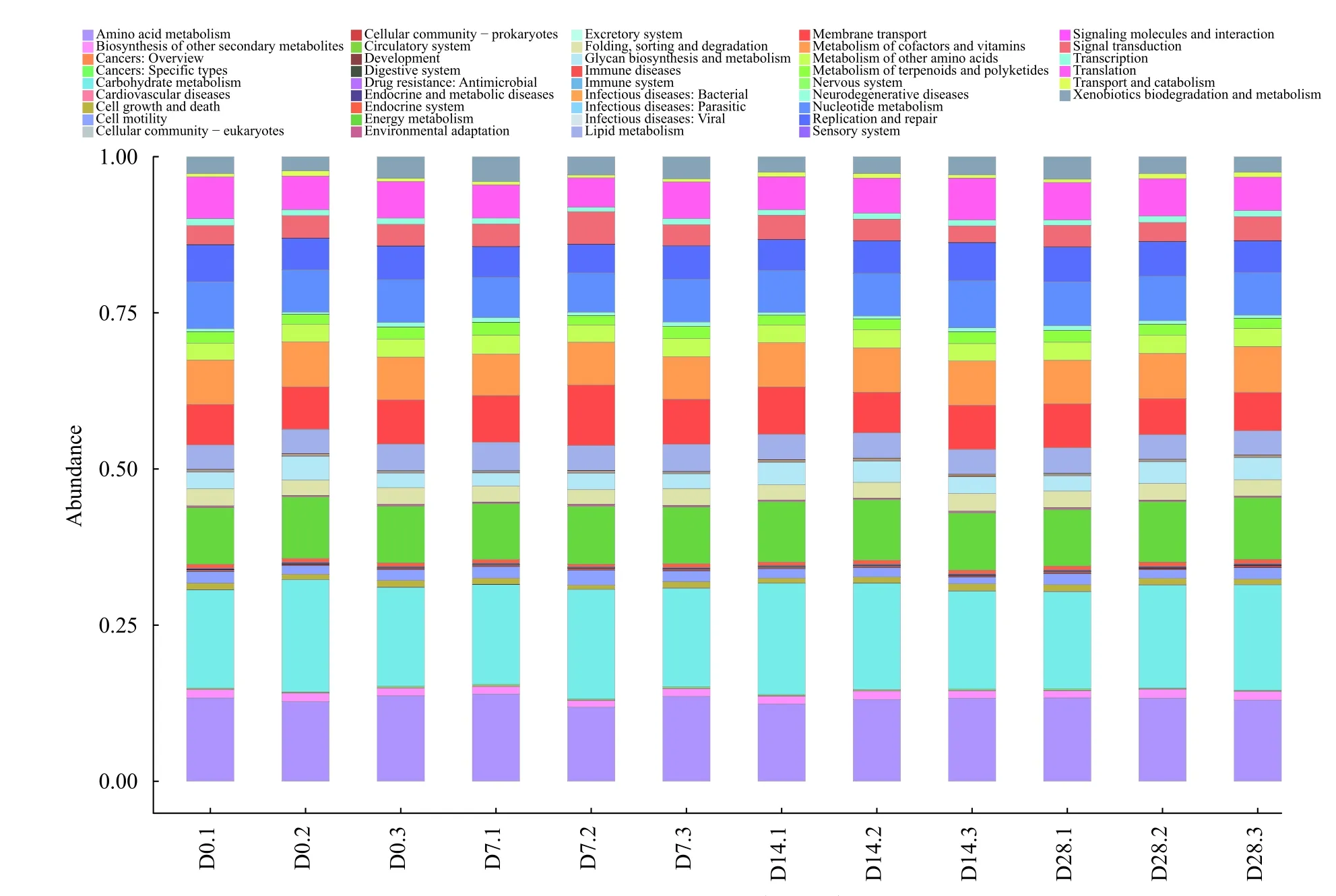
图 6 PICRUSt2二级通路注释结果Fig. 6 PICRUSt2 secondary path annotation results
3 讨论
3.1 饥饿对小龙虾血淋巴生理的影响
在养殖过程中, 饥饿是一种应激因子, 不论是长期饥饿还是短期饥饿, 都会不同程度地干扰机体内分泌节律, 进而影响能源物质的利用[15]。本实验发现, 克氏原螯虾在长达28d的饥饿胁迫中, GLU水平随着饥饿时间延长不断降低, 说明糖类是维持机体生命活动的必要燃料, 在生命代谢过程中具有重要意义, 这与王春忠等[16]在长毛对虾中的研究结果一致。此外, 在判断机体营养状态时, 一般以血淋巴总蛋白作为主要参考指标[17], 同时UREA作为其主要代谢产物与机体对能源物质的调控有着密切联系[18]。本实验发现饥饿胁迫下的克氏原螯虾TP水平呈下降后上升的趋势, 在饥饿7d时出现最小值, 而蛋白质的代谢产物UREA的含量则呈现先上升后下降趋势, 在饥饿7d时出现最大值, 两者含量变化完全相对应。结果表明克氏原螯虾在面临饥饿胁迫时, 可通过蛋白质分解代谢为机体生命活动提供能量, 这与吴旭干等[19]对三疣梭子蟹初孵幼体的整期饥饿研究结果一致。ALT与AST作为蛋白质和氨基酸代谢中的2种重要转氨酶, 在衡量动物机体肝功能是否正常具有重要指示作用[20]。当动物肝细胞受损时, 其体内ALT与AST活性会迅速增强, 并被释放到血液中, 同时作为体内蛋白质和氨基酸代谢终产物的UREA减少, 动物肝脏细胞受到损害的程度上升[21,22]。在本实验中, 随着饥饿时间的延长, 克氏原螯虾血淋巴中AST活性变化出现显著差异, 在饥饿第14天出现最大值; ALT含量变化虽未见显著差异, 但与AST的变化趋势具有相似性。这说明饥饿则会导致克氏原螯虾机体肝细胞一定程度受损, 蛋白质和氨基酸代谢出现紊乱, 最终影响机体生长。TG作为机体储存能量的载体,长期饥饿会导致其水平显著下降[23], 本实验随着饥饿程度的不断加深, 克氏原螯虾TG水平呈现先显著上升后下降的趋势, 且在第7天达到最大值。联系本实验克氏原螯虾生化组成数据, 发现克氏原螯虾在面临饥饿胁迫时, 会通过糖异生作用, 加快蛋白质的分解代谢, 合成大量脂类储能物质以应对长期的饥饿胁迫, 这一点与朱艺峰等[24]对花鲈的周期性饥饿研究结果具有相似性。
3.2 饥饿胁迫对克氏原螯虾肠道组织的影响
肠道是机体重要的消化器官, 各种营养物质通过上皮细胞吸收进入血液, 进而供给全身的营养需求[25], 肠腔大小, 肠道黏膜上的褶皱高度, 肌层厚度,上皮组织细胞的数量都与机体的营养物质的消化吸收能力密切相关[26]。同时肠道组织还通过肠腔上细胞膜和肠上皮细胞间的紧密连接, 介导着机体的非特异性免疫防御功能[27]。本实验中随着饥饿时间的延长, 克氏原螯虾肠绒毛萎缩、凌乱, 上皮细胞凋亡指数上升, 说明饥饿胁迫不仅能够有效诱导肠道发生显著的形态变化以适应食物短缺的问题, 同时细胞凋亡作为动物进化过程中保留下来的高度保守机制, 也造成肠道产生炎症反应, 肠道的屏障进一步受损。另外, 在该实验进行过程中, 28d的饥饿并没有导致大量的克氏原螯虾死亡, 表明克氏原螯虾在面临饥饿胁迫时, 可通过下调消化系统结构和功能来节约能量以满足其基本能量需求[28]。
3.3 饥饿对克氏原螯虾肠道微生物的影响
新生动物在没有摄取食物之前, 肠道内没有任何微生物,当其开口摄食后, 肠道绒毛上皮便成为微生物的集聚地, 分泌各种酶类与宿主相互依存、互惠共生[29]。与鱼类等脊椎动物一样, 克氏原螯虾肠道微生物菌群在影响机体生长代谢、健康免疫等方面具有重要作用[30], 肠道菌群生态的失衡, 会导致虾体内环境出现紊乱, 从而诱发疾病[31]。
本实验基于16S rRNA的高通量测序技术在门水平发现克氏原螯虾肠道是一个由好氧菌和厌氧菌组成的动态菌群。在饱食情况下变形菌门 (Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)等厌氧占绝对优势(90%以上), 这与李可等[32]对南美白对虾肠道微生物群落分析结果相似。在不同程度的饥饿胁迫下, 其微生物结构组成出现显著差异。其中差异最显著的柠檬酸杆菌属(Citrobacter)在饥饿开始后便骤降至较低水平; 厚壁菌门Firmicutes中的链球菌属(Streptococcus), 其丰度随着饥饿时间的延长不断增加; 拟杆菌门(Bacteroidetes)中的拟杆菌属(Bacteroides), 在饥饿胁迫的初期即第7天出现最小值, 后期虽有上升趋势, 但增幅较小, 与初始水平仍有较大差距。在菌群功能上, 黄锦等[33]发现柠檬酸杆菌作为一种条件致病菌大量出现在施用化肥的养殖田块中, 该菌种极易爆发大规模杆菌疾病, 而在本实验中柠檬酸杆菌骤降至较低水平, 可能是触发了某些肠道保护机制[34],使得致病菌数量显著减少。另外Zhang等[35]发现拟杆菌门(Bacteroidetes)及厚壁菌门(Firmicutes)是动物胃肠道参与食物残余物代谢的主要细菌, 在本研究当中, 厚壁菌门(Firmicutes)种群数量出现了一定程度的上升, Mountfort等[36]曾指出厚壁菌门(Firmicutes)可以产生多糖水解酶进而促进胃肠道内容物的分解代谢进程, 其分解产生的小分子糖类及脂肪酸是供给肠道组织细胞能量代谢的重要来源[37], 其种群数量在饥饿胁迫开始后的迅速增长并持续稳定说明厚壁菌门(Firmicutes)在饥饿胁迫下克氏原螯虾的能量代谢方面发挥了重要作用。
此外, 肠道微生物在漫长的进化过程中与宿主形成了互惠共生关系, 其作为一个环境因素参与宿主众多营养代谢和免疫调控进程[38]。肠道菌群的代谢产物作为一种信号分子能作用于机体, 对机体进行宏观调控, 同样的机体营养状态的改变也能反作用于肠道菌群, 从而对菌群参与的代谢途径产生影响[39,40]。因此我们进一步对不同程度饥饿胁迫下的克氏原螯虾肠道微生物群落进行功能预测分析, KEGG富集结果显示不同程度饥饿胁迫下肠道微生物参与的代谢类型并没有明显规律可循, 但是注释水平较高的糖代谢和脂代谢及氨基酸代谢等通路仍是值得关注的内容。科研人员在对卵形鲳鲹(Trachinotus ovatus)幼鱼[41]的饥饿研究中发现短期饥饿会通过提升脂代谢途径来供能, 氨基酸代谢途径的增强则出现在长期胁迫后; 太平洋鲑(Oncorhynchusspp.)[42]在饥饿初期首先利用肝脏糖原和部分肠系膜脂肪供能, 后期则主要利用肠系膜脂肪和少量蛋白质。有研究指出, 饥饿可以引起肠道微生物的种群数量的巨大改变以适应自身能量需求[43], 通过比对各项指标, 我们发现出现上述差异的原因可能是克氏原螯虾机体面对饥饿做出的应激反应[44], 通过改变肠道菌群组成结构, 缓解机体的生物紊乱, 提高抗氧化应激能力, 减少体内炎症,有效改善肠道内的微生态。
总之, 克氏原螯虾在面临食物短缺问题时, 可能会通过改变能量物质利用途径适应饥饿代谢过程, 同时不同程度饥饿胁迫会产生强烈的肠道应激反应, 其菌群组成结构在不同水平的物种丰度上均发生显著变化。长期饥饿会导致肠道绒毛萎缩, 细胞凋亡指数增加, 影响虾的健康。目前, 国际上越来越多的研究者发现, 适度的饥饿对提高养殖动物抗氧化应激和免疫水平有显著影响, 这种改善机体健康的效应已经得到了广泛关注。本研究借助高通量测序技术和生物信息学统计来寻找不同程度饥饿胁迫对克氏原螯虾血淋巴生理生化及肠道微生物的影响, 有一定的代表性, 为克氏原螯虾的健康养殖提供了理论参考, 同时也为进一步探明克氏原螯虾肠道微生物动态平衡机制奠定了基础。

