基于转录组测序分析牛不同脂肪组织的脂肪沉积差异研究
王思元,刘 迪,张伟红,王国富,高树新
(1.内蒙古民族大学 动物科技学院,内蒙古通辽 028000;2.内蒙古通辽市开鲁县兽医局,内蒙古通辽 028000)
脂肪组织是一个活跃的代谢器官,该组织对于脂质积累、能量消耗、葡萄糖和胰岛素代谢以及激素调节至关重要,对维持全身能量稳态具有深远的作用[1]。脂肪组织的发育和积累程度受多种因素的调节,包括饮食、年龄、品种以及脂肪组织类型等,同时脂肪代谢也是一个受多途径、多基因共同调控的复杂过程[2]。目前已发现众多参与脂肪代谢的分子,例如:脂肪酸结合蛋白4(Fatty Acid Binding Protein4,FABP4)、脂肪酸合成酶(Fatty Acid Synthase,FASN)、过氧化物酶体增殖物激活受体γ(Peroxisome Proliferator Activated Receptorγ,PPARγ)、CCAAT增 强 子 结 合蛋白α(CCAAT enhancer binding protein alpha,C/EBPα)和甾醇调节元件结合蛋白1(sterol regulatory element binding protein 1,SREBP1)等,他们都在调节脂肪细胞分化沉积的过程中发挥重要作用[3-6]。
脂肪组织按部位主要分为内脏脂肪和皮下脂肪,这2种脂肪组织在表型结构、代谢途径和脂质积累上都有明显的差异[7]。有研究表明,与皮下脂肪相比,内脏脂肪细胞的脂质周转率更高[8],成熟脂肪细胞比例更高,前体脂肪细胞分化能力较弱;同时,内脏脂肪中雄性激素受体更多且对β-肾上腺素敏感[9],其具有更强的脂解代谢活性、胰岛素抵抗性以及摄取葡萄糖能力,而皮下脂肪吸收循环中的游离脂肪酸和甘油三酯(Triacylglyceride,TAG)的能力较强[10]。在肉牛养殖业中,最重要的就是低成本生产优质肉,而内脏脂肪的沉积会降低牛肉品质并引发多种代谢疾病[11]。因此,了解肉牛不同脂肪组织的脂质代谢差异的机制,有助于提高肉牛业的生产效率。
目前,转录组测序技术被广泛应用于功能基因的挖掘和利用,可以加快对基因的系统性理解[12]。本试验采用高通量RNA-Seq(RNA Sequencing)技术,以安格斯牛(Aberdeen Angus)和西门塔尔牛(Simmental cattle)为模型,研究不同部位脂肪组织(背皮下脂肪和肾周脂肪)的转录组图谱,发掘与脂肪沉积相关的功能基因,以期为深入研究皮下脂肪和内脏脂肪的差异提供基础资料。
1 材料与方法
1.1 材料
1.1.1 样品采集 试验所需的安格斯牛和西门塔尔牛由内蒙古自治区通辽余粮畜业开发有限公司提供。选取相同月龄且体质量差异不显著的西门塔尔牛和安格斯牛各3头,屠宰后,采集每头牛相同部位的肾周脂肪和背皮下脂肪,立即将所有样品投入液氮,并在-80℃条件下保存,直至随后使用。
1.1.2 主要试剂 Trizol、反转录试剂盒(KR118)和Talent荧光定量检测试剂盒SYBR Green(FP209-01)均购自天根(北京)。
1.2 方法
1.2.1 总RNA提取和转录组测序 使用Trizol提取不同脂肪组织中的总RNA。使用Nanodrop(Thermo,美国)检测总RNA样品的纯度(D260/D280)和浓度。样品检测合格后,由深圳华大基因生物科技有限公司完成测序,使用平台为BGISEQ-500。
1.2.2 测序数据处理与注释 将测序所得的原始数据(Raw data),过滤掉低质量、接头及未知碱基含量过高的reads后,获得高质量的Clean Data,然后利用HISAT软件将Clean Data与牛的参考基因进行对比。其次利用String Tie软件进行转录本重构,并使用Cuffcompare挑选出新的转录本,使用CPC对新转录本进行蛋白编码潜力预测,随后将预测具有蛋白编码潜力的新转录本加入到参考基因中,得到一个完整的参考转录本。最后使用Bowtie2将clean reads比对到参考序列以统计基因比对率,并利用RSEM计算基因和转录本的表达水平,使用FPKM作为基因表达水平的衡量指标。
1.2.3 基因表达分析 在所有样本中均检测到的基因称为共基因。使用OmicShare在线工具(www.omicshare.com/tools),基于log2FPKM值生成了一个热图,该热图显示了表达量最高的共同基因。
使用DEGseq方法确定安格斯、西门塔尔牛,肾周脂肪和背皮下脂肪样品组间的差异表达基因(Differentially Expressed Genes,DEGs)。以q-value(校正后的p-value)≤0.001和差异倍数(|log2(Foldchang-e)|>1)2个水平作为筛选标准。
1.2.4 差异基因分析 用基因本体(Gene Ontology,GO)来分析DE基因的功能。将DEG与基因本体数据库(http://www.geneontology.org/)进行比对,对计算出的P值进行校正,将校正后的P值≤0.05作为所有DE基因GO项的阈值。基于通路的分析有助于理解DE基因在某些生物学过程中的特定功能。将DEG与京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库(http://www.kegg.jp/kegg/pathway.html)进行比对,Q值≤0.05的途径被认为DE基因显著富集。
1.2.5 实时荧光定量PCR验证差异基因表达使用Trizol提取西门塔尔牛和安格斯牛的肾周脂肪和背皮下脂肪总RNA,然后利用反转录试剂盒合成cDNA。以cDNA为模板,对差异基因进行实时荧光定量PCR验证。PCR反应体系:2×Talent qPCRPre Mix 10μL,正 反 向 引 物(10 μmol/L)各0.6μL,ROX Reference Dye(50×)2μL,cDNA模 板1.25μL,dd H2O 5.55μL。PCR反 应 程 序:95℃预 变 性3 min;95℃变 性5 s,57℃退火10 s,72℃延伸15 s,40个循环。以β-actin为内参基因,每个样品进行3次技术重复。引物由Primer(6.0)设计并由上海生工生物技术服务有限公司合成(表1),用2-ΔΔCt方法计算基因的相对表达量。

表1 引物信息Table1 Primer information
2 结果与分析
2.1 测序数据分析
使用BGISEQ-500平台检测安格斯牛、西门塔尔牛的肾周脂肪和背皮下脂肪共12个样品,每个样品平均产出10.99 Gb数据。Q20、Q30是指测序过程中,对所识别的碱基给出的错误概率。Q20代表错误识别的概率是1%,即正确率是99%;Q30则代表错误识别的概率是0.1%,即正确率是99.9%。由表2可知,各样品clean reads Q30(过滤后的reads中质量值大于30的碱基数占总碱基数的比例)百分比均在88.2%以上,满足后续分析要求。通过对原始数据进行整理,样品比对基因组的平均比对率为92.32%,同时样品间比对率较均匀,样品之间的数据具有可比性;共检测到23 472个基因,其中已知的基因为22 582个,预测的新基因为933个;共检测出19 747个新转录本,其中15 643个属于已知蛋白编码基因的新的可变剪接亚型,933个属于新的蛋白编码基因的转录本,剩下的3 171个属于长链非编码RNA。

表2 过滤后的reads质量统计Table2 Quality statistics of filtered reads
2.2 共同高表达基因
为了进一步研究脂肪组织中特定基因的表达模式,在每个样本的前100个高表达基因中筛选出50个共同基因,并根据FPKM值将它们分为3个主要簇(图1)。第一组由32个基因组成,主要是编码核糖体蛋白或核糖体蛋白同源物的基因。而与脂肪沉积有关的几个基因,即脂肪酸结合蛋白4(Fatty Acid Binding Protein4,FABP4),脂肪形成调节因子(Adipogenesis Regulatory Factor,ADIRF)和硬脂酰辅酶A去饱和酶(Stearoyl-Co A Desaturase,SCD),与其他基因一起组成第二组和第三组。在热图中,不同的颜色代表不同的表达水平。红色代表较高的表达,绿色代表较低的表达。在第一组和第二组中,所有基因在2个脂肪组织之间均表现出相似的差异表达模式。特别是在肾周脂肪中,核糖体蛋白基因和2个脂肪沉积相关基因(FABP4、ADIRF)的表达比在背皮下脂肪中更高。第三组的大多数基因在背皮下脂肪中的表达水平高于肾周脂肪。在所有测试的脂肪组织中,SCD的m RNA表达水平最高。
2.3 差异表达基因的筛选
为了全面了解肾周脂肪和背皮下脂肪组织中DEGs,选择安格斯牛和西门塔尔牛2个不同品种牛进行分析。使用q-value值≤0.001和|log2Foldchang-e|>1的筛选标准筛选DEGs。在安格斯牛肾周和皮下脂肪中,发现731个上调基因和947个下调基因;在西门塔尔牛肾周和皮下脂肪中,发现1 193个上调基因和762个下调基因(图2)。
2.4 差异表达基因的分析
根据细胞成分,分子功能和生物学过程,对DEGs进行GO功能分类,结果显示,安格斯牛、西门塔尔牛2个脂肪组织间的差异基因,在生物过程中,富集最多的是细胞过程和单细胞生物过程,代谢过程次之;细胞组分中,细胞和细胞部分富集最多,其次是膜和膜部分;分子功能中,主要是结合和催化活性(图3和图4)。
为了确定与脂肪沉积有关的生物学途径,将DEGs对比到KEGG数据库中,认为Q值≤0.05的途径是显著富集的。在安格斯牛肾周脂肪和皮下脂肪中发现与脂质代谢有关的几种途径,PPAR信号通路(21个基因,Q=0.007 745 447 6)、甘油脂代谢(14个基因,Q=0.001 507 545)、类固醇生物合成(7个基因,Q=0.002 561 65)、甘油磷脂代谢(17个基因,Q=0.009 139 934)和ECM-受体相互作用(37个基因,Q=0.007 264 252 3)等途径得到了显著富集。
在西门塔尔牛2种脂肪组织中,显著富集的途径包含PPAR信号通路(16个基因,Q=0.044 426 68),甘油脂代谢(12个基因,Q=0.033 519),胰岛素分泌(19个基因,Q=0.002 077 858),脂肪细胞脂解作用的调控(15个基因,Q=0.001 166 248)和ECM-受体相互作用(44个基因,Q=0.000 009 415 021),这些途径可能有助于脂肪沉积或脂肪酸代谢。
在所有比较中,PPAR信号途径、甘油脂代谢和ECM-受体相互作用是富集丰富的共同途径。因此,将重点放在这3个途径以进行下一步的研究。表3列出在3种途径中富集的DEG。在PPAR信号传导途径和甘油脂代谢中,发现9个表达差异较大且共同的DEGs,包括3个上调基因:视黄酸X受体α(retinoid X receptor alpha,RXRA)、C1q肿瘤坏死因子相关蛋白7(C1q and TNF related 7,C1QTNF7)、单酰甘油-O-酰基转移酶2(Monoacylglycerol O-acyltransferase 2,MOGAT2)和6个下调基因:肉碱脂酰转移酶1B(Carnitine Palmitoyltransferase 1B,CPT1B)、解偶联蛋白1(Uncoupling Protein 1,UCP1)、脂肪酸结合蛋白3(Fatty Acid Binding Protein 3,FABP3)、脂肪酸转位酶(Fatty Acid Translocation enzyme,CD36)、脂蛋白1(LPIN1)、甘油-3-磷酸酰基转移酶3(Glycerol-3-phosphate Acyltransferase 3,GPAT3)。在ECM-受体相互作用中,Ⅰ型胶原Α(Collagen Type I alpha 1 Chain,COL1A1)、III型胶原Α1(Collagen Type III alpha 1 Chain,COL3A1)、胶原Α2(Collagen Type I alpha 2 Chain,COL1A2)和II型胶原Α1(Collagen Type II alpha 1 Chain,COL2A1)在背皮下脂肪中上调,而层粘连蛋白γ3(Laminin Subunit gamma 3,LAMC3)和粘连蛋白γ2(Laminin Subunit gamma 2,LAMC2)的表达量下调(表4)。

表3 富集在PPAR通路、甘油脂代谢和ECM-受体相互作用的差异表达基因Table3 Differentially expressed genes enriched in PPAR pathway,glycerol metabolism and ECM-receptor interaction
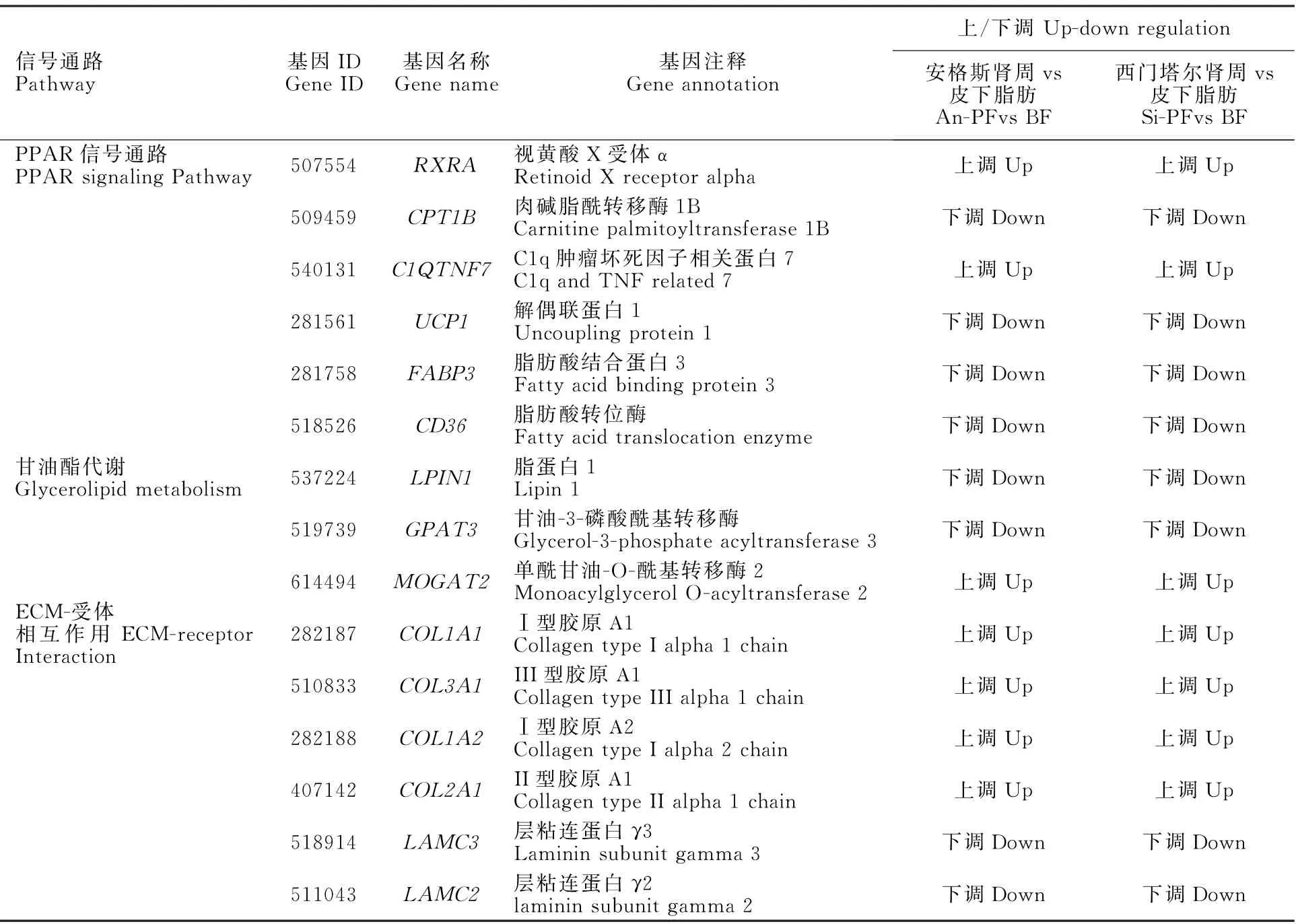
表4 富集在PPAR通路、甘油脂代谢和ECM-受体相互作用的共同差异表达基因Table4 Common differentially expressed genes enriched in PPAR pathway,glycerol metabolism and ECM-receptor interaction
2.5 实时荧光定量PCR验证
为验证转录组的准确性,对差异表达基因COL1A1、COL3A1、RXRA、LPIN1和GPAT 3进行实时荧光定量PCR验证。图5结果显示,实时荧光定量PCR分析结果与转录组测序数据基本一致。
3 讨论
脂肪代谢的机制是很复杂的,在肉牛养殖业中操纵脂肪沉积来生产优质牛肉非常重要。本研究以安格斯牛和西门塔尔牛为模型,通过转录组测序和生物信息学分析,筛选出不同脂肪组织与脂肪沉积相关的高表达共基因和差异基因,探讨了差异形成的可能分子机制。
3.1 牛脂肪沉积的高表达候选基因
此次研究中,发现3个脂肪沉积的候选基因,即FABP4、ADIRF和SCD,它们在牛的脂肪组织中大量表达。FABP4是一种脂肪细胞特异性的脂肪酸结合蛋白,与脂肪酸有很高的亲和力,被认为在动物的脂肪酸运输和脂肪沉积中发挥作用[13]。研究证实,FABP4参与牛的脂肪积累,且其多态性与牛羊肉的嫩度有关[14]。ADIRF特异性分布于细胞核,在脂肪组织高度表达,在人类肥胖者的脂肪组织中该基因表达量显著上调。Ni等[15]研究发现,在3T3-L1细胞中过表达ADIRF基因可上调PPARγ和C/EBPα的水平,并在脂肪形成的早期促进成脂分化;此外,还可刺激前体脂肪增殖并抑制凋亡,同时通过增加葡萄糖转运蛋白4(Facilitated Glucose Transporter 4,GLUT4)的表达水平,增强了脂肪细胞的葡萄糖摄取能力[16]。表明,ADIRF可以调节脂肪细胞增殖分化和葡萄糖转运,促进脂肪沉积。但目前,对于该基因的研究十分有限,且仅局限于人类,其在家畜中的功能特性需要进一步发掘。SCD是催化饱和脂肪酸向单不饱和脂肪酸转化的关键酶,其表达量和活性与脂肪沉积和单不饱和脂肪酸含量呈正相关[13],可以通过调节脂肪沉积和脂肪酸组成来改善肉质。Am等[17]研究
显示,SCD是脂肪生成转录因子SREBP-1C的靶基因,并在UTR区域受SREBP-1C正调控,SCD基因的敲除会显著降低SREBP-1C的表达水平,并抑制前体脂肪的分化[18]。有报道称,油酸可激活SCD敲除小鼠中SREBP-1C的表达和活性[19]。表明,SCD作为油酸生物合成的关键酶,其可能通过调控油酸的合成来影响SREBP-1C的表达与活性,并进一步调节其他脂肪生成基因,最终影响脂肪生成。
3.2 几种差异基因对脂肪沉积的影响
在本研究中,发现在牛的背皮下脂肪和肾周脂肪中差异化表达PPAR信号通路和甘油酯代谢通路中的多个基因(表4),其中RXRA、C1QTNF7和MOGAT2在背皮下脂肪中被上调。RXRA属于配体依赖性核受体家族成员,RXRA可作为一个有活性的配体结合亚单位与PPARs形成异二聚体作用于靶基因[20]。当PPARγ与RXRA进行异二聚化才能产生活化的核受体结构,并与靶基因启动子上的过氧化物酶体增殖物反应原件(Peroxisome Proliferator Response Element,PPRE)结合,从而调控靶基因的表达[21];同时Xue等[22]的研究发现,PPARA/RXRA信号可调节绵羊肝脏中脂肪酸的代谢。表明,RXRA的表达与活性能调节PPARs生物功能的发挥,进而影响脂肪的代谢。C1QTNF7与脂联素具有高度结构相似性,主要在脂肪组织中表达[13]。肥胖人的循环和肝脏中C1QTNF7水平显著升高,并且与体质量指数、葡萄糖、胰岛素和TAG水平呈正相关[23]。体内试验表明,与野生型小鼠(Ferox genus murium)相比,C1QTNF7敲除小鼠会减弱肥胖所引起的胰岛素抵抗,改善葡萄糖代谢和脂肪组织炎症[23]。以上结果表明,C1QTNF7基因的表达可能会对脂肪代谢有着重要的作用。MOGAT2是酰基甘油酰基转移酶家族的关键成员,能催化甘油一酯的酯化生成甘油二酯,该基因的缺失会使得机体食物摄入和脂肪吸收减少,增加能量消耗,并减轻由饮食诱导的葡萄糖耐受不良和脂肪积累[24]。
在肾 周 脂 肪 中CPT1B、LPIN1、GPAT3和CD36基因表达水平上调。CPT1B是脂肪分解代谢的关键酶,也是脂肪酸β-氧化的限速酶,催化脂酰辅酶A与肉毒碱结合生成脂酰肉碱,并将其转移到线粒体内膜进行β-氧化,从而为机体提供能量并减少脂肪沉积。CPT1B在肾周脂肪中的表达量上调,可能是内脏脂肪脂解代谢活性强于皮下脂肪的部分原因。但目前,CPT1B对脂肪沉积的调控颇有争议,俞雨阳等[25]研究显示,绵羊肌肉组织中的CPT1B基因的表达量与肌间脂肪沉积量呈显著正相关,而Zhao等[26]以猪为研究对象发现,CPT1B表达量与肌间脂肪呈负相关;高明[27]发现在牛胎儿成纤维细胞中随着CPT1B的表达量升高,TAG的含量呈现显著上升的趋势,而Zhang等[28]在前体脂肪细胞中则显示CPT1B的高表达量会抑制TAG的生成。推测这些差异可能与种间特异性以及组织间特异性有关,CPT1B在脂肪代谢中的具体功能及作用机制需要进一步研究。LPIN1是脂类家族成员,在维持脂质代谢稳态中起关键作用,一方面LPIN1是催化磷脂酸转化为TAG和磷脂所必需的磷脂酸磷酸酶,另一方面,其可以与PPARα和PPARγ共激活剂α(PGC-1α)作用,共同调节脂肪分化和脂类合成等过程[29]。GPAT是TAG从头合成途径中的限速酶,可催化TAG合成的第一步,将3-磷酸甘油转化为溶血磷脂酸(LPA),具有四种亚型GPAT1-4。其中GPAT3定位于内质网,最重要的是GPAT3被认为是脂肪细胞中合成TAG的主要亚型[30]。在前脂肪细胞中发现,GPAT3m RNA的表达量在分化过程中显著上调;另外,过表达GPAT3后,胞内的TAG含量显著增加(约3~4倍),而敲低该基因,几乎完全阻止了脂滴的形成[31],表明GPAT3对脂质的形成有促进作用。体内试验显示,与野生型小鼠相比,高脂饮食饲喂的GPAT3敲除小鼠能减少脂肪的沉积,改善葡萄糖和脂质代谢,减轻胰岛素抵抗[32]。CD36对长链脂肪酸具有高亲和力,其高表达有助于组织对脂肪酸的吸收,可促进脂质在组织中的积累。此外大量研究证实,CD36可以介导其他信号通路,造成机体的代谢紊乱,并引发一系列疾病,如:胰岛素抵抗、II型糖尿病和炎症反应等[33-34]。本 试 验 中LPIN1、CPAT3和CD36在牛肾周脂肪中上调表达,表明LPIN1、CPAT3和CD36可能是促进内脏脂肪含量增加,进而引发代谢性疾病的候选基因。
UCP1和FABP3在2个 脂 肪 组 织 间 的 表 达量也不同。UCP1在棕色脂肪脂肪中发现,在生热和脂解调节中起关键作用[35]。研究表明,UCP1的多态性与奶牛的乳品质[36]和绵羊的胴体性状[37]有关。FABP3与FABP4具有相似的功能,主要在心脏和骨骼肌中表达,调节肌肉脂肪含量和脂肪组织发育。
3.3 细胞外基质在脂肪组织中的作用
在脂肪组织中,脂肪细胞嵌入在细胞外基质(ECM)网络中,该网络可以支持和锚固脂肪细胞并调节脂肪生成,主要由胶原蛋白组成[38]。不同的胶原蛋白构成不同的成分,Ⅰ、Ⅱ、Ⅲ型胶原形成原纤维,Ⅳ型胶原形成基膜。在脂肪细胞分化早期,Ⅰ、Ⅲ型胶原由前体脂肪细胞分泌,Ⅳ、Ⅴ、Ⅵ型胶原在分化的中期达到峰值[13]。在本研究中,ECM途径相关的基因,如:COL1A1、COL1A2、COL2A1、COL3A1和其他基因的差异表达,显示了在牛肾周脂肪和背皮下脂肪间ECM结构和成脂能力的差异。
4 结论
本研究提供牛2个不同脂肪组织的转录图谱,鉴定出高度转录的共同基因,并利用GO和KEGG数据库分析了肾周脂肪和背皮下脂肪之间的差异基因。数据显示FABP4、ADIRF和SCD与脂肪沉积相关,并有很高的转录水平。9个与脂肪沉积相关的基因(RXRA、C1QTNF7、MOGAT2、CPT1B、LPIN1、GPAT3、UCP1、FABP3和CD36)和6个ECM相 关 基 因(COL1A1、COL1A2、COL2A1、COL3A1、LAMC2和LAMC3)可能是造成肾周脂肪与背皮下脂肪之间脂肪代谢差异的候选基因。需要进一步研究候选基因在脂肪代谢中的作用,以改善肉牛的育种过程。

