复方丹参滴丸通过调控凋亡相关蛋白的表达抑制TNF-α诱导的人牙周膜成纤维细胞凋亡
江 瑾 于春华 仇 妮 王 芳 张 明
人牙周膜成纤维细胞(human periodontal ligament cells,hPLFCs)是一种具有多向分化功能的群体细胞,是牙周组织增殖过程中起主导作用的细胞[1]。hPLFCs的凋亡是牙周组织破坏的重要病理生理过程,hPLFCs的凋亡已被认为是牙周炎、根尖周炎的病理生理因素之一[2]。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是一种重要的影响hPLFCs细胞功能的外界刺激因子。TNF-α对于hPLFCs生物学特性的影响受到越来越多学者广泛关注[3,4]。研究表明,TNF-α可以诱导hPLFCs发生细胞凋亡[5]。寻找具有抑制hPLFCs细胞凋亡作用的药物,是近年来药物研究的热点之一。
复方丹参滴丸(compound danshen dripping pills,CDDP)是利用现代制药技术研制而成的一种纯中药滴丸剂,主要成分为丹参、三七和冰片,其主要成分是丹参水溶性成分和三七的水溶性成分。该药起效快,副作用小,生物利用度高,具有活血化瘀、理气止痛之功能,在临床上广泛用于冠心病、心绞痛的预防、治疗、急救,在扩张血管、清除自由基、改善微循环等方面具有一定的临床价值[6~9]。目前,有关CDDP在牙周疾病中对于TNF-α诱导牙周组织凋亡作用的研究尚不多见。因此,本研究拟通过TNFα诱导hPLFCs细胞凋亡,探讨CDDP对于hPLFCs细胞凋亡的影响及机制,为进一步的深入研究与临床应用奠定基础。
资料和方法
1.实验试剂和仪器:复方丹参滴丸(天士力医药集团股份有限公司);TNF-α、MTT(Sigma公司);胎牛血清FBS(Gibco公司);α-MEM培养基(Hyclone公司);Annexin V-FITC/PI双染凋亡检测试剂盒(上海博谷生物科技有限公司);BCA蛋白定量试剂盒、PVDF蛋白转印膜(碧云天生物技术研究所公司);anti-p53抗体、anti-Bax抗体、anti-Bcl-2抗体和anti-β-actin抗体(Santa Cruz公司);超净工作台(苏州净化有限公司);酶标仪与电泳装置(美国Bio-Rad公司);倒置显微镜(日本Olympus公司)。
2.hPLFCs的体外培养:hPLFCs(武汉普诺赛生命科技有限公司),于5% CO2、37℃下培养于α-MEM培养基中,常规换液,待细胞长至80%后,0.25%胰蛋白酶消化传代培养,取对数生长期细胞用于后续实验。
3.MTT法检测TNF-α对hPLFCs增殖的影响胰酶消化细胞,制备单细胞悬液,细胞以5×104个/孔接种于96孔培养板中。培养24h后,加入不同浓度TNF-α(25ng/mL,50ng/mL,100ng/mL,200ng/mL),继续培养24h。吸弃培养基,每孔加入20μL的MTT溶液(5mg/mL溶于PBS),置于37℃恒温箱中孵育4h。吸去上清后,每孔加入150μL二甲基亚砜随后震荡10min溶解蓝色结晶。用酶标仪在490nm波长下测量其吸光度值。
4.CDDP溶液的制备:将CDDP置于研钵内研碎,培养基溶解,超声30min使药完全溶解,现配现用。
5.实验分组处理:实验分为3组:正常对照组:含5% FBS的DMEM培养基培养;TNF-α组:对照培养基加入200ng/mL TNF-α;TNF-α+CDDP组:对照培养基中加入200ng/mL TNF-α与270mg/mL、540mg/mL、1080mg/mL CDDP。
6.流式细胞仪检测hPLFCs细胞凋亡:细胞接种于24孔板中,细胞经不同实验组预处理48h后,4℃预冷的PBS将各组细胞洗涤2次,加入含0.25%胰酶消化并收集细胞。随后加入1mL的1倍Annexin V结合缓冲液,800r/min离心5min弃上清。加入结合缓冲液200μL重悬细胞。在细胞悬液中加入5mg/L的Annexin V-FITC 10μL及PI 5μL,混匀后37℃避光孵育30min。流式细胞仪以488nm为激发波长,530nm为发射波长检测细胞凋亡率。
7.Western blot检测hPLFCs凋亡相关蛋白的表达:细胞接种于6孔板中,细胞经不同实验组预处理24h后,PBS洗涤细胞,胰酶消化并收集细胞。加入细胞蛋白裂解液RIPA,提取细胞总蛋白,BCA法蛋白定量。取30μg蛋白上样,SDS-PAGE电泳分离总蛋白后,湿转法进行PVDF电转膜。用5%脱脂奶粉在室温下封闭1h,分别加入1:2000稀释的鼠抗人p53、Bax、Bcl-2和β-actin一抗,4℃孵育过夜,TBST洗膜,加入1:1000稀释的HRP标记的二抗,室温孵育1h,TBST洗膜。曝光分析结果,蛋白相对表达量以待测蛋白与内参β-actin的灰度值比值表示。
8.统计学分析:采用SPSS 21.0分析,统计学分析采用单因素方差分析进行,所有数据以均数±标准方差表示,P<0.05表示有统计学意义。
结 果
1.不同浓度TNF-α对hPLFCs增殖的影响:结果表明,hPLFCs细胞增殖与TNF-α浓度相关。与对照组相比,25ng/mL TNF-α作用的hPLFCs增殖变化不明显;50ng/mL TNF-α细胞增殖略微下降;100ng/mL TNF-α细胞增殖显著下降;200 ng/mL TNF-α细胞增殖下降程度更大(图1)。因此,采用200ng/mL TNF-α进行后续实验。
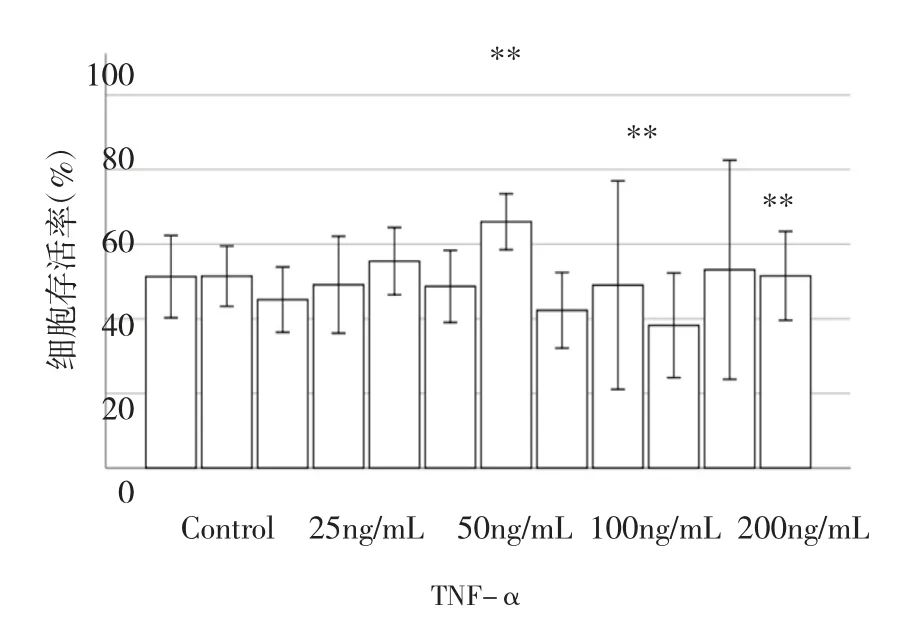
图1 不同浓度TNF-α对hPLFCs增殖的影响
2.CDDP对TNF-α诱导的hPLFCs增殖的影响结果表明,与对照组相比,TNF-α处理组的hPLFCs细胞增殖明显降低。与TNF-α组相比,CDDP组细胞增殖显著升高,且1080mg/mL CDDP组显著高于540mg/mL CDDP组,1080mg/mL与540mg/mL CDDP组均显著高于270mg/mL CDDP组(图2)。

图2 不同浓度CDDP对TNF-α诱导hPLFCs增殖的影响
3.流式细胞仪检测CDDP对于TNF-α诱导的hPLFCs细胞凋亡的影响:结果显示,对照组、TNF-α组、TNF-α+CDDP 270mg/mL组、TNF-α+CDDP 540mg/mL组、TNF-α+CDDP 1080mg/mL组的细胞凋亡率(Q2+Q4)分别是6.8%、35.9%、23.6%、16.6%、10.6%。与对照组比较,hPLFCs细胞经TNF-α作用后,细胞凋亡率显著增加。但是,CDDP组与TNF-α组相比细胞凋亡率显著降低,且1080mg/mL CDDP组分别显著低于540mg/mL CDDP组与270mg/mL CDDP组,540mg/mL CDDP组显著低于270mg/mL CDDP组(图3)。
图3 不同浓度CDDP对TNF-α诱导人hPLFCs细胞凋亡的影响
4.蛋白免疫印迹法检测CDDP对于TNF-α诱导的hPLFCs凋亡相关蛋白的影响:结果显示,与对照组相比,p53、Bax在TNF-α组表达明显升高,Bcl-2蛋白表达显著降低。与TNF-α组比较,CDDP组p53、Bax蛋白表达逐渐下降。并且,1080mg/mL CDDP组分别显著低于540mg/mL CDDP组与270mg/mL CDDP组,540mg/mL CDDP组 低 于270mg/mL CDDP组。除此之外,与TNF-α组比较,CDDP组Bcl-2蛋白表达逐渐升高,1080mg/mL CDDP组分别显著高于540mg/mL CDDP组与270mg/mL CDDP组(图4)。
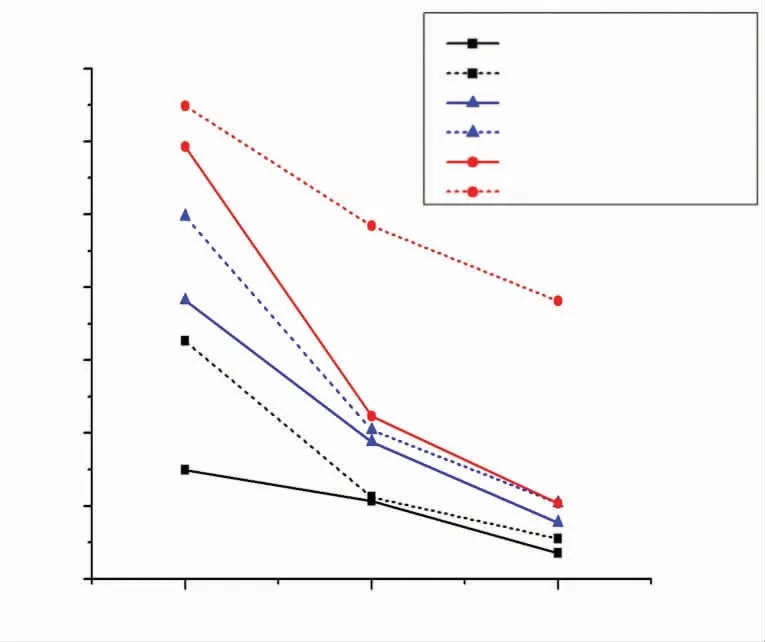
图4 不同浓度CDDP对TNF-α诱导hPLFCs凋亡相关蛋白表达的影响
讨 论
hPLFCs细胞凋亡是一个由多种细胞因子、多种细胞信号转导通路参与的复杂的病理生理过程。针对hPLFCs细胞凋亡信号转导通路的研究不仅有助于更深入地探讨牙周病、根尖周病发病的分子机制,也为其防治研究提供了更多可能有效的干预环节。因此,本研究使用TNF-α诱导hPLFCs细胞凋亡,检测CDDP对细胞凋亡率及凋亡相关蛋白的影响,探索CDDP对hPLFCs细胞凋亡的抑制作用。
本实验用流式细胞仪检测hPLFCs的凋亡率,观察到培养液中加入200ng/mL TNF-α作用正常细胞48h后,与对照组比较,hPLFCs的凋亡率明显增高,这与文献报道[10,11]是一致的。紧接着,采用流式细胞仪检测CDDP对TNF-α诱导的hPLFCs细胞凋亡的影响。CDDP是第一个被美国FDA批准进入治疗心血管疾病II期临床试验的中药[12]。研究表明CDDP可以通过抑制糖尿病大鼠细胞凋亡发挥神经保护作用[13]。本研究的结果显示,与TNF-α组比较,给予不同浓度的CDDP作用48h后,细胞凋亡率有所下降,且随CDDP浓度的增大,hPLFCs的凋亡率下降的越明显,说明CDDP可以有效抑制TNF-α诱导的hPLFCs细胞的凋亡。
Bcl-2/Bax比值在介导细胞凋亡过程中发挥着重要作用。Bcl-2具有抑制细胞凋亡的作用,而Bax具有直接促进细胞凋亡的作用,Bcl-2和Bax是正负调控的凋亡蛋白,Bcl-2/Bax比值决定着细胞区域凋亡还是存活[14]。p53是另一个介导细胞凋亡的调节蛋白,当细胞受到损伤、辐射等影响时,p53表达上调并介导细胞凋亡[15,16]。本实验中采用Western blot检测TNF-α对于hPLFCs细胞凋亡的影响。结果显示,TNF-α作用于hPLFCs后,hPLFCs出现大量凋亡,细胞内Bcl-2蛋白表达明显下降,Bax、p53蛋白表达水平明显上调。但是,加入不同浓度CDDP作用后,细胞的凋亡率呈现下降趋势,Bcl-2表达呈现剂量依赖性上升,Bax、p53表达水平呈现剂量依赖性下降。由此可见,hPLFCs存在Bcl-2、Bax、p53介导的细胞凋亡途径,这些凋亡蛋白的高表达和失衡导致了细胞的大量凋亡,甚至导致牙周组织受损;而CDDP对TNF-α诱导的hPLFCs凋亡相关蛋白的表达有一定的抑制作用,可以起到保护牙周组织的作用。

