化疗对急性淋巴细胞白血病患儿性腺功能的影响
曹 科 罗小娟 王 缨 刘 霞 叶炳均 陈诗杨 赖建威 龙庆玲 陈运生
深圳市儿童医院 1.检验科,2.血液肿瘤科,3.内分泌科(广东深圳 518038)
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是儿童白血病的最常见类型,约占儿童恶性肿瘤的80%左右。近年来由于采用强烈联合化疗和风险导向治疗等手段,儿童白血病的治疗取得了长足进步,ALL化疗后5~10年无事件生存率在我国大型儿童白血病诊疗中心高达80%以上。由于环磷酰胺等化疗药物的药理毒性和靶向选择性差等特点,ALL 化疗生存率的提高可能伴随着患儿性腺功能损伤并增加成年期早发性卵巢功能不全,无/少精子症和不育不孕发病率[1-2]。目前,化疗方案的疗效和安全性是ALL临床治疗的焦点和重心。
儿童肿瘤组织建议对于>13 岁,曾接受过烷化剂或盆部放疗的女童,可采用血清促性腺激素对卵巢功能进行筛查。但对于青春期前(2~5 岁为主)的ALL 儿童,其下丘脑-垂体-性腺轴尚未激活,血清促性腺激素处于低值,雌激素和雄激素几乎测不到,卵巢和睾丸变化几乎处于静止状态,无月经周期和射精过程。因此,血清性激素水平、睾丸触诊等性腺发育评估,月经周期和精液质量改变等指标,并不适用于评估ALL 儿童化疗期间性腺损伤。抗缪勒管激素(anti-Müllerian hormone,AMH)和抑制素B(inhibin B,INHB)由女性卵巢生长卵泡和男性睾丸支持细胞分泌,是属于转化生长因子β 超家族成员,是除雌、雄性激素和黄体生成素、促卵泡激素等激素外,参与两性生殖细胞和性腺发育,反映男女性腺功能的重要生物标志物。在正常排卵妇女中发现,与卵泡刺激素、雌激素相比,血清AMH水平能更好地反映卵巢卵泡池大小和卵泡数量,更能准确反应卵巢生殖功能的下降和预测绝经期,是预测卵巢储备功能的一个可靠指标[3]。INHB 主要由睾丸支持细胞分泌,血清INHB 水平降低与睾丸损伤相关,而且单次采血检测结果与激发试验后睾酮水平两者间存在强烈关联,因此,血清INHB可间接反映男性睾丸支持细胞的数量和活性,被推荐为评估青春期前睾丸功能有效、可靠的非侵入性标志物[4-5]。目前,AMH 和INHB 在生殖领域和评估化疗对成人恶性肿瘤的性腺功能损伤研究中应用较多[6-8],但对ALL 儿童性腺功能损伤的评估鲜有报道。本研究依据华南地区儿童ALL治疗协助组2016化疗方案(south China children’s leukemia group,SCCLG-ALL-2016),连续监测低、中、高危三型ALL儿童化疗前及化疗后血清AMH、INHB激素水平,旨在了解不同强度的化疗对ALL儿童性腺功能激素指标的影响,评估化疗期间性腺功能损伤程度。
1 对象与方法
1.1 研究对象
采用回顾性队列研究,收集2017年4月至2020年8月期间深圳市儿童医院血液肿瘤科收治的ALL患儿临床资料。研究对象入选标准:①青春期前儿童(女1~10 岁、男1~12 岁),由经验丰富的内分泌医师评估入组儿童第二性征发育(男童睾丸、阴茎和阴毛生长,女童乳房、阴毛生长的Tanner 分期均为Ⅰ期);②确诊为ALL;③新发患儿。排除标准:①成熟B、急性混合型白血病;②第二肿瘤;③曾经接受过放疗或化疗;④继发于免疫缺陷病;⑤伴唐氏综合征的ALL;⑥中枢神经系统和/或睾丸白血病;⑦入组前1个月内使用糖皮质激素超过1周;⑧隐睾症、性早熟、特纳综合征等影响性腺功能疾病。
选取同期在院儿童保健科健康体检,年龄和性别相匹配的健康儿童57例作为对照组。
1.2 方法
1.2.1 临床资料收集 记录入组ALL 患儿性别、年龄,临床危险度分型和化疗方案。
1.2.2 危险度分型 依据患儿临床特征、细胞免疫学与生物学特征、对治疗反应,将临床危险度分为高危型、中危型、低危型3 组。低危型:①泼尼松7天反应佳,第8天外周血幼稚细胞<1.0×109/L;②年龄≥1岁且<10岁;③WBC<50×109/L;④诱导化疗第15天骨髓M1(原淋+幼淋<5%);⑤诱导化疗第33天骨髓 M1;符合以上①~⑤标准,或初诊时有以下两项之一且符合微小残留病的低危标准,①t(12;21)/(TEL-AML1)(ETV6-RUNX1)阳性;②超二倍体(>50)且伴4、10号三倍体。中危型:泼尼松7天反应佳,且符合以下1项或多项,①年龄<1岁或≥10岁;②WBC≥50×109/L;③T-ALL;④中枢神经系统白血病(CNSL)或/和睾丸白血病;⑤费城染色体阳性ALL(Ph+ALL)或费城染色体样ALL(Ph-like ALL);⑥t(1;19)(E2A-PBX1)阳性;⑦t(9;22)(BCR-ABL 1)阳性;⑧第15 天骨髓M 2(5%≤原淋+幼淋<25%),且第33天骨髓 M1。高危型:符合以下任何1 项或多项,①泼尼松反应差,第8 天外周血幼稚细胞≥1.0×109/L;②第15 天骨髓M3(原淋+幼淋≥25%);③第33天骨髓未缓解M2及M3(原淋+幼淋≥5%);④t(4;11)(MLLAF4)或其他MLL基因重排阳性;⑤低二倍体(≤44);⑥21号染色体内部扩增(iAMP21)阳性;⑦IKZF阳性;⑧MEF2D重排或ZNF384重排;⑨TCF3-HLF/t(17;19)(q 22;p 13);⑩诱导治疗后(第33 天)评估纵隔瘤灶没有缩小到最初肿瘤体积的1/3或巩固治疗前仍存在瘤灶者。
1.2.3 治疗方案 按SCCLG-ALL-2016方案进行规范化疗,总流程包括诱导缓解、巩固、再诱导和维持治疗。诱导缓解阶段采用VDLD 方案(醋酸泼尼松+长春新碱+柔红霉素+培门冬酶+地塞米松)和CAM方案(环磷酰胺+阿糖胞苷+6-巯基嘌呤+长春新碱)早期强化治疗,低危组1 轮,中危、高危组2 轮。巩固治疗阶段:低危组以甲氨蝶呤2 g/m2、中危组以甲氨蝶呤5g/m2进行4轮化疗,每2周1次,为期56天,每次大剂量甲氨蝶呤(5 g/m2)化疗时需给予腰穿鞘注治疗,同时口服巯嘌呤[25mg/(m2·d)]化疗56 天;高危患儿需给予2 轮HR-1’、HR-2’、HR-3’方案,化疗药物包括:地塞米松、长春新碱、长春地辛、大剂量甲氨蝶呤(5 g/m2)、环磷酰胺、阿糖胞苷、培门冬酶、异环磷酰胺、柔红霉素、依托泊苷。再诱导阶段:采用VDLD方案(低危组3轮,中、高危组4 轮)和CAM 方案。维持治疗阶段:6-巯基嘌呤+甲氨碟呤+地塞米松+长春新碱治疗。在整个化疗期间需定期腰穿鞘注预防中枢神经系统白血病;总疗程2.0~2.5年。
1.2.4 样本采集 分别于化疗前,化疗后3、6、12、18 个月共5 个时间点,于上午8 点空腹抽取静脉血3 mL,相对离心力1 200×g,离心5分钟后取血清。收集同期在院儿童保健科健康体检儿童生化常规检测的剩余血清标本,于-40℃冰箱冻存备检。
1.2.5 检测方法 血清AMH、INHB水平、黄体生成激素(LH)、卵泡生成激素(FSH)、雌二醇(E2)和睾酮(T)均采用化学发光免疫分析法检测,仪器为深圳市亚辉龙生物科技股份有限公司的iFlash 3000化学发光免疫分析仪,使用仪器配套专用试剂盒,严格按照仪器标准操作程序和试剂盒说明书操作检测,室内质量控制在控。
1.3 统计学分析
采用SPSS 22.0 统计软件进行数据分析。符合正态分布的计量资料以均数±标准差表示,非正态分布计量资料以中位数(P25~P75)表示,经对数转换为正态分布数据后,再行相关检验。多组间比较采用单因素方差分析,两组间比较采用两独立样本t检验。重复测量计量资料采用重复测量的方差分析,若符合球形假设检验则行两因素方差分析,若因变量方差协方差矩阵不相等,行Greenhouse&Geisser方法(ε<0.75)或者Huynh-Feldt方法(ε≥0.75)矫正。相关性分析采用Spearman 秩相关检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
共纳入112 例ALL 患儿,男58 例、女54 例,中位年龄4.1(2.5~6.1)岁(范围1~9岁)。其中男童高危型14例、中危型29例、低危型15例;女童高危型10例、中危型29例、低危组15例。正常对照组57例,男28例、女29例,中位年龄4.0(2.5~6.3)岁。
2.2 ALL 患儿化疗前血清AMH、INHB 和性激素水平
无论男、女,ALL 高危组、中危组、低危型组与对照组之间年龄,血清AMH、INHB 和LH、FSH 水平的差异均无统计学意义(P>0.05)。无论ALL 高危组、中危组、低危型组还是对照组(t=7.97~16.38,P均<0.01),女童组血清AMH、INHB 水平均明显低于男童组,FSH 明显高于男童组,差异均有统计学意义(t=5.02~6.52,P均<0.01)。见表1。

表1 ALL儿童化疗前血清AMH、INHB和性激素水平比较分析
经Spearman 秩相关检验发现,女童化疗前血清AMH水平与年龄呈正相关(r=0.37,P=0.006),男童AMH、INHB水平与年龄呈负相关(r=-0.48,P<0.001;r=-0.32,P=0.014)。
2.3 ALL化疗前、后血清AMH和INHB水平比较
采用重复测量方差分析发现,男童低危型、中危型、高危型之间血清AMH 水平差异无统计学意义(F=1.05,P=0.362),男童化疗前后不同时间点的血清AMH 水平差异也无统计学意义(F=2.65,P=0.105),时间与危险度分型对于血清AMH水平不存在交互效应(F=1.20,P=0.304)。男童低危型、中危型、高危型之间血清INHB 水平差异有统计学意义(F=3.60,P=0.036),男童化疗前后不同时间之间血清INHB水平差异有统计学意义(F=81.67,P<0.001),时间与危险度分型对于血清INHB水平存在交互效应(F=5.12,P<0.001)。见表2。

表2 ALL男童化疗前、后血清AMH和INHB水平比较分析
采用重复测量方差分析发现,女童低危型、中危型、高危型之间血清AMH 水平差异无统计学意义(F=0.62,P=0.551),女童化疗前后不同时间之间血清AMH水平差异有统计学意义(F=21.32,P<0.001),时间与危险度分型对于血清AMH水平存在交互效应(F=2.33,P=0.029)。女童低危型、中危型、高危型之间血清INHB 水平差异无统计学意义(F=0.675,P=0.523),女童化疗前后不同时间之间血清INHB水平差异无统计学意义(F=1.226,P=0.300),时间与危险度分型对于血清INHB水平不存在交互效应(F=0.664,P=0.721)。见表3。
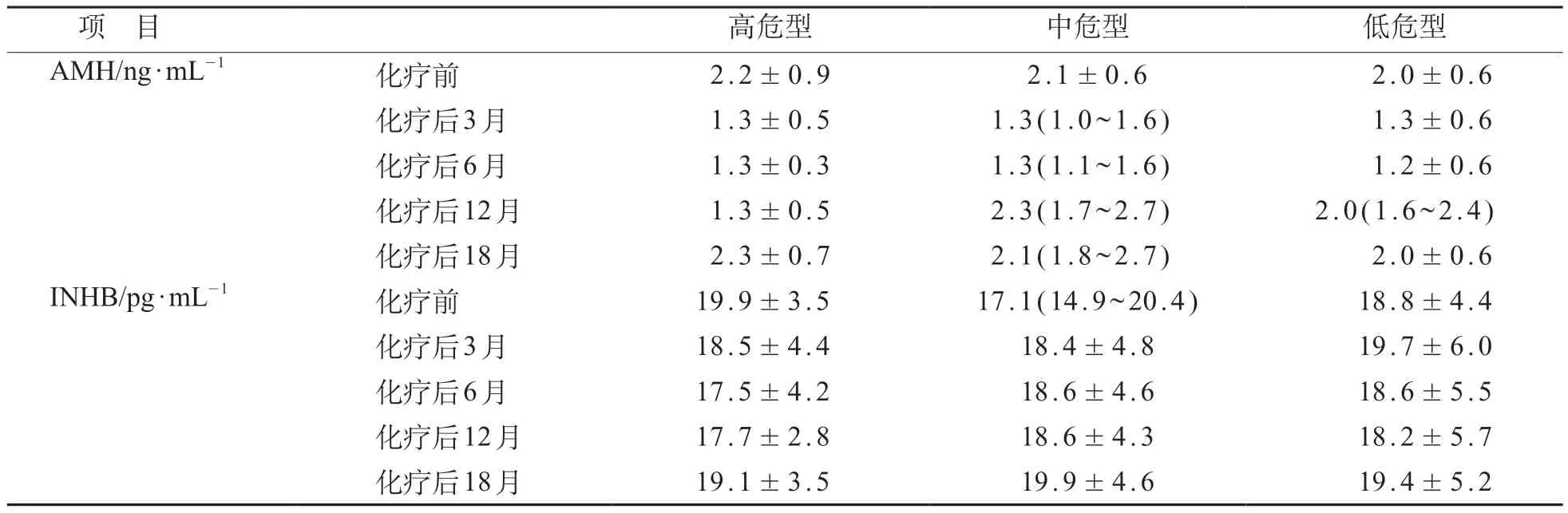
表3 ALL女童化疗前、后血清AMH和INHB水平比较分析
3 讨论
本研究将ALL儿童化疗前血清AMH、INHB和性激素水平与正常对照组相比,结果并无统计学差异,提示ALL本身不会显著改变AMH和INHB水平。对健康儿童性激素调查显示,不同性别、不同年龄组间的性激素水平存在显著差异,新生婴儿期和青春期变化波动较大,而幼儿期至学龄期则相对稳定[9]。本研究对象年龄跨度较大(1~9 岁),与年龄进行相关性分析,提示女童血清AMH水平随年龄增长有升高趋势,而男童血清AMH和INHB随年龄增长呈下降趋势。同时,女童组血清AMH、INHB水平均显著低于男童组,而FSH 高于男童组,与已报道的性激素参考值调查结果相似[10]。因此,本研究分析化疗对ALL患儿性腺功能激素指标的影响,比较同一个体化疗前后血清AMH、INHB水平变化,能减少年龄和性别相关的个体差异造成的组间偏倚,能更客观反映化疗期间性腺功能的损伤。
ALL 治疗与霍奇金淋巴瘤和骨盆/腹部实体肿瘤相比,烷基化剂等化疗剂量和放疗强度相对较小,对于青春期前儿童,白血病化疗是否导致其性腺功能损伤,尚不明确。本研究对ALL 儿童化疗前、后AMH 和INHB 激素指标进行分析,结果表明尽管ALL儿童尚处于青春前期,SCCLG-ALL-2016化疗仍可导致其性腺功能激素指标改变,而且化疗对高危型的影响程度高于低、中危型,提示ALL患儿在化疗期间性腺功能存在不同程度的损伤,与国外最近研究结果[11]相一致。长期临床随访显示,儿童期因白血病、实体肿瘤接受高剂量放化疗的男性患儿,成年后发生无精或少精症的比例高达80.2%~92.6%,性功能明显较正常人差[12]。女性发生卵巢早衰性不孕风险增加,或者虽然能够自然受孕,但存在月经不规则,性腺激素紊乱,窦卵泡数较低等情况[13],提示卵巢储备功能下降和“生育窗口期”缩短。在ALL治疗目标达到临床缓解,进而提高生活质量的今天,生育能力的保存是至关重要的,化疗可能导致性腺潜在的损伤应充分告知。
ALL化疗方案中环磷酰胺作为双功能烷化剂和细胞周期非特异性药物,在临床治疗中的生殖毒性是决定性腺损伤的关键因素。研究表明,环磷酰胺通过上调卵母细胞PTEN/PI3K/Akt信号通路,启动卵泡的募集和生长,最终导致卵巢卵泡储备的集体闭锁-耗尽[14]。其他细胞抑制剂,如阿糖胞苷或阿霉素,虽然实质上对性腺功能的毒性较小,但可损伤DNA,通过卵母细胞和原始卵泡颗粒细胞凋亡等不同机制导致卵泡闭锁[15-16]。一项利用人卵巢异种移植模型,对原始卵泡卵母细胞进行单细胞测序结果显示,注射环磷酰胺后12h,即可出现原始卵泡DNA损伤显著增加和细胞凋亡高峰,导致卵巢储备大量丧失[17]。动物实验证明环磷酰胺可诱导小鼠睾丸所有阶段的生殖细胞凋亡,以精原细胞和精母细胞最为显著[18-19]。环磷酰胺一方面对睾丸支持细胞(sertoli cells,SC)具有明显的氧化应激损伤作用,损害睾丸生精细胞形成精子所依赖的微环境,继而干扰SC细胞内分泌功能,抑制INHB 等精原细胞生长因子的分泌功能,导致未成熟睾丸损伤;另一方面通过对睾丸组织信号传导通路的损伤,诱导已经分化的精原细胞及精母细胞显著凋亡,并干扰“幸存”的未分化精原细胞的正常增殖及分化,最终导致无精、少精症和精子质量下降[20]。
ALL 的临床危险度分为低危、中危和高危型组。烷基化剂等化疗药物剂量和疗程在不同的危险组之间有差异,其生殖毒性大小和性腺功能损伤程度不一。SCCLG-ALL-2016 化疗方案中低危型组环磷酰胺累积剂量2 g/m2,中危型组3 g/m2,而高危型组使用的环磷酰胺剂量高达5 g/m2。环磷酰胺的性腺毒性依赖于剂量,但其导致性腺损伤的临界剂量尚未确定。对ALL 儿童化疗后长期幸存者的精液质量和生育能力研究显示,<10 g/m2的环磷酰胺累积剂量(联合预防性颅照射)治疗男性癌症幸存者时,未能观察到精液质量和激素水平的变化[21]。而其他研究发现,环磷酰胺总剂量为5.0~7.5 g/m2时精液参数即可发生异常[22-23]。本研究结果显示,女童和男童低危、中危和高危型3组均分别出现血清AMH和INHB水平下降,而高危型组下降程度和持续时间更长。提示高危型组患儿接受了更高强度的化疗,对性腺功能的影响更为明显,应重视对其远期性腺功能的随访观察。低危、中危型组虽然环磷酰胺累积剂量较低,但与其他性腺毒性细胞抑制剂联用,仍存在性腺功能紊乱的可能。
另外,本研究发现,ALL女童化疗后血清AMH水平出现明显下降,但在12~18 月后能恢复至化疗前水平,而男童则在相同时间内未观察到INHB水平回升。与成年乳腺癌患者化疗结束6 个月后,AMH 未恢复至基线水平相比[24],化疗后女童卵巢储备功能似乎具有一定的恢复代偿机制。有研究报道,ALL 女童治疗后的时间间隔与血清AMH 水平呈正相关,化疗结束10 年以上女性AMH 水平明显高于10年以下者,提示女童卵巢功能存在部分恢复的可能[11]。未成熟女性AMH 水平随着卵泡的生长而升高,在生殖早期,尽管原始卵泡池下降,生长卵泡数量和AMH 水平却保持相对稳定,表明维持生长卵泡数量恒定的补偿机制是存在的,提示青春前期女童卵子储蓄池功能大于成年女性,推测其对化疗的敏感性低于成年期女性[25]。另外,新近病例报告描述了同卵双胞胎姐妹均接受白血病化疗和骨髓移植后截然不同的生育结果,姐姐在2 岁诊断治疗,27 岁时自然受孕并顺产一个健康女婴;而妹妹则在青春期月经初潮后(15岁)诊断治疗,10年后复发接受再次化疗和骨髓移植,28岁发生卵巢早衰而不孕[13],推断青春期前的状态对卵巢衰竭起到了保护作用。
目前研究表明,生殖细胞和组织(卵细胞、精子、卵巢和睾丸组织)在超低温条件下能长期存活。恶性肿瘤患者化疗前,可采用冻存胚胎、生殖细胞和组织等方法保留生育能力,待化疗结束后再行胚胎着床、生殖细胞受孕或生殖组织再植[26]。另有研究表明,促性腺激素释放激素激动剂(GnRHa)可抑制成熟女性下丘脑-垂体-卵巢轴功能,保持在青春前期状态,对肿瘤患者化疗后卵巢功能具有一定的保护作用。针对化疗所致生殖细胞凋亡信号通路的关键基因或蛋白抑制剂的新药研发也是热点。然而,目前针对青春前期患儿生育潜能的保护,仍面临诸多技术难题和伦理挑战,需要多学科通力合作以提高生存率和保护生育力。
综上,本研究比较不同强度的化疗对ALL儿童性腺功能激素指标的影响,提示ALL 儿童在化疗期间性腺功能存在不同程度的损伤。血清AMH 和INHB对ALL儿童化疗后短期内性腺损伤的监测评估具有临床意义,对如何在治疗癌症的同时最大限度地保护性腺功能具有积极意义。化疗后随访时间短,是本研究的不足之处,有待进一步采用多中心前瞻性研究,并延长随访时间,进一步明确儿童期ALL 化疗对青春发育、远期性腺功能损伤和成年后孕育等临床结局影响。

