外源神经递质5-羟色胺(5-HT)和多巴胺(DA)调控三疣梭子蟹争斗行为的初步研究*
吴 波 张 顺 张 成 母昌考 徐善良, 2① 王丹丽①
外源神经递质5-羟色胺(5-HT)和多巴胺(DA)调控三疣梭子蟹争斗行为的初步研究*
吴 波1张 顺1张 成1母昌考1徐善良1, 2①王丹丽1①
(1. 宁波大学海洋学院 浙江宁波 315211; 2. 海洋生物技术教育部重点实验室 浙江宁波 315211)
影响甲壳类动物争斗行为的因素包括性别差异、体型和生殖状态等, 神经递质对甲壳动物的争斗行为也具有调控作用。为探索三疣梭子蟹在养殖和繁殖过程中由于争斗行为受损或死亡的行为机制, 采用双抗体夹心法测定争斗前后三疣梭子蟹血淋巴中5-HT和DA的含量, 并分析了争斗前后肌肉、胸神经节、肝胰腺三种组织中5-HT和DA受体基因表达量变化。同时, 通过注射外源5-HT和DA, 记录并分析了三疣梭子蟹争斗行为差异以及三种组织中5-HT和DA受体基因表达量变化。结果表明: (1) 争斗后三疣梭子蟹血淋巴中5-HT含量显著升高, DA含量显著降低(<0.05); (2) 注射10–6mol 5-HT能显著减少三疣梭子蟹的争斗行为发生次数以及争斗持续时间(<0.05), 而注射10–6mol DA却能够显著增加三疣梭子蟹的争斗行为发生次数和争斗持续时间(<0.05); (3) 争斗前后5-HT和DA受体在肌肉和胸神经节中表达量发生显著变化(<0.05), 且不同受体在相同组织中未呈现相同的变化趋势; (4) 注射外源DA能够调节、、受体的表达水平(<0.05), 外源5-HT也能调节和受体的表达水平(<0.05)。综上所述, 外源5-HT对三疣梭子蟹争斗行为起抑制作用, 而DA对三疣梭子蟹争斗行为起促进作用。同时, 外源5-HT和DA也会引起相关受体表达量变化, 且它们之间存在相互作用。
三疣梭子蟹; 争斗行为; 5-HT/DA;受体
“争斗行为”指的是同种动物个体间为获得食物、配偶或庇护所等资源在相遇时发生争斗的行为, 是一种典型的社会行为(李玉全等, 2013)。甲壳动物由于具有强大的螯足, 种群内争斗行为往往表现得尤为突出, 严重影响其养殖过程中的存活率(李艺等, 2019)。而影响甲壳类动物争斗行为的因素有很多, 包括性别差异(Tina, 2018)、体型(Hamasaki, 2018)和生殖状态(Costa, 2016)等。此外, 有研究表明神经递质对甲壳动物的争斗行为也具有调控作用(Zhu, 2018; Yang, 2019)。且争斗能力不同的甲壳动物体内神经递质含量也是不同的, 而神经递质含量的高低变化也会影响到甲壳动物个体的争斗能力(Huber, 2001; 赵玉超等, 2017)。而5-羟色胺(5-HT)和多巴胺(DA)作为两种重要的神经递质, 与甲壳动物争斗行为的调控密切相关(王芳等, 2020)。但是, 目前有关于5-HT和DA对三疣梭子蟹()争斗行为影响的研究较少。
5-羟色胺(5-HT)也称血清素(serotonin), 是一种广泛分布在脊椎动物和无脊椎动物体内的抑制性神经递质, 在摄食、睡眠和攻击性等调控过程中起着关键作用(Serretti, 2006)。同时, 5-HT也被认为是影响争斗行为的最主要的神经递质(Bortolato, 2013), 其他神经递质可能是先通过影响5-HT的含量变化来影响争斗行为(孔雀等, 2006)。赵玉超等(2017)研究发现通过注射外源5-HT能够有效降低日本囊对虾()、凡纳滨对虾()和中国明对虾()平均争斗次数。但也有研究表明, 5-HT可能不是直接对争斗行为起作用, 而是对大脑中枢的行为反应进行调节, 进而影响动物的争斗行为(Bacqué-Cazenave, 2018)。多巴胺(DA)是一种广泛分布于甲壳类动物体内的儿茶酚胺类神经递质, 也能够参与甲壳动物的运动能力和争斗行为的调节(Zhu, 2018)。此外, 5-HT和DA需要与突触前膜、突触后膜的多种受体进行结合才能发挥作用(段云峰等, 2013)。目前已经在虾蟹中发现存在多种5-HT和DA受体, 这些受体大部分属于G蛋白偶联受体家族(Northcutt, 2016)。它们可以通过激活第二信使来调节5-HT和DA的释放, 进而影响甲壳动物的争斗行为(Lee, 2008; Rodgers, 2013)。
本研究以三疣梭子蟹为实验对象, 探究5-HT、DA与争斗行为间的关系。旨在了解5-HT和DA对三疣梭子蟹争斗行为的响应机制, 为进一步了解三疣梭子蟹争斗行为的分子机制和减少其养殖过程中的争斗伤亡提供一些理论依据。
1 材料与方法
1.1 实验三疣梭子蟹暂养
实验所用三疣梭子蟹()从宁波鄞州区瞻岐镇一养殖场获得, 挑选规格基本一致、体重为(90±10) g的肢体完整的健康雌雄个体, 置于水槽(85 cm×40 cm×25 cm)中单养。实验开始前在实验环境下适应一周, 以减少应激。所用海水为经沉淀、沙滤后的自然海水, 盐度为25.5±1.0, 水温为(26.0±1.0) °C, pH 7.7±0.3。每天18:00投喂缢蛏, 次日7:00清理残饵及粪便, 日换水1/2, 争斗当天停止投喂。
1.2 实验设计
采用“雄×雄”配对争斗, 分为注射5-HT与注射DA的实验组和对照组。实验组三疣梭子蟹5-HT/DA的注射量分别为10–6、10–8和10–10mol/只。另设三个对照组, 即注射等量0.85%无菌生理盐水(生理盐水组)、不注射的空白对照组以及规格一致的未争斗组, 每组9个重复。配对的两只蟹规格尽量一致, 分别在头胸甲上做白色标记。如图1所示, 实验开始启动摄像头, 先将两只蟹分别置于实验水槽两侧, 槽中间用不透明隔板隔开, 适应10 min后撤掉隔板, 记录两个体之间的争斗行为全过程, 实验拍摄时长为90 min, 超过实际争斗持续时间, 保证能够记录完整的争斗过程。
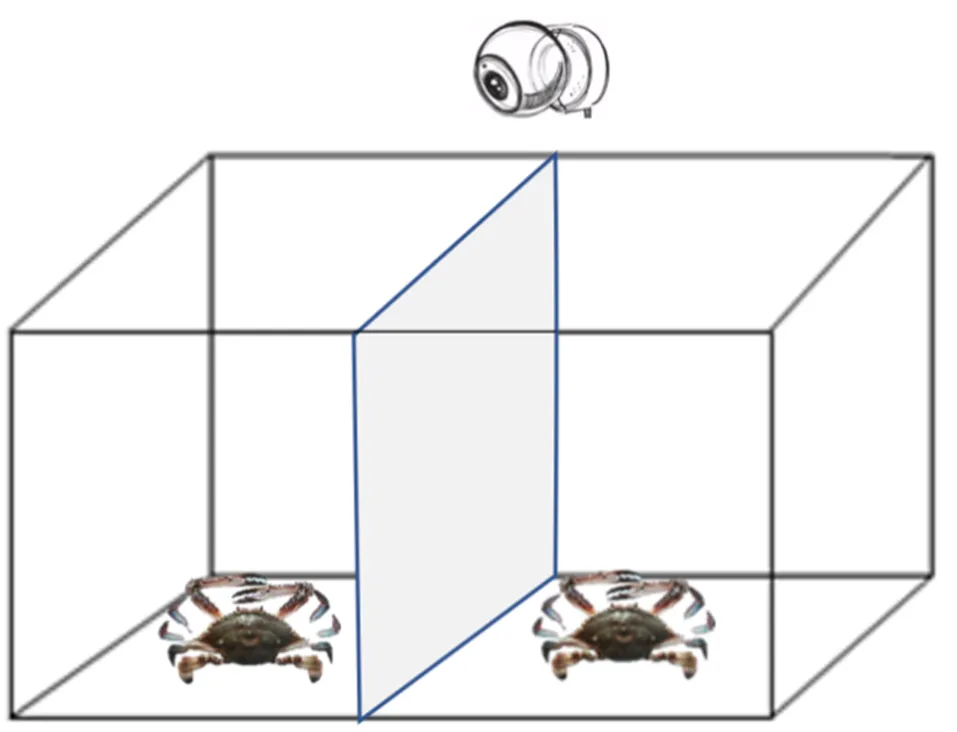
图1 三疣梭子蟹争斗实验装置图
注: 中间为不透明PVC板
1.3 5-HT和DA注射试剂准备
抗凝剂的配制: 应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂。
注射液的配制及剂量: 注射前, 将盐酸5-HT溶于0.85%无菌生理盐水配成浓度为5×10–3、5×10–5以及5×10–7mol/L的5-HT溶液, 同理配制浓度为5×10–3、5×10–5和5×10–7mol/L的DA溶液。注释剂量及方法根据前人的研究确定(Zhu, 2018; Yang, 2019)。
1.4 注射实验
两个实验组分别在蟹游泳足的关节膜注射0.2 mL 5-HT溶液或DA溶液。5-HT注射量为10–6、10–8和10–10mol/只, DA注射量为10–6、10–8和10–10mol/只, 生理盐水组则注射等量生理盐水。有研究表明, 外源5-HT注射后能够迅速分布整个血淋巴, 大部分在5min内能够被组织吸收(Tierney, 2001)。注射后的两只蟹同样分别置于实验水槽两侧, 槽中间用不透明隔板隔开, 适应10 min后撤掉隔板。同时, 参考Zhu等(2018)的研究, 外源DA的效果能够持续2 h左右, 满足实验需要。
1.5 视频分析与数据采集
通过红外摄像与视频逐帧回放技术, 记录并统计各组蟹的争斗行为发生次数、持续时间, 对争斗行为进行量化分析。当一只螃蟹朝向另一只螃蟹靠近或两只蟹同时向对方移动视为争斗开始, 当争斗中两只蟹超过5 min未互动视为争斗结束, 从争斗开始到争斗结束的时间即为争斗持续时间。统计争斗持续时间内争斗行为发生次数, 争斗行为的定义如表1所示。

表1 三种争斗行为的描述
1.6 血淋巴和组织的采集
首先, 选取规格一致的未争斗个体直接取样, 而未注射个体以及注射个体待争斗结束后立即取样。取样时将蟹置于冰盘上, 用1 mL注射器预先吸入预冷抗凝剂, 再从游泳足基部抽取0.1 mL血淋巴, 4 000 r/min离心20 min, 取上清; 另取肌肉、肝胰腺、胸神经节3种组织样品, 放入加有RNA保护液的1.5 mL无酶离心管中, 用以提取RNA, 并置于–80 °C保存。
1.7 5-HT、DA含量检测
使用上海科兴有限公司生产的蟹酶联免疫分析(ELISA)试剂盒, 应用双抗体夹心法测定蟹血淋巴中5-HT和DA水平。
1.8 RT-qPCR分析
利用TRIzol法提取总RNA并合成第一链cDNA, 具体操作参考HiFiscript cDNA第一链合成试剂盒(康为)。在NCBI上查找与三疣梭子蟹相近物种的、、、、基因序列, 找到凡纳滨对虾和中华绒螯蟹()的相关基因并利用DNAMAN进行序列对比, 根据同源性高的区域。利用primier5.0设计特异性引物后PCR获得三疣梭子蟹相关基因核心片段。根据核心序列设计实时荧光定量PCR引物, 并检测5-HT、DA上述受体基因的表达水平。目的基因进行Real-time qPCR的反应条件与内参基因一致。数据采集在Roche LC480上进行, 反应结束后确定Real-time qPCR的扩增曲线和熔解曲线。数据处理采用2–ΔΔCt法, 且用SPSS 19.0软件进行数据统计分析。实验所用引物序列见表2。
1.9 数据处理与统计分析
采用SPSS19.0软件进行单因子方差分析(one-way ANOVE), 比较分析各组间的差异, 使用Excel软件作图, 以上标小写字母不同表示具有显著性差异(<0.05)。

表2 实验中用到的引物列表
2 结果
2.1 争斗前后血淋巴中5-HT、DA含量变化
争斗前后三疣梭子蟹血淋巴中5-HT和DA含量均存在显著性差异。争斗后三疣梭子蟹血淋巴中5-HT含量呈显著上升趋势(<0.05), 比争斗之前的上升19.5%; DA含量则呈现显著下降的趋势(<0.05), 比争斗之前下降11.3%, 如图2所示。
2.2 5-HT和DA对争斗行为的影响
注射外源5-HT和DA对三疣梭子蟹争斗行为发生次数的影响见表3。与生理盐水组或对照组相比, 注射10–6mol/只5-HT组三疣梭子蟹的夹击、击打和推搡发生次数都显著减少(<0.05)。而与生理盐水组相比, 注射10–8mol/只5-HT和10–10mol/只5-HT组三疣梭子蟹仅击打和推搡发生次数显著降低(<0.05), 而夹击次数无明显变化(>0.05)。同时, 与生理盐水组或对照组相比, 注射10–6mol/只 DA组三疣梭子蟹的夹击, 击打和推搡发生次数都显著增多(<0.05), 而注射10–8mol/只DA组和10–10mol/只DA组三疣梭子蟹的争斗行为发生次数则无明显变化(>0.05)。
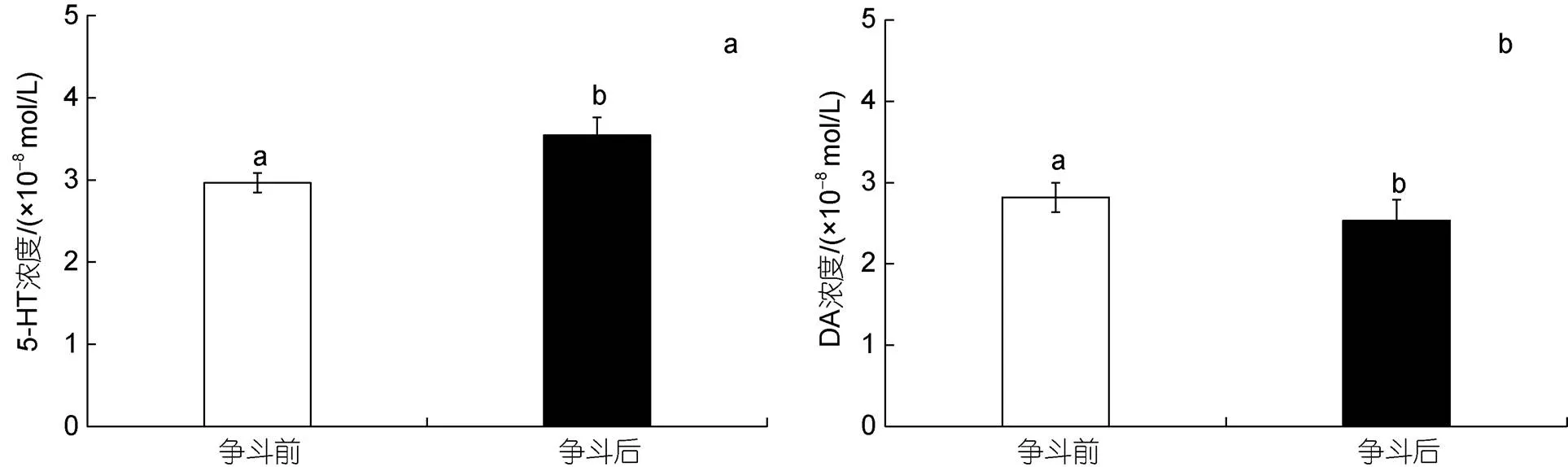
图2 争斗前后血淋巴中5-HT (a)和DA (b)含量变化

表3 注射5-HT和DA对争斗行为发生次数的影响
注: 表中同列不同行上标字母不同表示存在显著差异(<0.05)
此外, 如图3所示, 注射10–6mol/只5-HT组相较于注射生理盐水组三疣梭子蟹的争斗时间减少了约26%, 仅持续约38 min, 存在显著性差异(<0.05), 相较于空白对照组三疣梭子蟹的争斗时间缩短了约24%, 存在显著性差异(<0.05), 而注射10–8mol/只5-HT组和10–10mol/只5-HT组三疣梭子蟹的争斗时间则无明显变化(>0.05); 注射10–6mol/只DA组相较于注射生理盐水组三疣梭子蟹的争斗时间分别增加了约20%, 超过60 min, 存在显著性差异(<0.05)。而注射10–8mol/只DA组和10–10mol/只DA组的争斗时间, 相较于生理盐水组有所增加, 但无显著差异(>0.05)。
2.3 争斗前后5-HT和DA受体基因表达分析
利用实时荧光定量PCR分别检测未注射的三疣梭子蟹争斗前后5-HT和DA相关受体基因在肌肉、肝胰腺和胸神经节中的表达分析。结果如图4所示, 争斗后mRNA表达量在仅肌肉中显著增强(<0.05, 图4a), 在胸神经节中有降低趋势, 但无显著变化(>0.05, 图4a)。mRNA表达量在肌肉和胸神经节中均显著降低(<0.05, 图4b)。而mRNA表达量仅在胸神经节中显著增强(<0.05, 图4c), 在肌肉中无明显变化(>0.05, 图4c)。争斗后,和mRNA表达量在肌肉中显著增强(<0.05, 图4d, 4e), 在胸神经节中显著降低(<0.05, 图4d, 4e)。

图3 注射5-HT和DA对争斗时间的影响

图4 争斗前后5-HT和DA受体基因在不同组织中的表达分析
注: a:, b:, c:, d:, e:
2.4 注射后5-HT和DA相关受体基因的表达分析
对5-HT和DA相关受体基因在对照组、生理盐水组、10–6mol/只5-HT和10–6mol/只DA组的肌肉和胸神经节中的相对表达量进行分析分析。结果表明, 10–6mol/只5-HT注射后, 肌肉和胸神经节中和mRNA表达量均显著降低(<0.05, 图5a, 5c), 而mRNA表达量在肌肉和胸神经节中均无显著变化(>0.05, 图5b)。同时, 注射5-HT后,mRNA表达量在肌肉中显著降低(<0.05, 图5d), 在胸神经节中无显著变化(>0.05, 图5d)。而mRNA表达量在肌肉中显著降低(<0.05, 图5e), 在胸神经节中显著升高(<0.05, 图5e)。在10–6mol/只DA注射后,mRNA表达量在肌肉中显著降低(<0.05, 图5a), 但在胸神经节中无显著变化(>0.05, 图5a)。而和mRNA表达量在肌肉中均显著降低(<0.05, 图5b, 5c), 在胸神经节中显著升高(<0.05, 图5b, 5c)。在注射DA后,mRNA表达量在肌肉中显著降低(<0.05, 图5d), 在胸神经节中无明显变化(>0.05, 图5d)。而mRNA表达量在胸神经节中显著升高(<0.05, 图5e), 在肌肉则显著降低(<0.05, 图5e)。以上结果表明注射5-HT和DA会引起相应受体表达量的变化, 进而参与三疣梭子蟹争斗行为的调节。
3 讨论
3.1 5-HT和DA对争斗行为的影响
5-HT和DA作为神经调节剂能够参与甲壳动物争斗行为的调控。有研究表明, 5-HT和DA能够通过G-蛋白偶联受体调节环磷酸腺苷(cAMP)的释放, 进而影响个体的争斗行为(Momohara, 2013), 而两者对争斗行为的影响也不相同。Pang等(2019)对中华绒螯蟹的研究发现, 5-HT和DA之间存在一定的拮抗作用。同样, 本实验结果发现, 三疣梭子蟹争斗后血淋巴中5-HT的含量显著上升, 而DA的含量则显著降低, 存在相反的变化趋势。以上结果均表明5-HT和DA之间可能存在拮抗作用, 但两者对争斗行为的确切影响还需要进一步研究。因此, 本研究通过注射不同浓度的5-HT和DA来进一步探究两者对三疣梭子蟹争斗行为的影响。我们发现注射10–6mol/只5-HT能够显著减少三疣梭子蟹的争斗时间和争斗行为的发生次数, 而注射10–6mol/只DA后三疣梭子蟹的争斗时间和争斗行为发生次数则都显著减少。这些结果表明5-HT对三疣梭子蟹争斗行为起抑制作用, 而DA对三疣梭子蟹争斗行为起促进作用。

图5 注射5-HT和DA后相关受体基因在不同组织中的表达分析
注. a:; b.; c.; d:; e.
因此, 从本实验结果来看, 5-HT和DA作为神经递质参与了三疣梭子蟹的争斗行为, 并分别对三疣梭子蟹争斗行为起到了抑制和促进作用。如果在实际养殖过程中, 通过提高三疣梭子蟹体内5-HT含量或降低DA含量, 从而减少其争斗现象的发生, 以达到提高产量的目的。例如已有研究学者通过给拟穴青蟹()饲喂色氨酸(TRP)来增加血淋巴中5-HT的含量, 从而抑制争斗行为的发生, 提高个体的存活率(Laranja, 2010)。
3.2 5-HT和DA相关受体基因参与三疣梭子蟹争斗行为的调控
遗传因素也是影响甲壳动物争斗行为的关键。5-HT和DA都是脊椎动物和无脊椎动物中高度保守的神经递质, 5-HT和DA相关受体在甲壳类动物中也高度保守。已有研究表明虾蟹中存在5-HT和DA受体, 且能够参与争斗行为的调节(Yang, 2019)。徐泽文等(2015)克隆了中华绒螯蟹()和受体基因片段。而De Boer等(2005)将5-HT受体家族中与争斗行为密切相关的和受体基因敲除时, 发现褐家鼠()的攻击行为显著增加。5-HT和DA受体包含多种类型, 且不同的5-HT和DA受体具有不同的表达机制, 其调控机理尚不清晰(Briffa, 2007)。本实验结果显示,、、、和受体在不同组织中的表达量存在明显差异(图3)。在胸神经和肌肉组织中的表达量较高, 在肝胰腺中表达量较低且无明显变化。争斗前后5-HT和DA受体在肌肉和胸神经节中表达量发生显著变化, 表明其可能主要通过这两种组织发挥作用。5-HT和DA多个受体在相同组织中未呈现相同的变化规律, 表明各个受体在争斗行为中的作用可能是不同的。争斗前后5-HT和DA受体基因在肌肉和胸神经中变化明显, 这可能与争斗行为受神经系统调控, 而肌肉则是直接参与争斗行为的发生有关。不同受体在争斗过程中发挥作用不同且在不同的组织中的作用也不同, 这方面还有待于进一步研究。
5-HT和DA通过与鸟嘌呤核苷酸结合和G蛋白偶联受体蛋白相互作用介导许多社会行为(Weitekamp, 2017)。本研究也证实了注射5-HT和DA可以调节肌肉和胸神经节中、、、和受体的表达水平(图5)。表明5-HT和DA可能通过其相应受体来参与争斗行为的调节。同时, 我们也发现DA能够调节、、受体的表达水平(图5a, 5b, 5c),和受体的表达水平也受到5-HT的调节(图5d, 5e)。这也证实了5-HT和DA之间存在相互作用。为进一步验证5-HT和DA相关受体参与争斗行为的调节, Pang等(2019)通过向中华绒螯蟹体内注射抑制剂(ketanserin)和受体激动剂[R(−)-TNPA]来验证它们对争斗行为的影响, 发现抑制的活性, 能够减少中华绒螯蟹的争斗行为, 而激活受体能够显著降低中华绒螯蟹的争斗行为。相反, Johnson等(2009)对黑腹果蝇()争斗行为的研究发现, 激活受体同样也会降低个体的争斗行为。Guo等(2015)也发现注射拮抗剂或iRNA敲除受体, 会增加东亚飞蝗()的运动能力。以上结果进一步证实和受体参与甲壳动物争斗行为的调节, 但对不同甲壳动物的调节存在种间差异性。这也与我们的研究发现相一致, 但更清晰的关系还需要进一步探索。
4 结论
本研究结果表明, 外源5-HT对三疣梭子蟹争斗行为起抑制作用, 而DA对三疣梭子蟹争斗行为起促进作用。同时, 外源5-HT和DA会引起相关受体表达量变化, 进而参与三疣梭子蟹争斗行为的调控, 且它们之间存在相互作用。
王芳, 刘晶晶, 刘大鹏, 2020. 甲壳动物争斗行为研究进展[J]. 中国海洋大学学报, 50(2): 31-36.
孔雀, 邰发道, 2006. 攻击行为神经机制的研究进展[J]. 现代生物医学进展, 6(8): 55-58.
李艺, 李晓东, 2019. 甲壳动物攻击行为的研究进展[J]. 水产科学, 38(3): 428-434.
李玉全, 孙霞, 2013. 水生动物的争胜行为[J]. 动物学研究, 34(3): 214-220.
赵玉超, 秦浩, 李娜, 等, 2017. 神经递质多巴胺(DA)和5-羟色胺(5-HT)对三种主要养殖对虾争胜行为的影响[J]. 海洋与湖沼, 48(3): 628-633.
段云峰, 吴晓丽, 王涛, 等, 2013. 五羟色胺和多巴胺与攻击行为的关联研究进展[J]. 生命科学, 25(10): 1027-1035.
徐泽文, 杨筱珍, 黄坚, 等, 2015. CODEHOP法设计引物克隆中华绒螯蟹5-ht和5-ht受体基因片段及序列分析[J]. 生物学杂志, 32(1): 1-5.
BACQUÉ-CAZENAVE J, CATTAERT D, DELBECQUE J P,, 2018. Serotonin has opposite effects on the aggressiveness of crayfish, facing either a smaller or a larger rival: alteration of size perception [J]. Journal of Experimental Biology, 221(12): jeb177840.
BORTOLATO M, PIVAC N, SELER D M,, 2013. The role of the serotonergic system at the interface of aggression and suicide [J]. Neuroscience, 236: 160-185.
BRIFFA M, ELWOOD R W, 2007. Monoamines and decision making during contests in the hermit crab[J]. Animal Behaviour, 73(4): 605-612.
COSTA J R, DALOSTO M M, PALAORO A V,, 2016. Contest duration and dynamics are affected by body size in a potentially subsocial crayfish (Crustacea: Decapoda) [J]. Ethology, 122(6): 502-512.
DE BOER S F, KOOLHAAS J M, 2005. 5-HT1Aand 5-HT1Breceptor agonists and aggression: a pharmacological challenge of the serotonin deficiency hypothesis [J]. European Journal of Pharmacology, 526(1/3): 125-139.
GUO X J, MA Z Y, KANG L, 2015. Two dopamine receptors play different roles in phase change of the migratory locust [J]. Frontiers in Behavioral Neuroscience, 9: 80.
HAMASAKI K, SUGIYAMA A, JINBO T,, 2018. The influence of male size on competitive mating success in the Japanese spiny lobster(von Siebold, 1824) (Decapoda: Palinuridae): implications for broodstock management techniques [J]. Journal of Crustacean Biology, 38(4): 393-400.
HUBER R, PANKSEPP J B, YUE Z,, 2001. Dynamic interactions of behavior and amine neurochemistry in acquisition and maintenance of social rank in crayfish [J]. Brain, Behavior and Evolution, 57(5): 271-282.
JOHNSON O, BECNEL J, NICHOLS C D, 2009. Serotonin 5-HT2and 5-HT1A-like receptors differentially modulate aggressive behaviors in[J]. Neuroscience, 158(4): 1292-1300.
LARANJA J L Q, QUINITIO E T, CATACUTAN M R,, 2010. Effects of dietaryL-tryptophan on the agonistic behavior, growth and survival of juvenile mud crab[J]. Aquaculture, 310(1/2): 84-90.
LEE S H C, TAYLOR K, KRASNE F B, 2008. Reciprocal stimulation of decay between serotonergic facilitation and depression of synaptic transmission [J]. Journal of Neurophysiology, 100(2): 1113-1126.
MOMOHARA Y, KANAI A, NAGAYAMA T, 2013. Aminergic control of social status in crayfish agonistic encounters [J]. PLoS One, 8(9): e74489.
NORTHCUTT A J, LETT K M, GARCIA V B,, 2016. Deep sequencing of transcriptomes from the nervous systems of two decapod crustaceans to characterize genes important for neural circuit function and modulation [J]. BMC Genomics, 17(1): 868.
PANG Y Y, SONG Y M, ZHANG L,, 2019. 5-HT2B, 5-HT7, and DA2 receptors mediate the effects of 5-HT and DA on agonistic behavior of the Chinese mitten crab () [J]. ACS Chemical Neuroscience, 10(11): 4502-4510.
RODGERS E W, KRENZ W D, JIANG X Y,, 2013. Dopaminergic tone regulates transient potassium current maximal conductance through a translational mechanism requiring D1Rs, cAMP/PKA, Erk and mTOR [J]. BMC Neuroscience, 14(1): 143.
SERRETTI A, CALATI R, MANDELLI L,, 2006. Serotonin transporter gene variants and behavior: a comprehensive review [J]. Current Drug Targets, 7(12): 1659-1669.
TIERNEY A, MANGIAMELE L, 2001. Effects of serotonin and serotonin analogs on posture and agonistic behavior in crayfish [J]. Journal of Comparative Physiology A, 187(10): 757-767.
TINA F W, JAROENSUTASINEE M, KEERATIPATTARAKARN K,, 2018. Sex and burrow/chimney ownership affecting time allocation for surface activities in(Tweedie, 1937) (Brachyura, Ocypodidae) [J]. Crustaceana, 91(1): 51-62.
WEITEKAMP C A, NGUYEN J, HOFMANN H A, 2017. Social context affects behavior, preoptic area gene expression, and response to D2 receptor manipulation during territorial defense in a cichlid fish [J]. Genes, Brain and Behavior, 16(6): 601-611.
YANG X Z, PANG Y Y, HUANG G Y,, 2019. The serotonin or dopamine by cyclic adenosine monophosphate-protein kinase A pathway involved in the agonistic behaviour of Chinese mitten crab,[J]. Physiology & Behavior, 209: 112621.
ZHU F, FU Y Y, MU C K,, 2018. Molecular cloning, characterization and effects of catechol--methyltransferase (comt) mRNA and protein on aggressive behavior in the swimming crab[J]. Aquaculture, 495: 693-702.
PRELIMINARY STUDY ON THE REGULATION OF AGONISTIC BEHAVIOR OFBY EXOGENOUS 5-HT AND DA
WU Bo1, ZHANG Shun1, ZHANG Cheng1, MU Chang-Kao1, XU Shan-Liang1, 2, WANG Dan-Li1
(1. School of Marine Science, Ningbo University, Ningbo 315211, China; 2. Key Laboratory of Applied Marine Biotechnology, Ministry of Education, Ningbo University, Ningbo 315211, China)
To explore the behavioral mechanism of damage or death ofdue to agonistic behavior during culture and reproduction, contents of 5-HT and DA in hemolymph ofbefore and after fight were determined by double antibody sandwich method, and the changes of 5-HT and DA receptor gene expression in muscle, thoracic ganglion, and hepatopancreas before and after fight were analyzed. Meanwhile, the difference of agonistic behavior and the changes of 5-HT and DA receptor gene expression in the three tissues were recorded and analyzed by injecting exogenous 5-HT and DA. Results show that, after fighting, the content of 5-HT in hemolymph ofincreased significantly, while the content of DA decreased significantly (<0.05). Injection of 10–6-mol 5-HT could significantly reduce the frequency and duration of agonistic behavior (<0.05), while injection of 10–6-mol DA could significantly increase the frequency and duration of agonistic behavior of(<0.05). The expression of 5-HT and DA receptor in muscle and thoracic ganglion changed significantly before and after fight, and different receptors did not show the same trend in the same tissue. Exogenous 5-HT could also regulate the expression ofandreceptors, and exogenous DA could regulate the expression of,, andreceptors. Therefore, 5-HT can inhibit the agonistic behavior of, while DA can promote the agonistic behavior. In addition, 5-HT and DA receptor genes can participate in the regulation of agonistic behavior ofthrough 5-HT/DA, interactively.
; agonistic behavior; 5-HT/DA;receptor
S967; Q958.12
10.11693/hyhz20210600132
*浙江省重大科技专项, 2019C02057号; 国家自然科学基金项目, 42076087号。吴 波, 硕士研究生, E-mail: 1035757132@qq.com
徐善良, E-mail: xushanliang@nbu.edu.cn; 王丹丽, E-mail: wangdanli@nbu.edu.cn
2021-06-08,
2021-08-13

