支气管肺泡灌洗术联合局部应用敏感抗菌药物对COPD合并支气管扩张患者血气分析、炎症因子及肺功能的影响*
曹洪丽,于 红,石曼欣妤,木亚莎尔·吐逊江,阮昱豪,席家宁△
1.首都医科大学附属北京康复医院呼吸科,北京 100144;2.首都医科大学北京康复医学院,北京 100144
慢性阻塞性肺疾病(COPD)是以持续、进行性发展的气流受限为特征的呼吸系统疾病,包括急性加重期与稳定期,主要表现为慢性咳嗽、咳痰、气短或呼吸困难,严重者可出现肺源性心脏病、呼吸衰竭,致残率和病死率较高,严重影响患者的生存质量。支气管扩张是以支气管不可逆性扩张为特征的呼吸系统疾病,可能与慢性炎症和纤维化影响支气管壁的肌肉及弹性组织有关,最终引起支气管的变形与长期扩张。以往认为COPD与支气管扩张之间的相关性不大,但近年来发现COPD合并支气管扩张患者在临床上并不少见,目前认为支气管扩张是COPD的并发症之一,二者不仅能共存,且相互作用,形成恶性循环,但目前国内相关的研究并不多[1-2]。对于COPD合并支气管扩张患者,以往临床上主要给予抗炎、解痉、化痰、平喘、吸氧等治疗,但疗效不甚理想,可能与痰液不易清除有关。本研究前瞻性选取2017年6月至2019年1月本院收治的62例COPD合并支气管扩张患者为研究对象,旨在探讨支气管肺泡灌洗术(BAL)联合局部应用敏感抗菌药物对COPD合并支气管扩张患者血气分析、炎症因子及肺功能的影响。
1 资料与方法
1.1一般资料 选取2017年6月至2019年1月本院收治的62例COPD合并支气管扩张患者为研究对象,其中男45例、女17例,年龄43~88岁、平均(67.33±18.00)岁。纳入标准:(1)符合2017年慢性阻塞性肺疾病全球创议更新解读中COPD的诊断标准[3];(2)符合成人支气管扩张症诊断专家共识编写组制定的专家共识中的诊断标准[4];(3)基础状态可,能耐受支气管镜检查。排除标准:(1)合并其他系统的感染;(2)合并哮喘、肺癌等其他肺脏疾病或有肺脏手术史;(3)心、肝、脑、肾等脏器的严重原发性疾病;(4)对所用的药物过敏。本研究已通过医院医学伦理委员会的批准,所有患者均签署相关的知情同意书。采用随机数字表法将患者分为观察组(31例)与对照组(31例),2组性别构成、年龄、病程比较,差异无统计学意义(P>0.05),具有可比性,见表1。
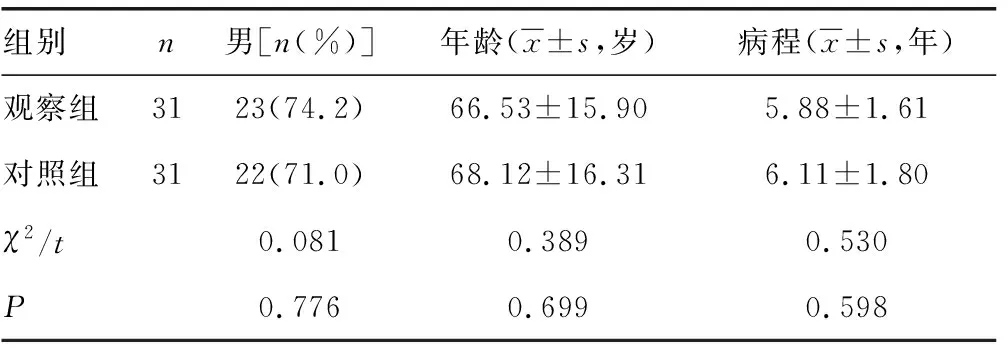
表1 2组一般资料比较
1.2方法 对照组:入院后进行血常规、血培养、痰培养、血气分析、肺功能等常规检查,同时行胸部高分辨率螺旋CT检查,初步确定感染部位,并给予静脉滴注敏感抗菌药物、吸氧、解痉、化痰、平喘、体位引流、无创呼吸机辅助通气等常规干预措施。观察组:在对照组基础上,采用日本奥林巴斯公司提供的BF260型电子支气管镜行BAL。常规进行术前准备、局部麻醉(2%利多卡因雾化吸入)与心电监测,经鼻腔插入纤维支气管镜,吸净呼吸道内的分泌物与痰液,留取痰液送检,然后根据术前胸部螺旋CT检查结果及支气管镜下所见来确定感染部位,然后针对性进行BAL,灌洗时每次灌入生理盐水(0.9%氯化钠注射液)10~20 mL,反复抽吸,每次持续时间不超过20 s,每次灌洗后应尽量吸净灌洗液与分泌物,直到病变处的分泌物被完全清除,总灌洗液≤120 mL,并且在灌洗后局部应用敏感抗菌药物,将抗菌药物注入病变的段或亚段支气管内,观察组患者每周BAL干预2~3次。全部患者干预2周后评估治疗情况。
1.3观察指标
1.3.1血气分析 分别在干预前、干预2周后采集所有患者桡动脉血2 mL,采用丹麦Radiometer公司生产的ABL80型血气分析仪检测动脉血氧分压(PaO2)、二氧化碳分压(PaCO2)及血氧饱和度(SaO2)。
1.3.2血清炎症因子 分别在干预前、干预2周后采集所有患者清晨空腹静脉血5 mL,以3 000 r/min离心5 min,取血清置于冰箱中保存待测。采用酶联免疫吸附试验检测白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、血清超敏C反应蛋白(hs-CRP)等炎症因子水平,全部操作均严格按照说明书进行操作。
1.3.3肺功能 在干预前、干预2周后采用日本福田产业株式会社生产的ST-130 肺通气功能检测仪检测所有患者的肺功能,包括肺活量(VC)、第一秒用力呼气容积(FEV1)与用力肺活量(FVC)。
1.3.4临床疗效 采用下列标准判断患者的临床疗效[5]:(1)显效,典型症状和体征基本消失,体温、血白细胞计数恢复正常,痰量明显减少,咳嗽、胸闷、气促明显好转,肺部啰音消失或减少,胸部CT提示气道炎症基本吸收,痰培养转为阴性;(2)有效,典型症状和体征有所改善,体温、血白细胞计数下降,痰量有所减少,咳嗽、胸闷、气促有所好转,肺部啰音减少,胸部CT提示气道炎症部分吸收;(3)无效:干预后患者临床症状、体征与肺功能指标无明显变化,或继续恶化。有效率=(显效例数+有效例数)/总例数×100%。
2 结 果
2.12组干预前后血气分析结果比较 2组干预前PaO2、PaCO2、SaO2差异均无统计学意义(P>0.05);2组干预后PaO2、SaO2均高于干预前,且观察组高于对照组(P<0.05),而PaCO2则低于干预前,且观察组低于对照组(P<0.05),见表2。
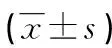
表2 2组患者干预前后的PaO2、PaCO2、SaO2比较
2.22组干预前后血清炎症因子水平比较 2组干预前血清IL-6、TNF-α、hs-CRP水平差异无统计学意义(P>0.05);2组干预后血清IL-6、TNF-α、hs-CRP水平均低于干预前,且观察组低于对照组(P<0.05),见表3。
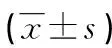
表3 2组干预前后血清IL-6、TNF-α、hs-CRP水平比较
2.32组干预前后肺功能比较 2组干预前VC、FEV1、FEV1/FVC差异无统计学意义(P>0.05);2组干预后VC、FEV1、FEV1/FVC均高于干预前,且观察组高于对照组,差异有统计学意义(P<0.05),见表4。
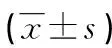
表4 2组干预前后VC、FEV1、FEV1/FVC比较
2.42组临床疗效比较 观察组临床疗效优于对照组,差异有统计学意义(P<0.05),见表5。
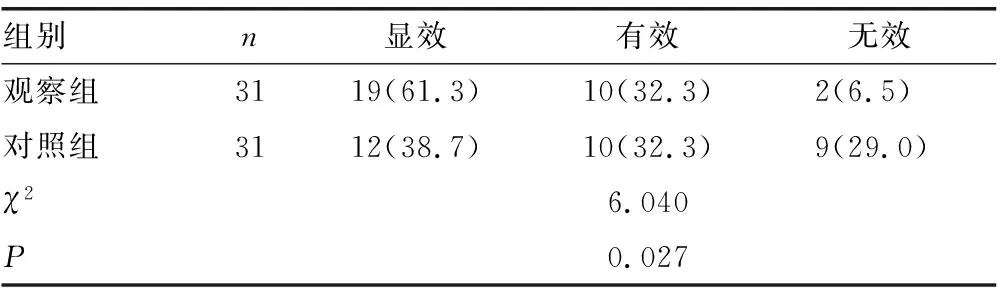
表5 2组临床疗效比较[n(%)]
3 讨 论
目前认为COPD与支气管扩张本质上都是呼吸系统的慢性炎症性疾病,二者可合并存在,相互作用,均可出现支气管的阻塞与感染,加重了咳嗽、咳痰、气促、呼吸困难等临床症状,肺功能更差,也加大了临床的治疗难度。气道的慢性炎性反应可通过多种介质来破坏支气管壁与肺组织的结构,促进支气管扩张的发生,同时也降低了气道纤毛上皮的清洁能力,进一步加重了感染,导致恶性循环,尤其是COPD晚期患者,其呼吸道黏膜容易出现萎缩性病变,从而促进支气管周围组织的增生与扩张。因此,抗炎一直是支气管扩张的重要治疗措施,但当前抗菌药物的滥用现象较为严重,且静脉用药难以在肺脏达到较高的药物浓度峰值,故临床上急需改善常规抗感染的方法。
随着内镜微创手术及器械的发展,纤维支气管镜已广泛用于呼吸系统疾病的诊治,除了能通过直接观察呼吸道来进行疾病的诊断外,还能进行直视下操作与治疗,其中BAL是通过纤维支气管镜对发生感染的肺叶或肺段进行反复的生理盐水冲洗,以清除呼吸道内的分泌物及痰液,改善支气管的阻塞现象。既往多个研究证实BAL对支气管扩张合并感染患者[6-10]、COPD急性加重期患者[11-12]、肺炎患者[13-15]的应用效果突出,能缓解炎性反应,提高临床疗效。但是,BAL仍有一定的缺点,包括操作复杂,患者容易出现不耐受现象。
本研究前瞻性选取了62例COPD合并支气管扩张患者为研究对象,采用随机数字表法将患者分为对照组(常规干预,31例)和观察组(BAL及局部应用敏感抗菌药物干预,31例)。干预后对照组血气分析、全身炎性反应与肺功能均有一定改善,而观察组的疗效更加突出,表现为干预后PaO2、SaO2、VC、FEV1、FEV1/FVC均明显高于对照组(P<0.05),PaCO2及血清IL-6、TNF-α、hs-CRP水平均明显低于对照组(P<0.05),并且观察组显效率达到61.3%,明显高于对照组的38.7%(P<0.05)。分析其原因,一方面是由于BAL能直接清洗残留在呼吸道的分泌物与痰液,同时刺激分泌物的排出,促进肺不张的恢复,通畅呼吸道,改善肺功能,提高SaO2,缓解临床症状体征;另一方面可能与其抗菌药物的局部应用有关,在灌洗结束后局部给予敏感的抗菌药物能提高药物在肺脏的浓度峰值,更高效地抑制或杀灭感染部位的细菌,减轻炎性反应,增强了抗感染的疗效,促进早日康复,改善耐药现象,且纤维支气管镜能直接观察呼吸道的病变特点与活动程度,获得被菌群污染较少的感染病变组织,更有效地实施痰培养及药敏试验,提高结果的准确性,以便更准确地发现感染病原体,筛选出敏感性较高的抗菌药物,提高抗炎疗效[16]。
综上所述,BAL联合局部应用敏感抗菌药物能改善COPD合并支气管扩张患者的血气分析结果,降低血清炎症因子水平,促进肺功能的康复,临床疗效明显,值得临床推广应用。

